江西铅山红芽芋试管苗染色制片技术优化研究
2014-04-02王艾平柯维忠林国卫吴燕芳易雪梅叶志康黄丽余琪肖淮宾
王艾平,柯维忠,林国卫,吴燕芳,易雪梅,叶志康,黄丽,余琪,肖淮宾
(上饶师范学院,江西 上饶 334001)
红芽芋(ColocasiaesculentaL. Schott var. cormosus cv. Hongyayu),是江西省铅山县传统优势产品,种植历史悠久,其品质鲜美、细腻,粉而不粘,口感好,且淀粉颗粒细小易被消化,品质风味居芋类之首[1]。研究表明,江西铅山红芽芋中碳水化合物含量较高,脂肪含量较低,蛋白质、维生素及矿物质元素含量丰富,营养全面,味香质滑,香醇可口,具有良好的食用价值和开发前景[2]。近十余年来,江西铅山红芽芋产业发展迅速,已成为铅山县农民增收致富的主导产业,铅山县也成为江西省最大的红芽芋生产基地[3]。近年来,国内外学者对红芽芋的栽培技术、组培快繁、种质保存等方面进行了较为广泛的研究[4-7],但对红芽芋细胞学研究报道甚少。植物染色体制片是进行植物学研究的基本技术,也是细胞分类学、染色体工程和植物育种学研究不可缺少的手段[8,9]。Belling(1921)提出植物染色体压片技术后,压片已成为植物染色体研究中最广泛应用的常规技术[10]。许多研究表明,在植物组织培养的继代过程中,试管苗容易发生染色体变异,其造成的影响有利有弊,有弊的是植物组织培养培育的试管苗不能保证原材料的遗传稳定性,有利的是这些变异可以用来培育和创制新品种。本实验拟探究不同因素对江西铅山红芽芋试管苗染色体制片效果的影响,旨在为江西铅山红芽芋的起源、演化及遗传育种提供理论依据。
1 材料与方法
1.1 材料
江西铅山红芽芋脱毒苗(由江西省江天农业科技有限公司提供)。
1.2 方法
在超净工作台内,将江西铅山红芽芋脱毒苗的单芽逐个分离,然后接到高温高压灭菌的液体培养基中
(MS+KT2mg/L+NAA0.1mg/L+30g/L蔗糖,pH=5.8),放入光照培养箱中培养(光照时间:14h/d;光照强度:1500-2000lx;温度:25±1℃;湿度:70-80%)。30d左右,待红芽芋试管苗幼根长至3~4cm后,于上午9~11时剪下根尖(0.5cm)和已展开的幼叶。将剪下的根尖和幼叶分别置于0.1%秋水仙素+0.002mol/L 8-羟基喹啉混合溶液中,于室温下浸泡预处理4h。用蒸馏水洗净处理过的材料,经卡诺氏固定液(乙醇:冰乙酸体积为3:1)固定24h,最后转入70%的酒精中,4℃保存备用。储存的根尖或幼叶用蒸馏水洗净后,置1mol/L的HCl中于60℃恒温水浴锅内分别解离10 min,再用蒸馏水洗净。用改良卡宝品红染色液分别染色5 min。用醋酸漂洗1~3min。把根尖和幼叶放在载玻片上,加一滴染液,用镊子捣碎,盖上盖玻片,然后再盖玻片上放一滤纸,用铅笔橡皮头轻轻敲击盖玻片,使细胞均匀分散。最后镜检,先用低倍镜观察,发现好的分裂相后,再转到油镜下观察,并用数码相机拍照。比较红芽芋试管苗根尖或幼叶染色体的制片效果,筛选出最佳的染色体制片所需的取材部位。
筛选出取材部位后,再研究各个因素对红芽芋试管苗染色体制片效果的影响。将剪下的材料分别置于0.1%秋水仙素溶液、0.002mol/L 8-羟基喹啉溶液以及0.1%秋水仙素+0.002mol/L 8-羟基喹啉混合溶液中,于室温下浸泡预处理4h。用蒸馏水洗净处理过的材料,经卡诺氏固定液(乙醇:冰乙酸体积为3:1)固定24h,最后转入70%的酒精中,4℃保存备用。储存的材料用蒸馏水洗净后,置1mol/L的HCl中于60℃恒温水浴锅内分别解离10 min 、15 min 和20min,再用蒸馏水洗净。用改良卡宝品红染色液分别染色4 min、6 min和10min。用醋酸漂洗1~3min。把材料放在载玻片上,加一滴染液,用镊子捣碎,盖上盖玻片,然后再盖玻片上放一滤纸,用铅笔橡皮头轻轻敲击盖玻片,使细胞均匀分散。最后镜检,先用低倍镜观察,发现好的分裂相后,再转到油镜下观察,并用数码相机拍照。比较红芽芋试管苗染色体的制片效果,筛选出最佳的预处理剂、1mol/LHCl解离时间以及改良卡宝品红染色时间。
2 结果与分析
2.1 取材部位对红芽芋试管苗染色体观察的影响
分别对红芽芋试管苗根尖和幼叶的染色体进行观察。结果表明,用幼叶进行染色体观察时,细胞小、易碎、染色体不易观察(见图1(a))。而用根尖进行染色体观察时,细胞较大,不易破碎,染色体更易观察(见图1(b))。因此,红芽芋试管苗染色体观察的最好材料是根尖。

(a)红芽芋幼叶细胞染色体(10×) (b)红芽芋根尖细胞染色体(40×)图1 取材部位对红芽芋试管苗染色体观察的影响
2.2 预处理剂对红芽芋试管苗染色体观察的影响
用0.1%秋水仙素、0.002mol/L 8-羟基喹啉、0.1%秋水仙素+0.002mol/L 8-羟基喹啉混合溶液分别处理红芽芋试管苗根尖4h。结果表明:3种预处理剂均可观察到根尖的染色体,但效果具有明显差异。用0.1%秋水仙素预处理时,细胞破碎严重,染色体高度重叠,不容易计数(见图2(a));用0.002mol/L 8-羟基喹啉预处理时,染色体细长,分散也不好,也不易计数(见图2(b));而用0.1%秋水仙素+0.002mol/L 8-羟基喹啉混合溶液预处理时,染色体分散较好,比较容易计数(见图2(c))。
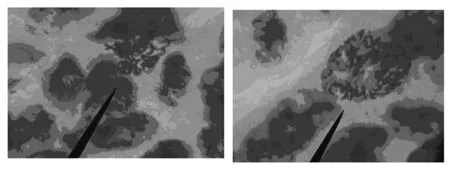
(a)0.1%秋水仙素处理的红芽芋根尖染色体形态(40×) (b)0.002mol/L 8-羟基喹啉处理的红芽芋根尖染色体形态(40×)

(c)0.1%秋水仙素+0.002mol/L 8-基喹啉处理的红芽芋根尖染色体形态(40×)图2 预处理剂对红芽芋试管苗染色体观察的影响
2.3 酸解离时间对红芽芋试管苗染色体观察的影响
预处理后,用 1 mol/ L 盐酸溶液在常温下对红芽芋试管苗根尖分别解离10 min、15 min和20min,结果见图3(a)-3(c)。结果表明:解离 10 min 时,根尖软化程度不够,很难观察到染色体;解离 20 min 时,细胞容易破裂,也难以观察到染色体;解离15min 时,细胞分散程度较好,且细胞破碎较少,比较容易观察到染色体。

(a)1 mol/ L 盐酸解离 10 min时红芽芋根尖染色体形态(10×) (b)1 mol/ L 盐酸解离20min时红芽芋根尖染色体形态(10×)

(c)1 mol/ L 盐酸解离 15min时红芽芋根尖染色体形态(10×)图3 酸解离时间对红芽芋试管苗染色体观察的影响
2.4 染色时间对红芽芋试管苗染色体观察的影响

(a)染色10min时红芽芋根尖细胞染色体形态(40×) (b)染色4min时红芽芋根尖细胞染色体形态(10×)

(c)染色6min时红芽芋根尖细胞染色体形态(10×)图4 染色时间对红芽芋试管苗染色体观察的影响
用 1 mol/ L 盐酸溶液解离后,卡宝品红染色时间对红芽芋试管苗根尖染色体的观察也有影响,如图4(a)-4(c)所示。结果表明:染色时间为10min时,细胞质与染色体均上色,无法清楚地观察到染色体;染色时间为4min时,细胞质几乎不上色,但染色体上色的细胞也不多,不易找到分裂相较好的细胞;染色时间为6min时,细胞质与染色体颜色对比较为明显,可清楚观察到染色体。
3 讨论
在进行植物染色体观察时,植物取材的部位至关重要。一般可在根尖、茎尖和嫩叶等不同部位进行取材。齐秀玲等[11]对草莓的染色体进行了观察,结果表明,草莓染色体观察的取材部位以根尖效果最好。薛陈心等[12]对欧洲黑莓的染色体进行了观察,发现根尖取材简单用量少,可观察到的分裂相较多。本实验结果也表明,用红芽芋试管苗幼叶进行染色体观察时,细胞小、易碎、染色体不易观察。而用红芽芋试管苗根尖进行染色体观察时,细胞较大,不易破碎,染色体更易观察。因此,对于植物染色体观察来说,根尖是较好的取材部位。究其原因,可能是茎尖和幼叶的细胞分裂指数较低[11]。但张永福等[13]对荔枝和龙眼部分珍稀种质进行染色体观察时,发现用幼叶也能达到较好的效果。这可能是植物种类差异所致。
在进行植物染色体观察时,为了防止纺锤体的形成,使细胞分裂停止在中期阶段,增加细胞的分裂指数,材料一般要经过预处理。预处理剂一般有二氯苯饱和水溶液、秋水仙素水溶液和8-羟基喹啉水溶液等,还可使用这些溶液的混合物,如秋水仙素与8-羟基喹啉混合溶液等。齐秀玲等[11]、陈是宇[14]和李庆玲等[15]发现,用对二氯苯饱和水溶液分别对草莓根尖、燕麦属牧草、白掌和观音莲根尖进行预处理2~3 h、4h、6 h和8h后,染色体观察效果较好。张蜀敏等[16]和侯典云等[17]发现,新疆雪莲组培苗和昭通半夏块茎再生苗根尖置0.002 mg/L 8-羟基喹啉溶液处理,效果最好。于盱等[18]发现,薄荷属植物根尖于0.1%秋水仙素溶液中浸泡12 h,容易观察到染色体。张永福等[13]发现,荔枝和龙眼部分珍稀种质的幼叶置于等体积的饱和对二氯苯和 2 mmol/L 8-羟基喹啉混合水溶液中预处理 3 -4 h,可以得到较多的分散良好、缢痕清晰、适合于计数及核型分析的染色体。薛陈心等[12]在欧洲黑莓的染色体观察中,发现用0.02%的秋水仙素和2 mmol/L的8-羟基喹啉(1:1)混合液对根尖预处理2h,效果较好。本实验结果进一步验证了这一观点,用0.1%秋水仙素+0.002mol/L 8-羟基喹啉混合溶液预处理时,红芽芋试管苗根尖染色体分散较好,容易计数。因此,对植物进行染色体观察时,植物基因型不同,其预处理剂种类、浓度和处理时间也不同。
在进行植物染色体观察时,材料经卡诺氏固定液固定后,需用1mol/L盐酸在58-60℃恒温下对材料进行解离。解离的作用是除去细胞之间的果胶层并使细胞壁软化以利于压片[11]。新疆雪莲根尖的适宜解离时间为5 min[16]。草莓根尖[11]和燕麦属牧草根尖[14]的适宜解离时间为10 min。白掌和观音莲根尖[15]的适宜解离时间分别为10 min和15min。薄荷属植物根尖[17]的适宜解离时间为15~20min。荔枝和龙眼部分珍稀种质根尖[13]的适宜解离时间为1h。本实验结果也表明,对于红芽芋试管苗根尖染色体观察而言,1mol/L盐酸解离的适宜时间为15min。这个结论与观音莲根尖[15]的实验结果一致。
植物染色体观察的关键一步是染色。染色一般可用改良的卡宝品红或乙酸洋红。但许多研究表明,改良的卡宝品红染色比乙酸洋红染色效果更好,具有分色清晰、操作简便快速、耐久不褪色等优点[11]。但改良卡宝品红染色时间也很重要。本实验结果表明,江西铅山红芽芋根尖染色时间为6min时,细胞质与染色体颜色对比较为明显,可清楚观察到染色体。但对于白掌和观音莲根尖[15]、新疆雪莲组培苗根尖[16],其改良卡宝品红的适宜染色时间为20 min。而薄荷属植物根尖[18]要求改良卡宝品红的染色时间长达2h以上。因此,植物根尖改良卡宝品红染色的时间也因植物种类而异。
参考文献:
[1] 肖月土.红芽芋无公害高产栽培技术[J].作物杂志,2006,(2):55-56.
[2] 姜绍通,程元珍,郑 志,等.红芽芋营养成分分析及评价[J].食品科学,2012,33(11):269-272.
[3] 徐国环,许满庆.红芽芋-稻-菜高效种植技术[J].中国种业,2008,(2):66-67.
[4] 李火金.铅山红芽芋茎尖脱毒组培繁育及高产栽培[J].中国蔬菜,2012,(3):45-46.
[5] 洪森荣,尹明华,王艾平.江西铅山红芽芋脱毒苗球茎愈伤组织诱导及其再生体系的建立[J].植物研究,2013,33(6):738-745.
[6] 洪森荣,尹明华.红芽芋驯化苗对盐胁迫的光合及生理响应[J].西北植物学报,2013,33(12):2499-2506.
[7] 洪森荣,尹明华,王艾平.江西铅山红芽芋胚性愈伤组织的包埋玻璃化超低温保存[J].植物科学学报,2014,32(1):80-87.
[8] 任文娟,郭小菲,姜立娜,等.菜用大黄染色体制片优化及核型分析[J].华北农学报,2013,28(5):128-132.
[9] 熊洋,何梦玲,何芳,等.3 个广藿香品种染色体制片技术优化与计数[J].广东农业科学,2013,40(24):121-123,131.
[10] 杜培,张新友,李丽娜,等.高质量花生根尖细胞染色体制片方法研究[J].河南农业科学,2013,42(3):31-35.
[11] 齐秀玲,郭二辉,王会民.不同制片方法对草莓染色体观察效果的影响[J].山西果树,2007,(5):7-9.
[12] 薛陈心,崔明稳,赵锦,等.欧洲黑莓的染色体观察[J].河北农业大学学报,2007,30(6):50-53.
[13] 张永福,卢博彬,王英,等.荔枝和龙眼部分珍稀种质的染色体观察[J].园艺学报,2010,37(12):1991-1994.
[14] 陈是宇,方程,孙彦,等.燕麦属牧草根尖组织染色体观察方法的优化研究[J].草原与草坪,2008,(2):23-26.
[15] 李庆玲,陈荣,杨跃生,等.两种天南星科植物根尖组织染色体观察方法的优化[J].草原与草坪,2012,(2):134-136.
[16] 张蜀敏,王晓军,陈阳.新疆雪莲组培苗的染色体观察[J].安徽农业科学,2008,36(3):971-972,987.
[17] 侯典云,王聪睿,王荔,等.昭通半夏染色体观察[J].江西农业大学学报,2006,28(2):320-322.
[18] 于盱,梁呈元,李维林,等.薄荷属植物染色体观察[J].江苏农业科学,2009,(4):190-191.
