花土沟油田复合微生物驱油实验研究
2014-04-01贾锁刚张启汉张立会扈福堂陈富林
贾锁刚,张启汉,张立会,扈福堂,陈富林
(1.中国石油股份有限公司青海油田钻采工艺研究院,甘肃敦煌736202;2.西北大学 西安市油田微生物工程实验室,陕西 西安710069)
青海花土沟油田位于柴达木盆地西南。油田已探明石油储量2 366×104t,埋藏深度120~1 100 m,岩石孔隙度18% ~22%,空气渗透率(40~500)×10-3μm2,油藏温度27 ~38 ℃,原始压力系数0.611 ~0.800,属低压低温油藏,地层水总矿化度20×104mg/L,CaCl2型,钙镁离子含量高,属于强矿化水[1]。高矿化度的特点使聚合物驱和化学表面活性驱的应用受到了限制,油田稳产形势严峻[2]。
微生物强化采油技术(MEOR)是一种利用微生物自身在油藏中的活动及其代谢产物进行有效驱油以提高原油采收率的技术[3],具有适应性广、工艺简单、增油效果显著和环境友好等特点,近年来在石油开采特别是提高枯竭油藏采收率中受到越来越多的重视[4]。目前,国内外许多油田已相继采用微生物采油技术,并取得良好的应用效果。例如安塞特低渗透油田王16-5井组2009年开展本源微生物采油,有效期300 d,累计增油550 t,经济效益可观[5]。微生物驱油技术在胜利油田盘2-33断块稠油油藏的应用结果表明,措施后产油量上升,含水率下降,采收率提高[6]。因此,开展微生物驱油等先进技术的研究和实验对提高油田产量有重要意义。
1 材料与方法
1.1 驱油菌株的筛选及鉴定
将从花土沟现场取回的油水样经稀释后涂布LB平板,挑取菌落将其在血平板上划线培养,观察溶血圈大小,筛选透明圈较大的菌株进行纯化培养。对筛选的菌株进行生理生化以及16S rRNA序列鉴定,明确微生物的分类地位。
1.2 驱油性能评价
将驱油菌株接种LB液体培养基,150 r/min、37℃恒温培养2 d,分别用JYW-200A自动界面张力仪和SVT-20旋转滴界面张力仪测定发酵液的表、界面张力。
配制原油降解培养基,NH4Cl 3 g,MgSO40.2 g,K2HPO41.25 g,KH2PO40.5 g,CaCl20.01 g,酵母膏0.5 g,水1 L。取花土沟原油20 g,原油降解培养基200 mL,共同置于500 mL三角瓶中,121℃高压灭菌30 min后,接种3%微生物混合菌液20 mL,于37℃、150 r/min恒温摇床中振荡培养7 d,检测微生物作用前后原油黏度、胶质、蜡含量的变化,分析微生物降解原油特性。
1.3 石油烃组分变化
取微生物作用前后油样1 mL,12 000 r/min离心5 min,取上层原油 100 μL,甲醇萃取,12 000 r/min再次离心5 min,取上清液过0.22 μm 滤膜,加入进样瓶中,用Agilent 6890气相色谱进行原油烃组分分析。色谱条件:色谱柱HP-5(0.32×0.25 mm×30 m);进样口温度250℃,不分流进样,检测器为FID氢火焰离子检测器;检测器温度300℃,程序升温,75℃升温至280℃,保持3 min,载气N2,燃气H2。
1.4 油藏适应性评价
于250 mL锥形瓶中加入100 mL原油降解培养基,10 mL原油,10 mL 3%微生物混合菌液,置于35℃、150 r/m恒温摇床中,每4 h测定一次菌浓度吸光值(用吸光值表示菌浓度,吸光值越大,菌浓度越高[7]),绘制其生长曲线。
模拟花土沟地层温度,设计30、35、40℃3个温度,将微生物混合菌液接种于LB培养基中,振荡培养52 h,测定菌体光密度值,检测菌株对花土沟地层温度适应性。
1.5 微生物驱油物理模拟实验
将实验用的花土沟岩心抽真空饱和水,测量孔隙体积,将岩心放入恒温箱内,在35℃温度下油驱水建立束缚水,测量原始含油饱和度,岩心在实验温度下老化24 h;用地层水进行驱油至极限含水率(98%)时停止水驱,计算水驱采收率;再注入混合微生物菌液恒温放置7 d,关闭岩心进出口,在岩心内培养24 h;打开岩心进出口,并用地层水进行后续水驱,岩心流出液中含水率达到98%时停止实验,计算总采收率。
2 结果分析
2.1 驱油菌株的筛选及鉴定
从花土沟油水样中共分离筛选到125株微生物,根据溶血圈的大小优选出2株,编号分别为QH2和QHQ110。QH2菌株革兰氏阴性菌,短杆状,单鞭毛,接触酶反应、氧化酶水解酶、精氨酸水解酶、油脂水解、反硝化实验反应阳性,不产H2S,发酵葡萄糖培养产气产酸,淀粉水解、水解明胶反应、吲哚实验阴性,M.R.阳性,V.P.阴性,并产生绿脓菌素[8]。QHQ110菌株杆状,革兰氏阳性,产芽孢,甲基红实验、硝酸盐还原实验、水解淀粉反应、酪素水解、水解明胶实验均为阳性,发酵葡萄糖培养产酸但不产气[9]。
对2株菌进行16S rDNA测定,PCR扩增引物采用细菌通用引物。结果送上海生工生物工程公司测序。将测序结果输入GenBank核酸序列数据库进行比对,结果表明,QH2菌和铜绿假单胞菌的相似度为99%,QHQ110和枯草芽孢杆菌的同源性达98%,因此驱油菌株分别命名为铜绿假单胞菌QH2(CCTCC NO:M2012468)和枯草芽孢杆菌QHQ110(CCTCC NO:M2012467)。
2.2 本源微生物驱油性能评价
2.2.1 表/界面张力测定 微生物发酵液的表/界面张力如表1所示。

表1 微生物发酵液的表/界面张力Tab.1 Surface/interfacial tension of microbial fermentation liquid
从表1中可以看出,枯草芽孢杆菌QHQ110、铜绿假单胞菌株QH2发酵液具有较强的降低表面张力的能力,而混合发酵液作用效果更强,可将水的表面张力从72 mN/m降低到26.29 mN/m。QHQ110、QH2混合菌液的界面张力值更低到了10-1的数量级,为0.272 8 mN/m。已有研究资料表明,铜绿假单胞菌可产生鼠李糖脂类表面活性剂[10],枯草芽孢杆菌产生脂肽类表面活性剂[11],从2株菌发酵液以及混合菌液具有极低的表面张力和界面张力来看,这2株菌可产生大量的生物表面活性剂类次级代谢产物。
2.2.2 原油黏度变化 混合菌液作用后原油黏度变化情况见表2。
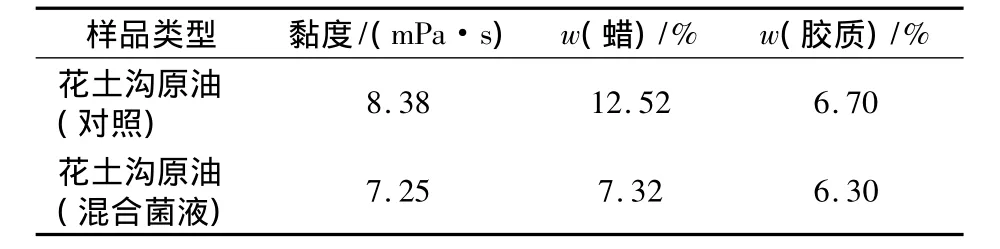
表2 混合菌液作用后原油黏度变化情况Tab.2 Change of oil viscosity under the effect of mixed fermentation liquid
混合菌液作用7 d后,原油黏度、蜡胶含量降低,说明菌种具有一定的降蜡和降胶效果,从而使原油的黏度下降,流动性增加,有利于驱油[12]。
2.2.3 菌株对原油烃组分的作用 混合菌液作用花土沟原油7 d后,微生物作用后的峰高要大大低于作用前,表明微生物对原油产生了降解作用[13],
不仅对中长链烷烃而且对长链烷烃的降解作用都很好,说明该混合菌液具备驱油应用潜力。
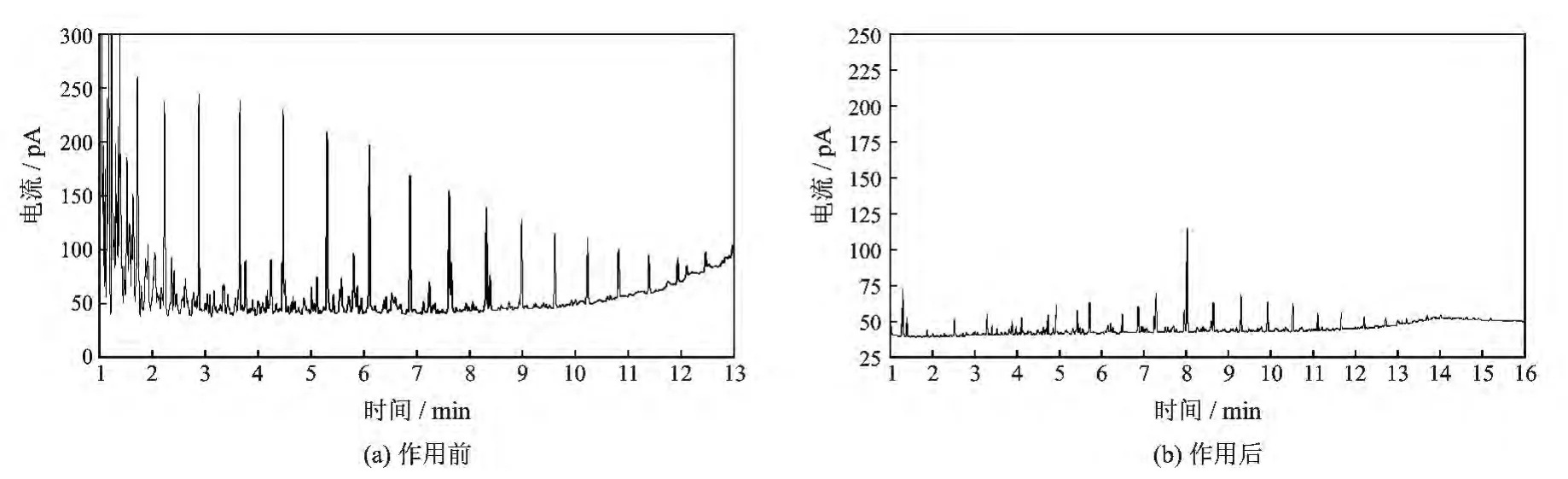
图1 微生物作用前后原油烃组分变化Fig.1 Change of crude oil hydrocarbon composition under the effect of microorganism
2.3 驱油微生物油藏适应性评价
2.3.1 菌株繁殖能力测定 驱油菌株生长曲线见图2。

图2 驱油菌株生长曲线Fig.2 Growth curves of two strains
图2 表明2株菌生长情况良好,培养8~12 h后即进入对数生长期,约24~32 h后进入稳定期,菌浓度基本一致,经平板菌落计数,菌数约107~108个/mL。花土沟油层温度27~38℃,在此条件下微生物可快速生长,短时间内菌浓度越大,微生物驱油效率越高。
2.3.2 温度对菌株生长的影响 混合菌液中驱油微生物在30~40℃之间生长繁殖旺盛(见图3),生长2 d内可达到设计要求的生物量指标107~108个/mL。

图3 温度对混合菌株生长的影响Fig.3 Effect of temperature on growth and reproduction of the mixed strains
青海油田花土沟气候寒冷干燥、冬长夏短、昼夜温差大,全年平均气温3.8℃,最热天气为7月份,平均18.5℃,极端最高气温30.6℃,最冷天气出现在1月,平均气温 -12.4℃[14],交通方面只有公路运输通行。为了确保混合菌液微生物在低温、短途运输过程中保持其生物繁殖能力和浓度,设计检测菌株生长达到108个/mL后在低温0℃冰箱存放1~5 d的菌体浓度,同时按照平板法计量活菌数。低温0℃对菌株存活及生长的影响见表3。
由表3可知,菌液在0℃静置5 d,其活菌数仍然保持在0.664×108个/mL,与对照常温(25℃)静置5 d活菌数在0.79×108个/mL相差不大,这与微生物在0℃环境下生长受抑制而不会死亡的规律相符。实验表明,混合菌液微生物在低温短途运输过程中,其生长繁殖能力不会受到影响。
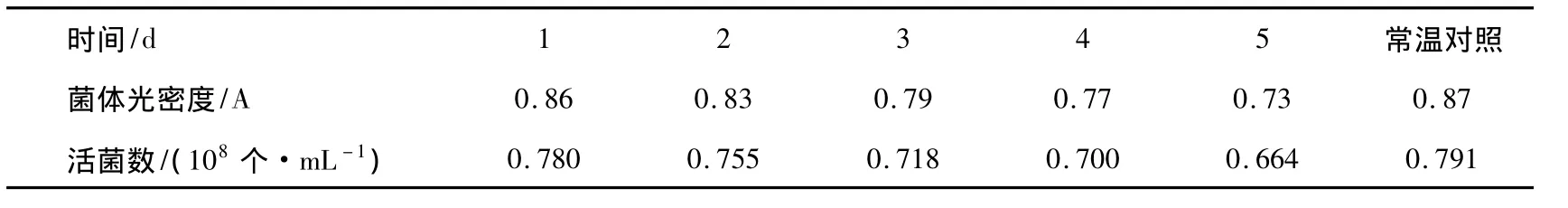
表3 低温0℃对菌株存活及生长的影响Tab.3 Survival and growth state of the mixed strain at 0 ℃
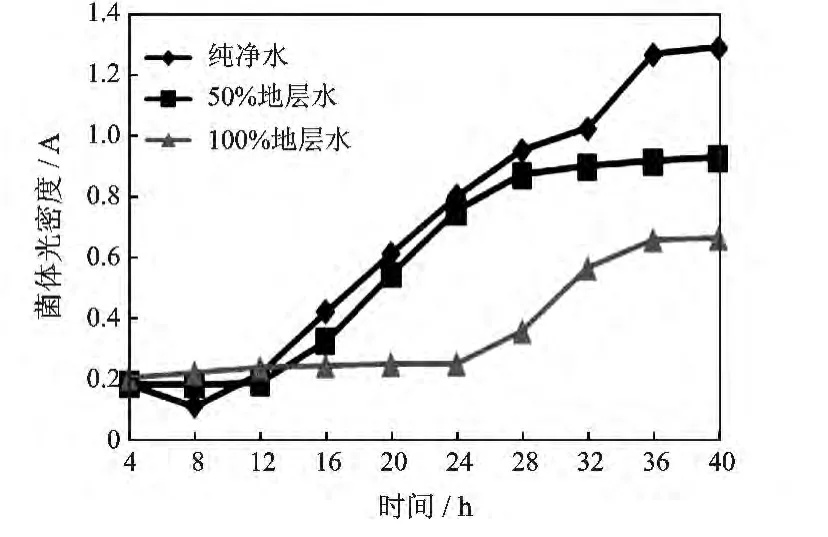
2.3.3 矿化度对菌株生长的影响 花土沟油田地层水为CaCl2型,钙镁离子含量高,总矿化度为20×104mg/L,属于强矿化水。为了准确模拟矿化水中各个离子浓度含量,采用纯净水、纯净水+地层水(体积比1∶1)、地层水不同矿化度水为溶剂,将3%混合菌液接种于LB培养基中,35℃摇床振荡培养40 h,每4 h测定发酵液的菌体光密度值,用以检测不同矿化水对菌株生长的影响(见图4)。
由图4可知,矿化度在(10~20)×104mg/L范围内,本源驱油菌株都可以生长繁殖,100%的地层水会延缓微生物菌体的生长繁殖速度,与正常LB培养基相比,虽然菌株的对数生长期延缓了10 h,但仍然能在2 d内达到较大光密度值,微生物生长状态良好,生物量指标达到107~108个/mL,表明菌株可以很好地适应花土沟油田环境。
2.4 生物驱油室内模拟实验
挑选3根渗透率分别小于50×10-3μm2、大于100×10-3μm2、大于500 ×10-3μm2的岩心进行驱油率测定(见表4)。结果表明,经微生物驱替作用后,岩心驱替效率提高了3.03% ~25.00%。水驱实验时,采收率平均达到57.48%;微生物驱提高采收率最高为14.29%。随着微生物驱和后续水驱,注入量逐渐增加,注入压力增大,水相渗透率上升,采收率分别提高了 3.03%(657 ×10-3μm2)、17.86%(30 × 10-3μm2)、25.00%(123 × 10-3μm2),平均提高了15.3%,说明注入微生物有洗油功效,从而提高了驱替效率。
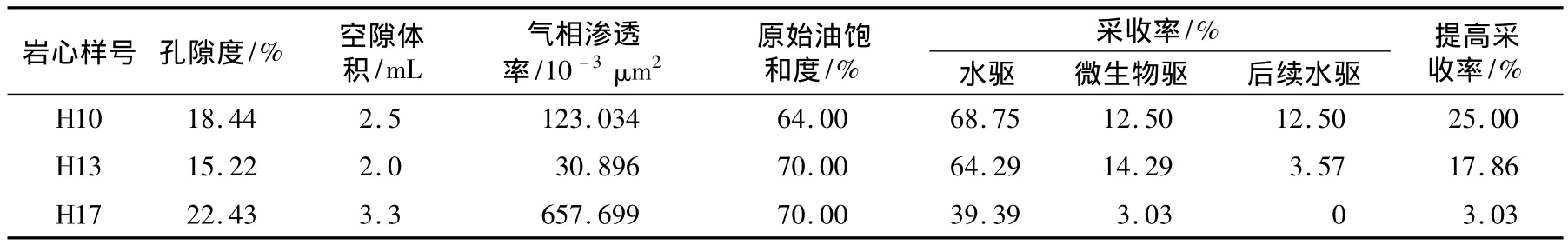
表4 各岩心提高采收率结果Tab.4 EOR results of the cores
3 结论
(1)通过大量的菌株筛选工作,分离得到2株产生物表面活性剂的优良菌株,经鉴定为铜绿假单胞菌和枯草芽孢杆菌。
(2)混合菌株发酵液具有更好的降低表、界面张力的能力,可将水的表面张力从72 mN/m降低到26.29 mN/m,并且发酵液的油水界面活性较高,平衡界面张力约为0.272 8 mN/m。
(3)筛选的本源微生物能够适应青海油田花土沟油藏环境。微生物菌体在该油藏环境中大量繁殖,在100%地层水配置的培养基中,驱油菌株生长速度较正常水体延缓10 h左右,但仍能在48 h内达到107~108个/mL;花土沟地层温度平均35℃,非常适合微生物的生长繁殖;花土沟本源驱油菌株发酵液在0℃静置5 d仍然能保持108个/mL的活菌浓度,有利于低温存储、运输。
(4)室内驱油模拟实验中,经微生物驱替段塞作用后,采收率平均可提高15.3%,说明筛选的菌株驱油性能较强,微生物驱油室内评价结果为其在花土沟油藏现场应用提供了可靠的实验依据。
[1] 李永太,刘易非,唐长久.提高石油采收率原理和方法[M].北京:石油工业出版社,2008.
[2] 申坤,李斌,黄战卫,等.复合本源微生物驱油技术在低渗透油藏的应用研究[J].西安石油大学学报:自然科学版,2013,28(3):63-69.SHEN Kun,LI Bin,HUANG Zhan-wei,et al.Application of composite indigenous microorganism oil displacement technology in low-permeability reservoirs[J].Journal of Xi'an Shiyou University:Natural Science Edition,2013,28(3):63-69.
[3] 王俊,黄立信,俞理.花土沟高矿化度油藏内源微生物提高采收率实验研究[J].科技导报,2011,29(3):26-28.WANG Jun,HUANG Li-xin,YU Li.Laboratory study of enhancing oil recovery rate by indigenous microorganism in hyper-salinity reservoir[J].Science & Technology Review,2011,29(3):26-28.
[4] 刘建英,申坤,黄战卫,等.安塞特低渗透油田微生物驱先导试验[J].新疆石油地质,2010,31(6):634-636.LIU Jian-ying,SHEN Kun,HUANG Zhan-wei,et al.A pilot study on MEOR in Ansai extra-low permeability oil field[J].Xinjiang Petroleum Geology,2010,31(6):634-636.
[5] 孙德宽,王勤田,王海峰,等.微生物驱油技术在盘2-33断块常规稠油油藏的应用[J].断块油气田,2004,11(4):52-54.SUN De-kuan,WANG Qin-tian,WANG Hai-feng,et al.Application of microorganism flooding technology in Pan2-33 fault block of routine heavy oil reservoir[J].Faultblock Oil& Gas Field,2004,11(4):52-54.
[6] 左良成.微生物提高石油采收率菌种的筛选及其驱油效能研究[D].西安:西北大学,2003.
[7] 袁姝玲.定边油田微生物采油菌株的筛选与性能评价[D].西安:西安石油大学,2011.
[8] 柯从玉,吴刚,游靖,等.微生物驱油产出液中有机酸的监测及对提高采收率的作用研究[J].西安石油大学学报:自然科学版,2013,28(3):54-58.KE Cong-yu,WU Gang,YOU Jing,et al.Monitoring of the organic acid in the produced liquid in microbial flooding process and effect of the organic acid on enhancing oil recovery factor[J].Journal of Xi'an Shiyou University:Natural Science Edition,2013,28(3):54-58.
[9] 包木太,汪卫东,王修林,等.激活内源微生物提高原油采收率技术[J].油田化学,2002,19(4):382-386.BAO Mu-tai,WANG Wei-dong,WANG Xiu-lin,et al.Microbial enhanced oil recovery by activation of stratal microflora:a review[J].Oilfield Chemistry,2002,19(4):382-386.
[10]LI Qing-xin,KANG Cong-bao,WANG Hao,et al.Application of microbial enhanced oil recovery technique to Daqing Oilfield[J].Biochemical Engineering Journal,2002,11(2/3):197-199.
[11]Bordoloi N K,Konwar B K.Microbial surfactant-enhanced mineral oil recovery under laboratory conditions[J].Colloids and Surfaces B-Biointerfaces,2008,63(1):73-82.
[12]Ramkrishna Sen.Biotechnology in petroleum recovery:The microbial EOR[J].Progress in Energy and Combustion Science,2008,34:714-724.
[13]曹书瑜,涂书培,李志伟,等.青海七个泉油田复合微生物驱油试验[J].石油天然气学报,2007,29(6):124-127.CAO Shu-yu,TU Shu-pei,LI Zhi-wei,et al.Study on composite microorganism oildisplacementtechnology in Qigequan of Qinghai field[J].Journal of Oil and Gas Technology,2007,29(6):124-127.
[14]张红丽.青海跃进油区微生物驱技术研究[D].廊坊:中国科学院渗透流体力学研究所,2009.
