他莫昔芬对大鼠脊髓损伤后炎性反应及细胞凋亡的影响
2014-04-01韦竑宇
韦竑宇 梁 立
中日友好医院脊柱外科,北京 100029
他莫昔芬作为乳腺癌患者内分泌治疗药物在临床已被广泛应用。 近年来研究发现,他莫昔芬在缺血缺氧性脑损伤、脊髓损伤(spinal cord injury,SCI)、脑出血等疾病中可发挥神经保护作用[1-3]。但他莫昔芬在SCI 中发挥神经保护作用的机制仍是未解之谜。
本研究旨在通过检测核因子kappa B p65 (NFκB p65)及磷酸化核因子κB 抑制因子α(pI-κB α)表达,观察他莫昔芬对核因子-kappa B 抑制蛋白激酶复合体/核因子kappa B(IKK/NF-κB)通路的调控;通过检测活性半胱天冬酶-3(caspase-3)活化水平,观察其对细胞凋亡的影响; 通过检测髓过氧化物酶(myeloperoxidase,MPO)活性,观察其对炎症细胞浸润的影响,从而探讨其神经保护机制。
1 材料与方法
1.1 实验动物及分组
健康雌性Sprague-Dawley(SD)大鼠51 只(由中日友好医院实验动物中心提供),鼠龄10~12 周,体重200~220 g,随机分为3 组:假手术组(n=17,仅行椎板切除术); 对照组 (n=17,SCI+硬膜下注射二甲基亚砜);他莫昔芬组(n=17,SCI+硬膜下注射他莫昔芬)。
1.2 模型制备及给药
3 组大鼠麻醉后,假手术组仅行T11~T13段椎板切除。其余两组以T12棘突为中心,咬除椎板,暴露脊髓,用质量为20 g 的不锈钢棒从12.5 mm 高处垂直落下(打击量25 g·cm),诱发脊髓损伤。
SCI 后30 min,对照组硬膜下注射2%二甲基亚砜5 mL/kg; 他莫昔芬组损伤部位硬膜下注射他莫昔芬5 mg/kg(溶于2%二甲基亚砜1 mg/mL)。
术后24 h,3 组大鼠以10%水合氯醛(600 mg/kg)麻醉后, 以含有1 U/mL 肝素的生理盐水进行心脏灌洗,截取10 mm 损伤节段脊髓,置于-80℃冰箱保存备用。
1.3 免疫印迹法检测NF-κB p65、pI-κB α 和活性caspase-3
蛋白提取按照蛋白抽提试剂盒说明书进行(普利莱基因有限公司, 北京),BCA 法蛋白定量检测浓度(普利莱基因有限公司,北京),计算蛋白电泳加样量。根据蛋白浓度进行上样、电泳、转膜、洗膜、封闭、4℃一抗过夜, 一抗分别为小鼠抗大鼠NF-κB p65 单克隆抗体(1∶1000,Santa Cruz 公司,美国)、兔抗大鼠pIκB α 单克隆抗体(1∶500,Cell Signalling 公司,美国)、兔抗大鼠活性caspase-3 单克隆抗体 (1∶1000,Cell Signalling 公司,美国);洗膜,将标记辣根过氧化物酶的羊抗兔或羊抗小鼠二抗分别加入二抗稀释液中(1∶2000,Jackson West Grove 公司,美国),37℃孵育1 h,漂洗二抗,ECL 法发光(ECL 试剂盒:普利莱基因有限公司,北京)。 X 线曝光10 s~1 min。 扫描胶片,运用Gel-Pro Analyzer 4.0 软件(Media Cybernetics 公司,美国) 进行灰度值分析, 以其光密度(Optical density,OD)表示。
1.4 比色法检测MPO 活性
脊髓组织中MPO 活性检测按照MPO 活性检测试剂盒(南京建成生物工程研究所,南京)说明书进行,在460 nm 处,1 cm 光径,测各组OD 值,根据说明书中的计算公式,推算MPO 活性。
1.5 统计学方法
采用SPSS 17.0 软件进行分析(SPSS 公司,美国),计量资料数据用均数±标准差()表示,组间比较采用单因素方差分析和Bonferrni 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 NF-κB p65 的表达
免疫印迹法检测各组脊髓组织NF-κB p65 的表达水平,结果显示:与假手术组相比,对照组术后24 h NF-κB p65 的表达水平较高,他莫昔芬组NF-κB p65表达水平显著低于对照组(P <0.05)。 见图1、表1。
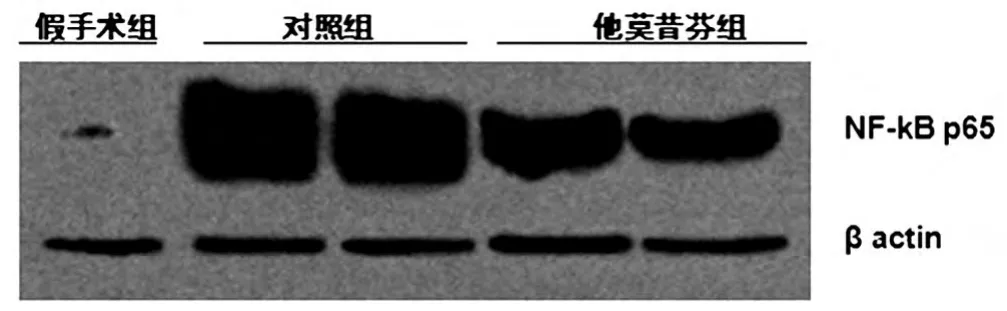
图1 核因子kappa B p65 免疫印迹检测结果
2.2 pI-κB α 的表达
采用免疫印迹检测各组脊髓组织中pI-κB α 的表达水平,结果显示:与假手术组相比,对照组pI-κB α显著升高, 而他莫昔芬明显抑制了pI-κB α 的表达,差异均有统计学意义(均P <0.05)。 见图2、表1。

图2 磷酸化核因子κB 抑制因子α 免疫印迹检测结果
2.3 活性caspase-3 的表达
本研究选择活性caspase-3 作为细胞凋亡相关的指标进行检测,结果显示:脊髓损伤24 h 后,与假手术组相比,对照组活性caspase-3 表达水平明显升高,他莫昔芬显著降低了活性caspase-3 的表达, 差异有统计学意义(P <0.05)。 见图3、表1。

图3 活性半胱天冬酶-3 免疫印迹检测结果
表1 Western blot 结果定量分析()

表1 Western blot 结果定量分析()
注: 与假手术组比较,#P <0.05; 与对照组比较,*P <0.05;NF-κB p65:核因子kappa B p65;pI-κB α:磷酸化核因子κB 抑制因子α;caspase-3:活性半胱天冬酶-3
组别 只数 NF-κB p65 pI-κB α caspase-3假手术组对照组他莫昔芬组17 17 17 0.31±0.03 3.17±0.12#1.55±0.07#*0.12±0.01 0.98±0.05#0.53±0.03#*0.08±0.01 1.03±0.05#0.36±0.02#*
2.4 MPO 活性
通过检测脊髓组织中MPO 活性反映炎性细胞浸润程度,结果显示:假手术组中,MPO 活性极低,另外两组则明显升高, 其中对照组升高更为显著 (P <0.05)。 见表2。
表2 各组大鼠术后24 h 脊髓组织中髓过氧化物酶活性(U/mg,)
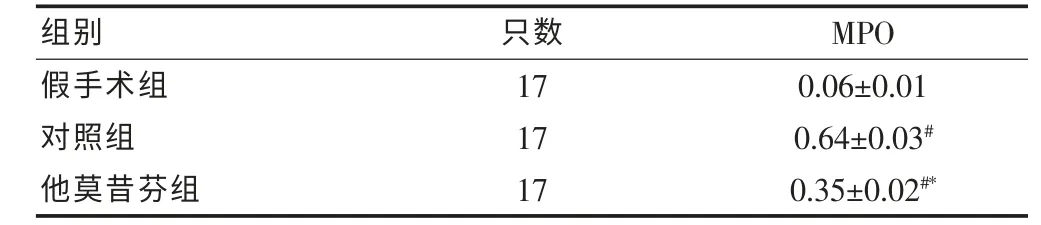
表2 各组大鼠术后24 h 脊髓组织中髓过氧化物酶活性(U/mg,)
注:与假手术组比较,#P <0.05;与对照组比较,*P <0.05;MPO:髓过氧化物酶
组别 只数 MPO假手术组对照组他莫昔芬组17 17 17 0.06±0.01 0.64±0.03#0.35±0.02#*
3 讨论
多个研究表明他莫昔芬可发挥神经保护作用,据报道, 他莫昔芬能够减轻脑出血部位周围细胞水肿,减轻SCI 后组织水肿, 促进瘫痪肢体的运动功能恢复[4-6];在缺血缺氧过程中参与氧自由基的清除,从而大大减少过氧硝酸盐的生成[7-8];同时可减弱小胶质细胞及反应性星形胶质细胞活化,发挥抗放射性脑损伤作用[9]。学者们发现,通过抑制炎性反应和神经细胞凋亡可有效缓解脊髓损伤,促进神经功能恢复[10-12]。本研究旨在观察他莫昔芬对SCI 过程中炎性反应及细胞凋亡的影响,探讨其神经保护机制。
众所周知, 转录因子NF-κB 家族是调控人体炎性反应的重要环节,有多条路径可激活NF-κB,I-κB激酶复合体磷酸化I-κB(I-κB α、I-κB β、I-κB ε)介导的经典路径在固有免疫的启动中发挥重要作用。据报道, 对IKK/NF-κB 通路的成功干预可有效缓解SCI的病理过程[13]。NF-κB 并非是一种单一蛋白,而是NFκB/Rel 家族成员构成各种二聚体的总称。已知有5 种哺乳类Rel 蛋白:NF-κB1 (p50 及其前体p105)、NFκB2(p52 及其前体p100)、c-Rel、RelA(p65)和RelB。 由p65:p50 构成的异二聚体是绝大多数细胞最为常见的NF-κB 形式,而且,仅RelA(p65)和c-Rel 具有转录激活结构域。 现已发现多种药物通过影响NF-κB通路及其基因产物在体外发挥神经保护作用[14-17]。 本研究选取p65 和pI-κB α 作为代表IKK/NF-κB 通路活化程度的指标进行检测,结果显示,他莫昔芬成功抑制了IKK/NF-κB 通路的传导, 在两组SCI 大鼠中检测到pI-κB α 表达水平明显高于假手术组,而他莫昔芬的应用降低了pI-κB α 的表达水平,同时使p65表达水平显著降低。
SCI 发生后炎性反应紧随其来,炎症细胞开始释放大量的促炎递质及神经毒性物质,如活性氧自由基ROS 和活性氮自由基RNS,加重脂质过氧化,损害神经元,从而加重神经功能障碍[18]。 在所有炎症细胞中,中性粒细胞是最快到达损伤部位的。 MPO 是主要存在中性粒细胞嗜天青颗粒中的一种酶,可催化过氧化氢和氯阴离子反应生成次氯酸和氯胺类,其活性的高低反映中性粒细胞的浸润程度、数量及活性,从而反映出炎症的严重程度, 为判定脊髓损伤程度提供依据[19]。 本实验结果表明在SCI 组MPO 表达显著升高,而应用他莫昔芬可大大降低损伤脊髓组织内MPO 的表达水平,下调了炎性反应的程度。
SCI 中的另一关键病理过程是凋亡,Crowe 等[20]研究表明,在大鼠SCI 模型脊髓白质中可发现大量凋亡细胞。凋亡所致的轴突变性及白质纤维脱髓鞘可最终引发神经元功能损伤[21-23]。 细胞凋亡转录启动最重要的因子为caspase-3 蛋白酶[24],它的激活是触发细胞凋亡的关键,被称为“分子开关”[25]。因此,caspase-3 的活性可反映损伤部位细胞凋亡的发生程度。本研究发现,损伤24 h 后,对照组的活性caspase-3 表达明显升高, 损伤部位注射他莫昔芬可显著降低caspase-3活性,表明他莫昔芬在脊髓损伤中具有抗凋亡特性。
综上所述,本研究提示他莫昔芬成功降低NF-κB p65 和pI-κB α 的表达,从而抑制IKK/NF-κB 通路介导的炎性反应。 通过检测组织中MPO 活性证实了他莫昔芬可减少脊髓损伤部位炎症细胞浸润, 此外,他莫昔芬可降低caspase-3 活性发挥抗细胞凋亡作用。
[1] Tian DS,Liu JL,Xie MJ,et al. Tamoxifen attenuates inflammatory -mediated damage and improves functional outcome after spinal cord injury in rats [J]. J Neurochem,2009,109(6):1658-1667.
[2] Xie Q,Guan J,Wu G,et al.Tamoxifen treatment for intracerebral hemorrhage[J].Acta Neurochir Suppl,2011,11:271-275.
[3] Feng Y,Fratkins JD,LeBlanc MH. Treatment with tamoxifen reduces hypoxic-ischemic brain injury in neonatal rats [J]. Eur J Pharmacol,2004,484(1):65-74.
[4] Kimelberg HK,Feustel PJ,Jin Y,et al. Acute treatment with tamoxifen reduces ischemic damage following middle cerebral artery occlusion [J]. Neuro Report,2000,11(12):2675-2679.
[5] Kimelberg HK,Jin Y,Charniga C,et al. Neuroprotective activity of tamoxifen in permanent focal ischemia [J]. J Neurosurg,2003,99(1):138-142.
[6] Rutledge EM,Aschner M,Kimelberg HK. Pharmacological characterization of swelling-induced D-[3H]aspartate release from primary astrocyte cultures[J].Am J Physiol,1998,274(6):C1511-C1520.
[7] Wiseman H,Cannon M,Arnstein HR,et al.Tamoxifen inhibits lipid peroxidation in cardiac microsomes. Comparison with liver microsomes and potential relevance to the cardiovascular benefits associated with cancer prevention and treatment by tamoxifen [J]. Biochem Pharmacol,1993,45(9):1851-1855.
[8] Osuka K,Feustel PJ,Mongin AA,et al. Tamoxifen inhibits nitrotyrosine formation after reversible middle cerebral artery occlusion in the rat [J]. J Neurochem,2001,76(6):1842-1850.
[9] Liu JL,Tian DS,Li ZW,et al. Tamoxifen alleviates irradiation-induced brain injury by attenuating microglial inflammatory response in vitro and in vivo [J]. Brain Res,2010,1316:101-111.
[10] Kubota K,Saiwai H,Kumamaru H,et al. Myeloperoxidase exacerbates secondary injury by generating highly reactive oxygen species and mediating neutrophil recruitment in experimental spinal cord injury [J]. Spine,2012,37(16):1363-1369.
[11] 韩晓光,田伟,刘波,等.表没食子儿茶素没食子酸酯对大鼠脊髓损伤后神经功能恢复的影响[J].中国脊柱脊髓杂志,2013,23(11):998-1005.
[12] 刘亚东,陈学明,于振山,等.大鼠脊髓损伤后大脑运动皮质神经元凋亡的观察[J].中国脊柱脊髓杂志,2013,23(6):546-552.
[13] Lu M,Wang S,Han X,et al.Butein inhibits NF-κB activation and reduces infiltration of inflammatory cells and apoptosis after spinal cord injury in rats[J].Neurosci Lett,2013,542:87-91.
[14] Han X,Lu M,Wang S,et al. Targeting IKK/NF-kappa B pathway reduces infiltration of inflammatory cells and apoptosis after spinal cord injury in rats[J].Neurosci Lett,2012,511(1):28-32.
[15] Pandey MK,Sandur SK,Sung B,et al. Butein,a tetrahydroxychalcone,inhibits nuclear factor (NF)-kappaB and NF-kappaB-regulated gene expression through direct inhibition of IkappaBalpha kinase beta on cysteine 179 residue [J]. J Biol Chem,2007,282(24):17340-17350.
[16] Niederberger E,Geisslinger G. The IKK-NF-kappa B pathway: a source for novel molecular drug targets in pain therapy[J]. FASEB J,2008,22(10):3432-3442.
[17] Huxford T,Huang DB,Malek S,et al. The crystal structure of the I kappaB alpha/NF-kappa B complex reveals mechanisms of NF-kappa B inactivation[J].Cell,1998,95(6):759-770.
[18] Yune TY,Lee SM,Kim SJ,et al. Manganese superoxide dismutase induced by TNF-beta is regulated transcriptionally by NF-kappa B after spinal cord injury in rats [J]. J Neurtrauma,2004,21(12): 1778-1794.
[19] 宋佳,齐慧慧,贾连顺.原花青素对大鼠急性脊髓损伤的保护作用及机制研究[J].中国矫形外科杂志,2013,21(8):794-798.
[20] Crowe MJ,Bresnahan JC,Shuman SL,et al. Apoptosis and delayed degeneration after spinal cord injury in rat sand monkeys [J]. Nat Med,1997,3(1):73-76.
[21] Grossman SD,Rosenberg LJ,Wrathall JR. Temporal-spatial pattern of acute neuronal and glial loss after spinal cord contusion [J]. Exp Neurol,2001,168(2):273-282.
[22] Hagg T,Oudega M. Degenerative and spontaneous regenerative processes after spinal cord injury[J]. J Neurotrauma,2006,23(3-4):264-280.
[23] Jiang SC,Bendjelloul F,Ballerini IP,et al. Guanosine reduces apoptosis and inflammation associated with restoration of function in rats with acute spinal cord injury[J].Purinergic Signal,2007,3(4):411-421.
[24] Brusselmans K,Vrolix R,Verhoeven G,et al. Induction of cancer cell apoptosis by flavonoids is associated with their ability to inhibit fatty acid synthase activity [J]. J Biol Chem,2005,280(7):5636-5645.
[25] Patil CS,Singh VP,Satyanarayan PS,et al. Protective effect of flavonoids against aging-and lipopolysaccharideinduced cognitive impairment in mice [J]. Pharmacology,2003,69(2):59-67.
