核苷代谢对甲氨蝶呤治疗骨破坏疗效的影响研究
2014-03-30屈鹏飞李浩波陈彪贾志宇赵云转张睿杨威张英怀
屈鹏飞 李浩波 陈彪 贾志宇 赵云转 张睿 杨威 张英怀
类风湿关节炎是一种慢性的炎症性疾病,其特征为破骨细胞介导的骨质破坏和关节软骨的破坏[1]。甲氨蝶呤(MTX)是一个单甲基的氨基蝶呤,近年来被广泛地使用,是最有效的治疗类风湿性关节炎的临床药物之一。甲氨蝶呤和氨基蝶呤由于能够通过抑制一种控制核酸合成的酶(二氢叶酸还原酶)来抑制DNA合成,因此在抗肿瘤的方面,也有着非常显著的药效[2]。近年来在对类风湿性关节炎的患者治疗过程中,低剂量的甲氨蝶呤被广泛的用来抑制关节炎症[3],但是最近的研究表明,甲氨蝶呤在一些类风湿性关节炎的治疗过程中,出现了效果不良,并且可能是因为给药过程中,因为其拮抗剂的潜在可能,而导致了效能极大降低[4,5]。本研究主要是在大鼠的全骨髓细胞的培养体系中脱氧腺苷与甲氨蝶呤的拮抗现象和在佐剂引导的关节炎动物试验模型中腺苷脱氨酶水平的变化来初步研究甲氨蝶呤对腺苷脱氨酶的抑制现象,并通过目前的证据发现腺苷脱氨酶可能为甲氨蝶呤的一个分子靶,并以此来解释在类风湿关节炎治疗过程中,造成甲氨蝶呤治疗效果不良的形成机制。
1 材料与方法
1.1 材料 实验动物4周龄SD雄性大鼠(清洁级,体重100~120 g)和5周龄雌性Lewis大鼠(清洁级,体重100~120 g),由九动株式会社(鸟栖,日本)提供,所有的动物试验都是根据九州大学制定的护理和使用动物指南而进行的。
1.2 主要试剂及仪器 α-Minimum Essential Medium(αMEM;cat#12000-022)胎牛血清和青霉素购于Invitrogen公司(大岛,纽约)。1,25-(OH)2D3购于英国普利茅斯生物研究实验室。腺苷脱氨酶抗体(H-300):SC-25747购于圣克鲁斯生物技术(美国加利福尼亚州圣克鲁斯)。第二抗体:Alexa Fluor®488 Goat Anti-Rabbit IgG(H+L)和(ECL)试剂盒购于Technologies Corporation(东京,日本)。甲氨蝶呤,脱氧核苷和免疫染色试剂盒购于美国Sigma公司。Kat1表面抗体由九州大学口腔分子解剖学实验室提供。
1.3 骨髓培养系统 全骨髓细胞培养系(破骨细胞形成系):将4周龄SD雄性大鼠用异氟烷麻醉后,无菌条件下取其胫骨和股骨,剪掉骨垢端暴露骨髓腔,然后用25号注射针冲出全骨髓细胞,调整细胞浓度,用24孔培养板(1×106cells/孔)或10 cm培养皿(3.85×106cells/皿),在37℃,体积分数5%CO2培养箱中培养,培养液为含15%FBS的α-MEM培养液。其中要添加1α,25-二羟维生素D3的浓度为10-8mol(V/V),加热处理ROS17/2.8细胞培养基(HT-ROS CM)浓度为10%。培养4或5 d后,进行Kat1免疫染色,其中含有3个以上的核的Kat1阳性细胞作为破骨细胞样多核细胞进行计数。
1.4 免疫染色 全骨髓细胞培养5 d后,用α-MEM培养液冲洗两次:(1)一抗:每孔加入1/100的Kat1抗体(10 μg/ml)200 μl。(2)于37℃培养30 min后,PBS冲洗3次,4%的甲醛溶液固定20 min。(3)用PBS洗4次,加入3%羊血清,室温静置30 min。(4)二抗:移除羊血清,直接加入生物素基化抗体小鼠IgM,室温静置30 min。(5)用PBS清洗6次后,加入发光剂ABCAP(30 min前预制),遮光室温放置30 min。(6)用PBS清洗6次,然后加入CDR(溶于0.1 mol/L Tris-Hcl缓冲液的1 mmol/L左旋咪唑),遮光室温放置30 min后,用PBS冲洗3次,加入5%的戊二醛,再静置30 min。(7)蒸馏水清洗4次,室温下干燥后,高倍显微镜下观察计数,细胞核超过3个的染色阳性细胞为破骨细胞。
1.5 关于Lewis大鼠佐剂性关节炎的诱导 实验对象:12只5周龄雌性Lewis大鼠被分为3组。(1)第1组(对照组):大鼠尾根部行皮下单独注射矿物油,0.5 ml/只。(2)第2组(关节炎组):①大鼠尾根部行皮下注射弗氏佐剂(CFA)为25 mg/kg热灭活M.酪酸;并以矿物油作注射介质;②同时用磷酸盐缓冲盐水(PBS)行腹腔注射,腹腔注射于佐剂皮下注射后第3天开始,1次/周。(3)第3组(治疗组):①首先与关节炎组一样在大鼠尾根部行皮下注射弗氏佐剂(CFA)为25 mg/kg并以矿物油作注射介质;②同时以甲氨蝶呤(1 mg·kg-1·周-1)行腹腔注射,腹腔注射于佐剂皮下注射后第3天开始,1次/周。4周后,所有的后踝关节(含有胫骨远端和距骨)被用来制作石蜡切片并行免疫荧光染色。
1.6 免疫荧光染色(1)石蜡切片(6 μm)脱蜡后,先用10%山羊血清于室温下进行封闭60分钟。(2)切片用(H-300)抗-ADA多克隆抗体(H-300,抗体需用1%山羊血清1∶200稀释)孵育,并置于4℃的湿盒内过夜。(3)切片用PBS清洗6次后,加入与Alexa荧光®488联结的第二抗体goat anti-rabbit IgG(H+L)(A11034,抗体需用1%山羊血清1∶500稀释),暗室内室温下放置60 min。(4)PBS漂洗后,即可用荧光显微镜观察。
2 结果
2.1 在全骨髓细胞培养系(破骨细胞形成系)中,脱氧腺苷废除了甲氨蝶呤对破骨细胞形成的抑制作用。在全骨髓细胞培养系中,甲氨蝶呤显著的抑制了破骨细胞特异性抗体Kat1免疫染色阳性细胞的生成,但是这种抑制作用却随着脱氧腺苷的添加而逐渐地消失了,并且呈一定的剂量依赖关系。见图1、表1。
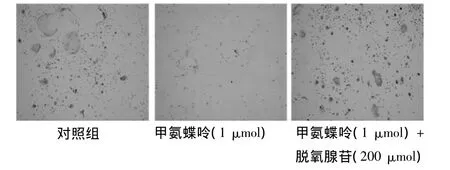
图1 大鼠骨髓细胞培养4 d后,破骨细胞特异性抗体Kat1光镜图像(免疫荧光×20)
表1 甲氨蝶呤和脱氧核苷对破骨细胞生成影响n=4,±s
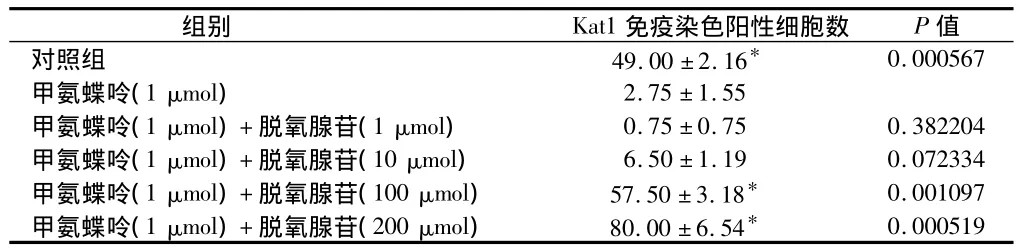
表1 甲氨蝶呤和脱氧核苷对破骨细胞生成影响n=4,±s
注:甲氨蝶呤(1 μmol)比较,*P<0.01
组别Kat1免疫染色阳性细胞数P值对照组49.00±2.16*0.000567甲氨蝶呤(1 μmol)2.75±1.55甲氨蝶呤(1 μmol)+脱氧腺苷(1 μmol)0.75±0.750.382204甲氨蝶呤(1 μmol)+脱氧腺苷(10 μmol)6.50±1.190.072334甲氨蝶呤(1 μmol)+脱氧腺苷(100 μmol)57.50±3.18*0.001097甲氨蝶呤(1 μmol)+脱氧腺苷(200 μmol)80.00±6.54*0.000519
2.2 在佐剂引导的关节炎动物试验模型中,甲氨蝶呤抑制了腺苷脱氨酶水平的表达。腺苷脱氨酶在罹患风湿性关节炎大鼠的骨关节切面上高度表达,而在对照组的骨标本切面上的表达比较低。腺苷脱氨酶高度表达于骨髓细胞和骨细胞外的骨破坏区域,并导致一定的弥漫性强染色模式。而经过甲氨蝶呤注射的罹患风湿性关节炎大鼠标本中,腺苷脱氨酶被明显抑制。见图2、3。
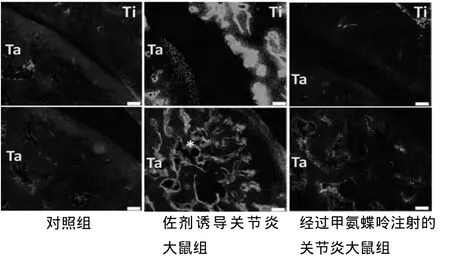
图2 后踝关节的免疫荧光染色,Ti:胫骨,Ta:距骨,标尺:50 μm

图3 关节炎大鼠距骨的骨髓位置中ADA免疫染色最强烈的部位,B:骨组织,BM:骨髓,图标尺:50 μm
3 讨论
目前从许多类风湿性病例来看,甲氨蝶呤能够抑制骨关节滑膜表面的炎性细胞的大量增殖[6],然而关于甲氨蝶呤如何调节炎性骨破坏所作用的分子靶点仍然还是不清楚。据报道,腺苷能够废除甲蝶呤对破骨细胞的形成的抑制以及对炎症性骨破坏关节炎的治疗结果[7]。而腺苷脱氨酶(ADA)是体内调节腺苷和脱氨腺苷代谢的关键酶,它不仅仅降解细胞内的腺苷而且也负责降解能够引起淋巴细胞毒性细胞外腺苷[8]。
腺苷和脱氧腺苷在细胞外主要来源于凋亡细胞DNA的降解,在细胞内主要来源于生理的核酸合成。这些核苷和脱氧核苷在体内又被磷酸化而用来合成ATP或脱氧ATP并被利用合成DNA。而腺苷脱氨酶(ADA)是存在于体内主要来降解腺苷和脱氧腺苷的关键酶。而据最近的文献报道:由于基因突变导致腺苷脱氨酶的先天性缺乏,会引起严重的基因缺陷性疾病。抑制腺苷脱氨酶会引起细胞外腺苷和脱氧腺苷浓度的增高,尤其是脱氧腺苷浓度异常增高,从而会影响DNA的合成[9]。据临床报道,在风湿性关节炎患者的滑膜液中,腺苷脱氨酶的浓度比正常人要高很多[10]。目前的数据表明:(1)在全骨髓细胞培养系(破骨细胞形成系)中,脱氧腺苷废除了甲氨蝶呤对破骨细胞形成的抑制作用,并呈现一定的剂量相关关系。(2)甲氨蝶呤抑制了罹患风湿性关节炎大鼠体内腺苷脱氨酶的水平的表达。所以我们可以推测由于甲氨蝶呤的参与,在骨关节患者的局部病灶(例如某些风湿性关节炎患者的滑膜液)内的腺苷脱氨酶有可能被抑制,从而导致了细胞外腺苷和脱氧腺苷浓度的增高,尤其是脱氧腺苷浓度异常增高。但是由于脱氧腺苷能够有效的拮抗甲氨蝶呤对破骨细胞形成的抑制作用,所以最后造成甲氨蝶呤临床效能大大的降低。近年来,目前对腺苷的细胞表面受体的研究很多,结合目前的数据,腺苷和脱氧核苷表面受体的拮抗剂的引入和对腺苷脱氨酶生理学方面的进一步探索有能成为未来潜在的治疗手段。
1 Shimizu S,Shiozawa S,Shiozawa K,et al.Quantitative histologic studies on the pathogenesis of periarticular osteoporosis in rheumatoid arthritis.Arthritis Rheum,1985,28:25-31.
2 Farber S,Diamond LK.Temporary remissions in acute leukemia in children produced by folic acid antagonist,4-aminopteroyl-glutamic acid.N Engl J Med,1948,238:787-793.
3 Weinblatt ME,Coblyn JS,Fox DA,et al.Efficacy of low-dose methotrexate in rheumatoid arthritis.N Engl J Med,1985,312:818-822.
4 Choi HK,Seeger JD,Kuntz KM.A cost-effectiveness analysis of treatment options for patients with methotrexate-resistant rheumatoid arthritis.Arth Rheumat,2000,43:2316-2327.
5 Barbieri M,Wong JB,Drummond M.The cost effectiveness of infliximab for severe treatment-resistant rheumatoid arthritis in the UK.Pharmacoeconomics,2005,23:607-618.
6 Romas E,Gillespie MT.Inflammation-induced bone loss:can it be prevented?Rheum Dis Clin North Am,2006,32:759-773.
7 Teramachi J,Kukita A,Li YJ,et al.Adenosine abolishes MTX-induced suppression of osteoclastogenesis and inflammatory bone destruction in adjuvant-induced arthritis.Lab Invest,91:719-731.
8 Blackburn MR,Aldrich M,Volmer JB,et al.The use of enzyme therapy to regulate the metabolic and phenotypic consequences of adenosine deaminase deficiency in mice.Differential impact on pulmonary and immunologic abnormalities.J Biol Chem,2000,275:32114-32121.
9 Benveniste P,Zhu W,Cohen A.Interference with thymocyte differentiation by an inhibitor of S-adenosylhomocysteine hydrolase.J Immunol,1995,155:536-544.
10 Erer B,Yilmaz G,Yilmaz FM,et al.Assessment of adenosine deaminase levels in rheumatoid arthritis patients receiving anti-TNF-alpha therapy.Rheumatol Int,2009,29:651-654.
