脱氧雪腐镰刀菌烯醇吸附剂对断奶仔猪生长性能、血清生化指标及肠道形态的影响
2014-03-28徐子伟
邓 波 万 晶,2 徐子伟* 吴 杰,2
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又称呕吐毒素,是一种广泛存在于小麦、大麦、玉米等谷类作物中的单端孢霉烯族毒素[1],畜禽食用污染谷物制成的饲粮会出现恶心、呕吐、腹泻、厌食和胃肠道出血等肠胃炎症状,导致采食量下降、日增重减少。在畜禽中,猪对 DON最为敏感[2],欧 盟 规 定 猪 全 价 料 中 DON限 量 为0.9 mg/kg[3]。我国饲料及饲料原料中 DON 污染情况严重[4-6],2012 年上半年百奥明饲料添加剂(上海)有限公司共检测了421份来自全国各地的饲料和原料样品,结果显示玉米及其副产品的DON阳性检出率高达93%,小麦中DON阳性检出率为90%,猪料和禽料中DON阳性检出率分别为96%和95%[6]。在饲粮中添加毒素吸附剂是目前最有效和最为广泛应用的解毒方法[7]。尽管市面上霉菌毒素吸附剂种类众多,但是对DON吸附效果好的吸附剂极少。传统的矿物质黏土类吸附剂对DON的吸附效果很差,对DON的体外吸附效果最高仅为 30%[8-10],而新型生物类吸附剂如酵母细胞壁、植物纤维(苹果纤维、微缩植物纤维)、腐殖质对 DON 的吸附效果也不好[2,11]。欧盟2009年对毒素吸附剂的调查报告显示,仅活性碳对DON有较好的吸附效果,且不同种类的活性碳对DON的吸附效果不同[12]。本课题组针对DON吸附剂的市场需求和前人的研究进展,在提纯蒙脱土的基础上对其进行碳化改性,再复合成为一种新型的高效吸附DON的吸附剂(主要成分为提纯蒙脱土和碳化蒙脱土),其体内吸附效果如何,需进行动物体内试验才能够确定。因此,本试验采用对DON最为敏感的断奶仔猪作为试验对象,在自然霉变饲粮中添加该高效吸附DON的吸附剂,通过测定断奶仔猪的生长性能、血清生化指标及肠道形态,检验该吸附剂在动物体内吸附DON的效果。
1 材料与方法
1.1 试验材料
本试验所用的高效DON吸附剂由浙江省农业科学院与浙江丰虹新材料股份有限公司合作开发,主要成分为提纯蒙脱土和碳化蒙脱土。
1.2 试验设计及饲粮
选取120头健康状况良好的(36±4)日龄断奶仔猪,随机分为3组(每组4个重复,每个重复10头猪),分别为阴性对照(NC)组、DON组(阳性对照)、DON+吸附剂(DON+AD)组(表1)。试验期28 d。

表1 试验设计Table 1 Experimental design
参考NRC(1998)10~20 kg断奶仔猪营养需要配制基础饲粮,其组成及营养水平见表2,按试验设计要求配制试验饲粮。试验所用玉米为自然霉变玉米,玉米原料和饲粮经免疫亲和柱净化和高效液相色谱测定DON含量,经免疫亲和柱净化和荧光计测定玉米赤霉烯酮(ZEA)含量。测定结果如下:正常玉米中DON含量为514μg/kg,霉变玉米中DON含量为2 500μg/kg;NC组饲粮平均含DON 500μg/kg,DON组 饲 粮 平 均 含 DON 1 600μg/kg,DON+AD组饲粮是在DON组饲粮中添加2‰吸附剂配制而成;NC组、DON组和DON+AD组饲粮中ZEA含量分别为31、21和50μg/kg。
1.3 饲养管理
试验仔猪以重复为单位进行圈养。每组4栏猪,每栏猪10头(公母各占1/2)。试验采用群饲,自由采食和饮水。免疫消毒程序按猪场常规方法进行。试验期观察和记录猪只健康状况,发现死淘猪只后及时进行结料并称重。
1.4 样品采集及测定
1.4.1 生长性能测定
试验以重复为单位记录耗料量。分别于试验第0、14和28天09:00以重复为单位称重,统计阶段耗料量以及总耗料量。以重复为单位分别计算试验 1~14 d、15~28 d及全期(1~28 d)平均日增重、平均日采食量和料重比。
1.4.2 血清生化指标测定
试验第28天称重后,每重复随机选择4头仔猪(公母各占1/2),前腔静脉采血。静置血样至析出血清,离心(3 000 r/min,10 min),分装上清于Eppendorf管中,-20℃冰箱保存,待测。用BTS-370 Plus全自动生化分析仪进行血清总蛋白、白蛋白、尿素氮、葡萄糖含量及乳酸脱氢酶、碱性磷酸酶、肌酸激酶、谷草转氨酶、谷丙转氨酶活性的测定。
1.4.3 肠道形态观察和测定
试验结束后,每组随机选择6头仔猪,屠宰采样。取十二指肠、空肠前段各3 cm,在10%中性福尔马林中固定24 h,经冲水、梯度乙醇脱水、二甲苯透明、石蜡包埋等处理后,以3~4μm的厚度切片,苏木素-伊红染色。在每个组织切片上选取10个完整绒毛的肠组织区域并拍照,使用Image-Pro-Plus 5.0图像分析软件分别测量单个绒毛的绒毛高度和隐窝深度,计算绒毛高度/隐窝深度,然后进行整理及统计分析。

表2 基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet(air-dry basis) %
1.5 数据统计分析
试验数据用Excel 2007进行初步处理,用SPSS 17.0软件中的ANOVA过程进行单因子方差分析(one-way ANOVA),Duncan氏法进行多重比较检验,以P<0.05作为差异显著性判断标准。试验数据以平均值±标准差表示。
2 结果
2.1 DON吸附剂对断奶仔猪生长性能的影响
从表3中可以看出,试验1~14 d,DON组较NC 组平均日增重下降 21.24%(P<0.05),料重比上升 15.15%(P<0.05),平均日采食量无显著差异(P>0.05);在DON污染饲粮中添加吸附剂改善了仔猪生长性能,DON+AD组较DON组平均日增重提高 17.11%(P<0.05),料重比下降 10.53%(P<0.05)。试验 15~28 d,各组间平均日增重和平均日采食量均无显著差异(P>0.05);DON组较NC 组料重比提高 11.63%(P<0.05);在 DON 污染饲粮中添加吸附剂降低了料重比,但差异不显著(P>0.05)。试验全期,各组间平均日增重和平均日采食量无显著差异(P>0.05);DON组较NC组料重比提高13.69%(P<0.05);在 DON 污染饲粮中添加吸附剂后料重比有下降的趋势(P>0.05)。
2.2 DON吸附剂对断奶仔猪血清生化指标的影响
从表4中可以看出,DON组较NC组血清总蛋白含量下降 9.52%(P<0.05),葡萄糖含量上升10.70%(P<0.05)。与 DON 组相比,DON+AD 组血清葡萄糖和尿素氮含量分别下降12.61%和9.32%(P<0.05),总蛋白含量有增加趋势,但差异不显著(P>0.05)。
DON组较NC组血清肌酸激酶、谷丙转氨酶活性分别提高 103.70%和 65.55%(P<0.05)。在DON污染饲粮中加入吸附剂使得血清肌酸激酶、谷丙转氨酶、谷草转氨酶活性恢复到正常水平,DON+AD组较DON组血清肌酸激酶、谷丙转氨酶、谷草转氨酶活性分别降低 45.45%、32.53%和36.17%(P<0.05)。各组间血清乳酸脱氢酶、碱性磷酸酶活性均无显著差异(P>0.05)。
2.3 DON吸附剂对断奶仔猪肠道形态的影响
从表5中可以看出,各组间十二指肠绒毛高度、绒毛高度/隐窝深度差异均不显著(P>0.05);DON+AD组较DON组十二指肠隐窝深度减少8.62%(P<0.05),DON 组与 NC 组隐窝深度无显著差异(P>0.05)。各组间空肠隐窝深度无显著差异(P>0.05);DON组较NC组空肠绒毛高度下降21.18%(P<0.05),绒毛高度/隐窝深度有减小的趋势,但差异不显著(P>0.05);DON+AD组较DON 组空肠绒毛高度提高 16.49%(P<0.05),绒毛高度/隐窝深度增加12.38%,但差异不显著(P>0.05)。
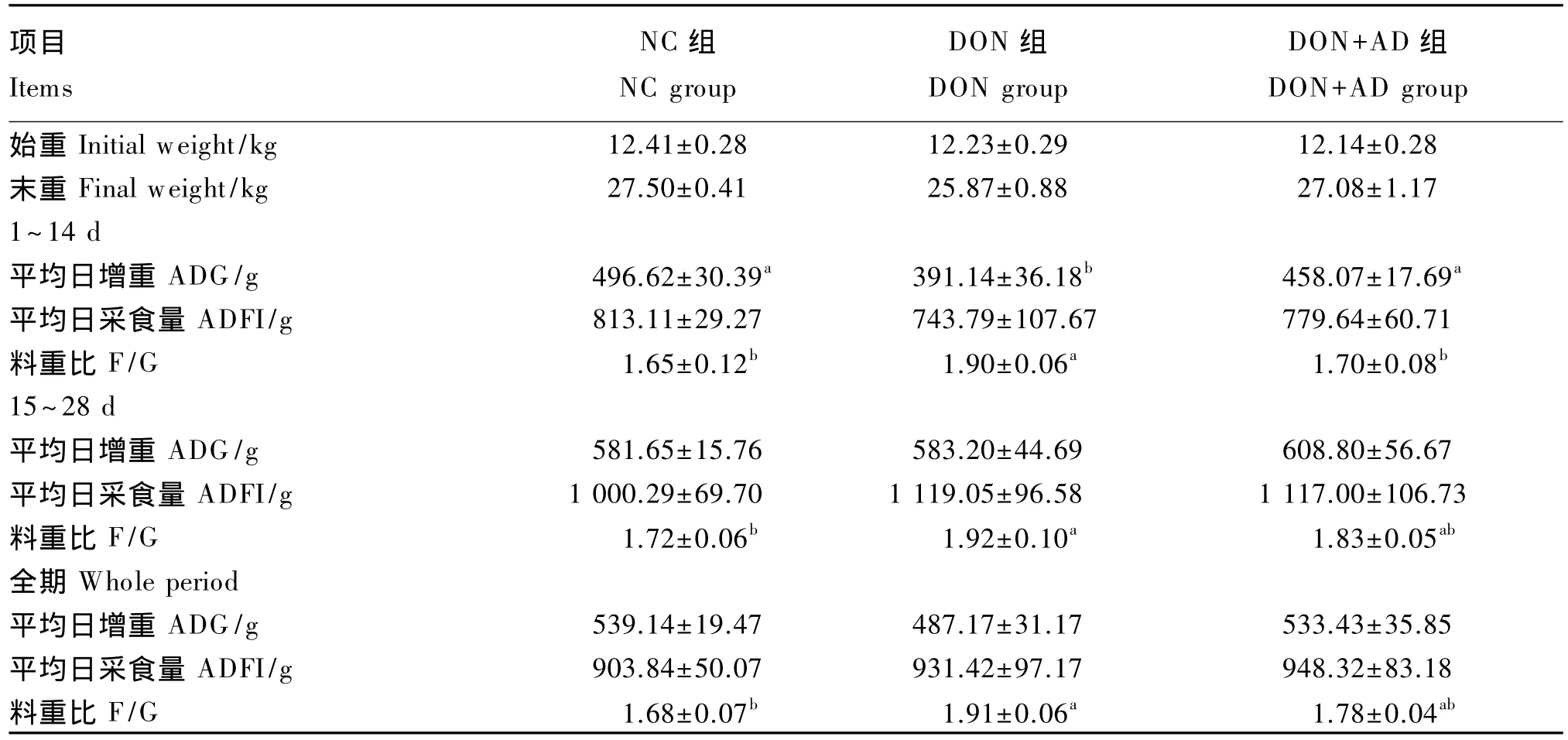
表3 DON吸附剂对断奶仔猪生长性能的影响Table 3 Effects of DON adsorbent on growth performance of weaner piglets
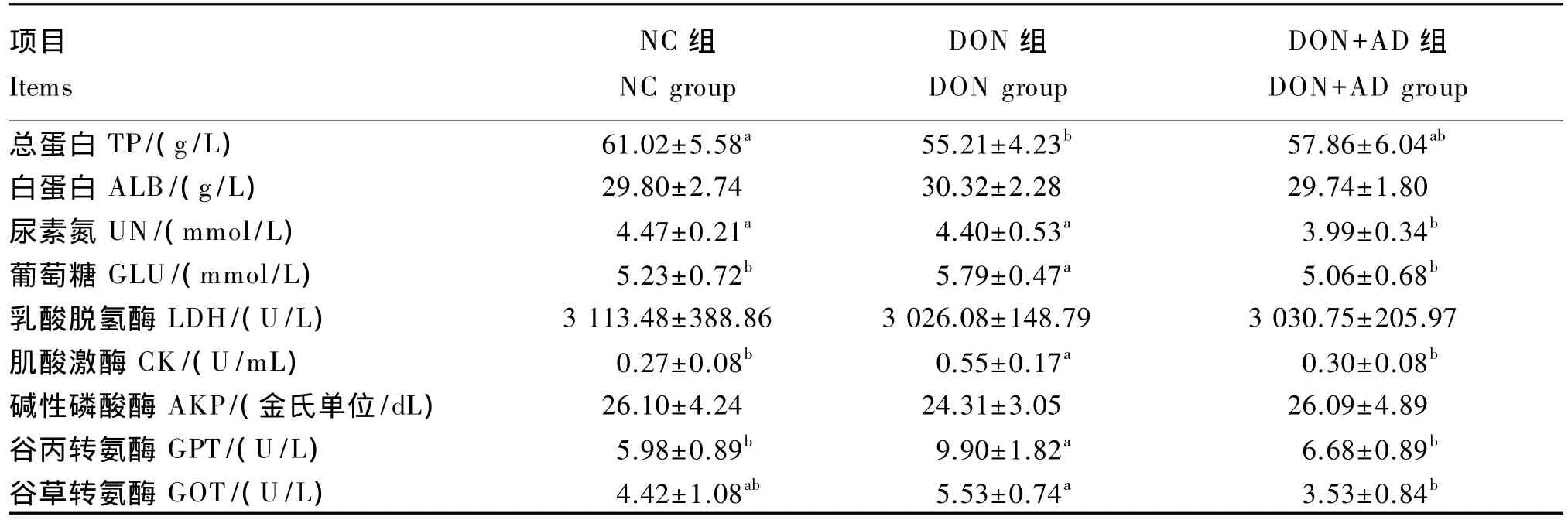
表4 DON吸附剂对断奶仔猪血清生化指标的影响Table 4 Effects of DON adsorbent on serum biochemical indexes of weaner piglets
3 讨论
3.1 DON吸附剂对断奶仔猪生长性能的影响
动物在食用了含有毒素的饲粮后出现的症状包括快速毒性反应、慢性毒性反应和死亡。在实际生产中,霉菌毒素对动物的主要影响并不是导致动物产生某种具体的疾病症状,而是在低剂量长期作用下对动物的新陈代谢、生理功能产生负面作用,进而影响其生长性能[13]。动物摄入DON初期主要表现为采食量下降,在口服DON后可导致动物体出现肠胃炎症状,如恶心、呕吐、腹泻、神经性厌食和胃肠性出血[14]。对1968—2010年间已有报道的试验数据统计显示,DON污染组较对照组生长猪采食量和体增重均下降了26%[15];给猪饲喂含 DON 0.6~2.0 mg/kg的自然霉变饲粮可导致猪采食量和体增重下降[16];但也有报道指出,低剂量的DON对猪生长性能无显著影响,当饲喂含DON 1 mg/kg的饲粮时,对猪的日采食量和日增重均无显著影响[17-18]。上述研究结果的不一致可能由于试验动物体重、年龄、性别、饲粮污染源(霉变谷物或纯品DON)、试验持续时间等方面差异所造成。在本试验1~14 d,DON组较NC组平均日增重显著下降,料重比显著上升,而添加吸附剂则改善了DON对仔猪平均日增重的负面影响。然而,由于动物体代偿/适应机制的建立,仔猪通过自我调节机制减弱DON对其产生的不利影响[18]。在试验 15~28 d,由于猪只个体增大,其对DON的耐受力增强,故导致后期各组间猪只平均日增重无显著差异,这一结果与2010年密西根大学的研究结果[19]一致。本试验中DON组饲粮中DON含量为1 600μg/kg,含量较低,且不存在其他毒素超标的情况,猪只不会受到毒素协同作用的影响,猪只随着体重的增大对DON的敏感性降低,同时自身产生代偿/适应,从而减弱DON对其的不利影响。蒋竹英等[20]的研究也证实,当低剂量的DON污染饲粮时,随着时间的延长,并且在不存在其他毒素的毒性协同作用下,断奶仔猪在试验的过程中会逐渐产生对DON污染饲粮的耐受适应能力。从全期来看,DON组较NC组仔猪平均日增重和平均日采食量均有下降的趋势,但差异不显著,添加吸附剂改善了DON对仔猪平均日增重及平均日采食量的不利影响。
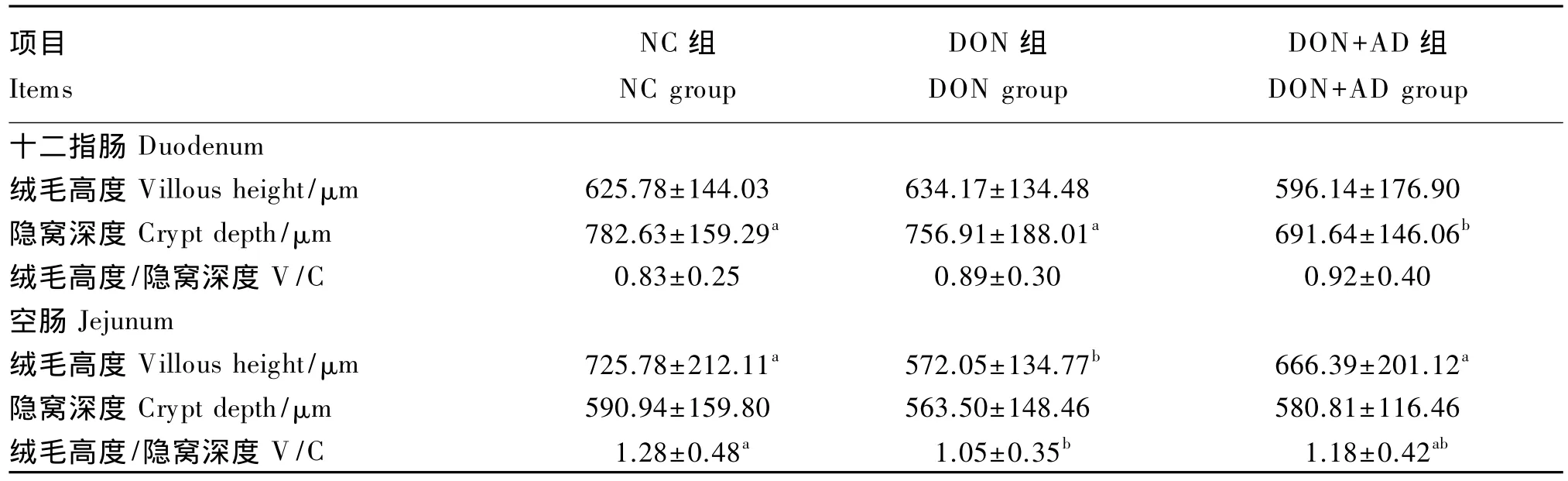
表5 DON吸附剂对断奶仔猪肠道形态的影响Table 5 Effects of DON adsorbent on intestinal morphology of weaner piglets
3.2 DON吸附剂对断奶仔猪血清生化指标的影响
血清总蛋白由肝脏合成,其含量反映了肝脏蛋白质合成功能,在一定程度上代表了饲粮中蛋白质水平和家畜对蛋白质的消化吸收程度。当动物体发生应激时,血清总蛋白含量降低,葡萄糖含量升高[21-22]。本试验中 DON组较 NC组血清总蛋白含量显著下降,葡萄糖含量显著升高,而添加吸附剂显著降低了血清葡萄糖含量,对血清总蛋白含量有增加的趋势。血清谷草转氨酶、谷丙转氨酶、肌酸激酶是动物是否出现应激的指标,当动物出现应激时,血清中这些酶活性会显著升高;同时,血清谷草转氨酶和谷丙转氨酶还可反映肝脏的功能,当肝脏功能受损时,肝脏细胞机能受损,从而导致胞内酶的外流增加,胞内酶大量释放到血液中,导致血清中酶活性明显上升。当一定量DON刺激动物体时,会造成血清谷草转氨酶、谷丙转氨酶、肌酸激酶活性上升[22]。本试验中 DON组较NC组血清谷丙转氨酶、肌酸激酶活性显著上升,谷丙转氨酶活性有增加的趋势。而添加吸附剂则显著降低了血清中这3种酶的活性,提示吸附剂对动物体的应激有一定的缓解作用,对肝脏功能有保护的作用。
3.3 DON吸附剂对断奶仔猪肠道形态的影响
动物对毒素的吸收和组织脏器内毒素的分布都是由肠道的吸收功能所调控的。肠道上皮被完全暴露在污染的饲粮中,并成为毒素的首要影响对象。大多数的DON在肠道上部(十二指肠和空肠)通过细胞旁路被吸收[23],DON进入血液循环后,通过肠肝循环重新进入肠腔[24]。小肠绒毛主要负责营养物质的吸收,绒毛可增加肠壁的表面积,绒毛高度越高说明成熟细胞越多,对营养物质的吸收功能越强;隐窝深度反映细胞的成熟率,当细胞成熟率下降时,隐窝深度变浅,分泌功能增强;绒毛高度/隐窝深度综合反映了小肠的吸收功能,比值越大说明小肠的吸收功能越强。一些研究表明毒素会对肠道绒毛形态产生影响。低剂量的DON可使猪空肠绒毛高度下降,绒毛融合并萎缩[13,25]。同样的情况在家禽中也被发现,不同剂量的DON会导致家禽十二指肠和空肠绒毛高度的减少,从而降低肠道吸收面积[26-28]。本试验观察到DON组仔猪空肠绒毛高度显著下降,绒毛高度/隐窝深度显著减少,表明自然霉变饲粮能损伤仔猪空肠的形态结构,与前人研究结果一致。而添加吸附剂后仔猪空肠绒毛高度和绒毛高度/隐窝深度均恢复到与NC组一致的水平。DON可抑制蛋白质合成,而肠绒毛和隐窝上蛋白质转换的频率较高,因此不难发现在动物摄入DON后其肠道黏膜结构发生了改变[29],而添加吸附剂后则对仔猪肠道黏膜形态起到了一定的保护作用。
本试验选用的饲粮基本不含有其他毒素,因此能够较好地表现出该吸附剂对于DON的高效吸附性能。由于市面上其他的吸附剂对于DON的吸附效果较差,常见的矿物质黏土类吸附剂、葡甘露聚糖等生物材料吸附剂都无法对DON进行有效的吸附[10],本试验所使用的吸附剂对于提高断奶仔猪的生长性能有一定的效果。在今后的试验中,应在更高DON剂量和多种毒素混合污染情况下检测该吸附剂对家畜的保护作用。
4 结论
① 试验1~14 d,DON污染饲粮使仔猪平均日增重显著下降,料重比显著上升;由于仔猪对DON产生一定耐受,导致试验15~28 d和全期生长性能在统计学上无显著差异。
②DON污染饲粮使仔猪血清肌酸激酶、谷丙转氨酶活性显著提高,仔猪空肠绒毛高度和绒毛高度/隐窝深度显著下降;添加吸附剂后血清中上述酶活性恢复到正常水平,在一定程度上缓解了DON对断奶仔猪肠道所产生的损伤。
致谢:对浙江丰虹新材料股份有限公司提供DON吸附剂材料和部分研究经费表示感谢。
[1] TRAN S T,SMITH T K.A survey of free and conjugated deoxynivalenol in the 2009,2010 and 2011 cereal crops in Australia[J].Animal Production Science,2013,53(5):407-412.
[2] DANICKE S,BROSIG B,KLUNKER L R,et al.Systemic and local effects of the Fusarium toxin deoxynivalenol(DON)are not alleviated by dietary supplementation of humic substances(HS)[J].Food and Chemical Toxicology,2012,50(3):979-988.
[3] European Commission.Commission recommendation of 17 August 2006 on the presence of deoxynivalenol,zearalenone,ochratoxin A,T-2 and HT-2 and fumonisins in products intended for animal feeding[J].Official Journal of the European Union,2006,229:7-9.
[4] 黄广明,李肖红,阳艳林,等.2012年上半年饲料中霉菌毒素污染状况的分析[J].养猪,2012(6):13-15.
[5] 马皎洁,邵兵,林肖惠,等.我国部分地区2010年产谷物及其制品中多组分真菌毒素污染状况研究[J].中国食品卫生杂志,2011,23(6):481-488.
[6] 王金勇,刘颖莉.2012年上半年中国霉菌毒素普查报告[J].中国畜牧杂志,2012,48(18):25-28.
[7] KOLOSOVA A,STROKA J.Substances for reduction of the contamination of feed by mycotoxins:a review[J].World Mycotoxin Journal,2011,4(3):225-256.
[8] GALVANO F,PIETRI A,BERTUZZI T,et al.Activated carbons:in vitro affinity for ochratoxin A and deoxynivalenol and relation of adsorption ability to physicochemical parameters[J].Journal of Food Protection,1998,61(4):469-475.
[9] TOMASEVIC-CANOVIC M,DAKOVIC A,ROTTINGHAUS G,et al.Surfactant modified zeolites-new efficient adsorbents for mycotoxins[J].Microporous and Mesoporous Materials,2003,61(1):173-180.
[10] AVANTAGGIATO G,SOLFRIZZO M,VISCONTI A.Recent advances on the use of adsorbent materials for detoxification of Fusarium mycotoxins[J].Food Additives and Contaminants,2005,22(4):379-388.
[11] TANGNI E K.Occurrence of mycotoxins in beer,exposure assessment for consumers and development of biological detoxification options for the control of ochratoxin A during brewing[D].Ph.D.Thesis.Belgium:Universite Catholique De Louvain,2003.
[12] BOUDERGUE C,BUREL C,DRAGACCI S,et al.Review of mycotoxin-detoxifying agents used as feed additives:mode of action,efficacy and feed/food safety[J/OL].Scientific Report Submitted to EFSA,2009[2012- 11- 01].http://www.adiveter.com/ftp/articles/A1041209.
[13] BRYDEN W L.Mycotoxin contamination of the feed supply chain:implications for animal productivity and feed security[J].Animal Feed Science and Technology,2012,173(1):134-158.
[14] PESTKA J J,SMOLINSKI A T.Deoxynivalenol:toxicology and potential effects on humans[J].Journal of Toxicology and Environmental Health,2005,8(1):39-69.
[15] ANDRETTA I,KIPPER M,LEHNEN C R,et al.Meta-analytical study of productive and nutritional interactions of mycotoxins in growing pigs[J].Animal,2011,6(9):1476-1482.
[16] OVERNES G,MATRE T,SIVERTSEN T,et al.Effects of diets with graded levels of naturally deoxynivalenol-contaminated oats on immune response in growing pigs[J].Journal of Veterinary Medicine,1997,44(9/10):539-550.
[17] DANICKE S,VALENTA H,DOLL S.On the toxicokinetics and the metabolism of deoxynivalenol(DON)in the pig[J].Archives of Animal Nutrition,2004,58(2):169-180.
[18] ROTTER B A,THOMPSON B K,LESSARD M,et al.Influence of low-level exposure to Fusarium mycotoxins on selected immunological and hematological parameters in young swine[J].Toxicological Sciences,1994,23(1):117-124.
[19] GRETCHEN H,DALE R.Evaluation of three commercial mycotoxin inhibitors added to vomitoxin contaminated corn diets for weanling pigs[J].MSU Pork Quarterly,2010,15(2):1-6.
[20] 蒋竹英,范觉鑫,陈明洪,等.脱氧雪腐镰刀菌烯醇污染饲粮对断奶仔猪血液生理生化指标的影响及竹炭和竹醋液的干预作用[J].动物营养学报,2012,24(12):2459-2468.
[21] GBORE F A,YINUSA R I,SALLEH B.Evaluation of subchronic dietary fumonisin B1on nutrient digestibility and growth performance of rats[J].African Journal of Biotechnology,2010,9(38):6442-6447.
[22] 吴苗苗,肖昊,印遇龙,等.谷氨酸对脱氧雪腐镰刀菌烯醇刺激下的断奶仔猪生长性能,血常规及血清生化指标变化的干预作用[J].动物营养学报,2013,25(7):1587-1594.
[23] SERGENT T,RIBONNE L,KOLOSOVA A,et al.Molecular and cellular effects of food contaminants and secondary plant components and their plausible interactions at the intestinal level[J].Food and Chemical Toxicology,2008,46(3):813-841.
[24] DIESING A K,NOSSOL C,DANICKE S,et al.Vulnerability of polarised intestinal porcine epithelial cells to mycotoxin deoxynivalenol depends on the route of application[J].PLoS One,2011,6(2):e17472.
[25] KOLF-CLAUW M,CASTELLOTE J,JOLY B,et al.Development of a pig jejunal explant culture for studying the gastrointestinal toxicity of the mycotoxin deoxynivalenol:histopathological analysis[J].Toxicology in Vitro,2009,23(8):1580-1584.
[26] AWAD W A,BOHM J,RAZZAZI-FAZELI E,et al.Effects of feeding deoxynivalenol contaminated wheat on growth performance,organ weights and histological parameters of the intestine of broiler chickens[J].Journal of Animal Physiology and Animal Nutrition,2006,90(1/2):32-37.
[27] YUNUS A W,BLAJET-KOSICKA A,KOSICKI R,et al.Deoxynivalenol as a contaminant of broiler feed:intestinal development,absorptive functionality,and metabolism of the mycotoxin[J].Poultry Science,2012,91(4):852-861.
[28] GIRISH C K,SMITH T K.Effects of feeding blends of grains naturally contaminated with Fusarium mycotoxins on small intestinal morphology of turkeys[J].Poultry Science,2008,87(6):1075-1082.
[29] GRENIER B,APPLEGATE T J.Modulation of intestinal functions following mycotoxin ingestion:meta-analysis of published experiments in animals[J].Toxins,2013,5(2):396-430.
