罗格列酮对糖尿病大鼠肾脏Smad7、TGF-β1及Ⅳ型胶原表达的影响及意义
2014-03-27陈宽林方明明张玉颖张丽莉
陈宽林,方明明,张玉颖,张丽莉
(江苏建康职业学院 1内科教研室, 2教务处,南京 210029)
糖尿病肾病是糖尿病常见慢性并发症,研究显示与高血糖所致相关炎性因子导致肾脏转化生长因子β1(transforming growth factor-β1,TGF-β1)合成增加,诱导成纤维细胞过度增殖、胶原高表达有关,并且通过Smads家族介导[1]。罗格列酮因其可能诱发或加重心力衰竭而曾备受争议,但最新研究证实其在无基础心脏疾病的糖尿病患者中应用的安全与可靠性,而且还可以抑制糖尿病肾病发生与发展[2]。为了进一步了解罗格列酮在糖尿病肾病发病机制中的作用,本研究观察了罗格列酮对链脲佐菌素诱导的糖尿病SD大鼠肾脏Smad7、TGF-β1和Ⅳ型胶原的表达,以及糖基化血红蛋白A1c(glycosylated hemoglobin A1c,GHbA1c)水平,以观察和探讨罗格列酮对糖尿病大鼠肾脏保护作用及机制。
1 材料和方法
1.1动物 鼠龄3个月左右SD雄性大鼠若干(购自南京盛名科研动物中心,清洁级),体质量210~250 g,对其先行室温、自然光下正常饲养1周,以0.1 mmol/L、pH4.8无菌磷酸盐缓冲液(phosphate buffered solution,PBS)配置浓度为2%的链脲佐菌素注射液,按照60 mg/kg体质量进行一次性腹腔注射,分别在注射后24 h和48 h两次测量尾静脉血糖,连续两次血糖水平在16.7 mmol/L以上者作为实验性糖尿病大鼠成功模型。选择制模成功的20只大鼠随机分为罗格列酮组10只,生理盐水对照组10只。
1.2方法
1.2.1主要试剂与仪器
1.2.1.1试剂 Smad7(编号BA1399)、TGF-β1(编号BA0290)、Ⅳ型胶原(编号BA2174)免疫组织化学试剂,即用链霉亲和素-生物素复合物(streptavidin biotin complex,SABC)(编号SA1025)、5%小牛血清蛋白封闭液、生物素标记二抗(以上试剂为SABC配套试剂盒)、二氨基联苯胺(编号AR1022)显色剂等试剂盒均购自武汉博士德(Boster)生物工程有限公司;大鼠GHbA1c免疫酶联吸附(enzyme-linked immuno sorbent assay,ELISA)检测试剂购自上海恒远生物科技有限公司(编号HY22591E);链脲佐菌素购自Sigma公司(编号S-0130);临床用罗格列酮片由成都恒瑞制药有限公司生产(批准文号:国药准字H20036509,生产日期2010/06/02);0.1 mmol/L PBS(分析纯)、去离子水、30%双氧水(分析纯)。
1.2.1.2仪器设备 莱卡切片机(UC07,德国徕卡仪器公司生产),双目镜奥林巴斯光学显微镜(CX31,日本奥林巴斯光学显微镜公司生产),酶标仪(Bio-Rad 750,美国BIO-RAD伯乐生产),烤箱,低温冰箱,微波炉等。
1.2.2动物处理 以注射用生理盐水为溶剂配置浓度为0.2 g/L罗格列酮,每日1次定时称重后罗格列酮组按1 mg/kg体质量罗格列酮灌胃,生理盐水对照组以与体质量相对应剂量生理盐水灌胃。实验期间,常规喂饲大鼠专用饲料、常温下饲养。给药期满后,以提拉颈椎法处死大鼠,立即剖腹取适当大小肾脏标本经4%PBS甲醛充分固定,石蜡包埋。
1.2.3切片染色及免疫组织化学法测定 切片厚度4 μm,免疫组织化学实验过程及步骤严格按相关试剂说明书要求进行,现用现配3%新鲜双氧水,采用免疫组织化学专用复合消化酶法修复抗原。所有切片均经苏木素轻度复染后透明,中性树脂盖玻片封片。
1.2.4切片观察及数据采集 本实验观察指标均采用生物素标记、二氨基联苯胺显色法显色,指标阳性结果显色均为棕(黄)色。所有切片在10×20镜下选择5个视野摄片,经由Image-Pro Plus6图像分析软件分析平均阳性面积率。
1.2.5大鼠GHbA1c测定 采用ELISA法检测大鼠血浆GHbA1c,450 nm波长读数。

2 结 果
2.1组间各指标阳性表达 两组间Smad7、TGF-β1及Ⅳ型胶原表达免疫组织化学阳性表达结果分别见图1、图2及图3(图见封三)。图片中棕色或棕褐色者为各指标的阳性表达。图1显示两组Smad7表达,罗格列酮组阳性表达率显著高于生理盐水对照组;图2显示两组TGF-β1表达,罗格列酮组阳性表达率显著低于生理盐水对照组;图3显示两组Ⅳ型胶原表达,罗格列酮组阳性表达率显著低于生理盐水对照组。
2.2组间指标统计结果 两组间各项对应指标方差齐性检验结果显示,组间指标方差齐性一致(P均>0.05)。两组的Smad7表达阳性面积百分率比较,罗格列酮组的表达显著高于生理盐水对照组(P<0.01);两组TGF-β1和Ⅳ型胶原的表达阳性面积百分率比较,罗格列酮组的表达均显著低于生理盐水对照组(P<0.01);两组的GHbA1c水平比较,差异无统计学意义(P>0.05)(表1)。
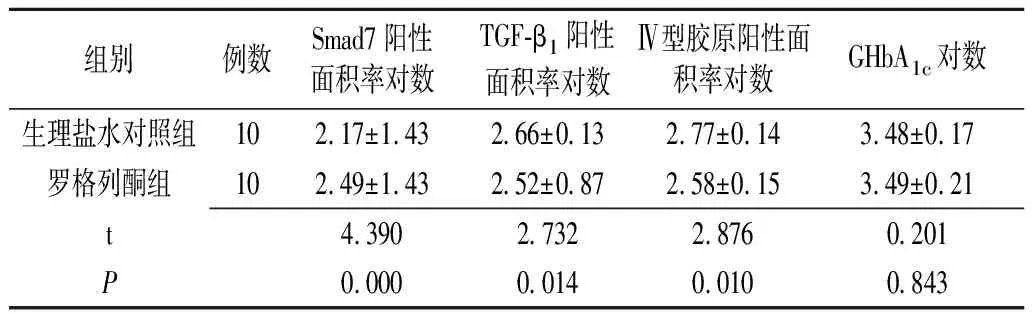
表1 两组糖尿病大鼠肾各观察指标表达阳性面积百分率对数统计分析结果 (%)
TGF-β1:转换生长因子β1;GHbA1c:糖基化血红蛋白A1c
2.3组内指标相关性 组内各指标间相关关系统计比较结果见表2。两组内Smad7与TGF-β1、Ⅳ型胶原之间呈负性相关,TGF-β1与Ⅳ型胶原表达呈正性相关,但均无统计学意义(P>0.05)。
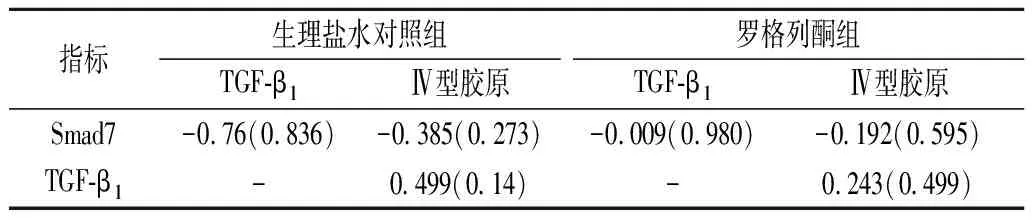
表2 糖尿病大鼠肾组内指标相关关系分析结果 [RR(P)]
TGF-β1:转换生长因子β1;“-”:自身对照,未做相关性分析
3 讨 论
糖尿病肾病基本病理改变在于肾小球基质胶原代谢紊乱,尤其Ⅳ型胶原是糖尿病肾病基质增生的主要成分。实验表明,Ⅳ型胶原的代谢受TGF-β1介导调控:TGF-β1促进Ⅳ型胶原合成,此作用可被抗TGF-β1抗体抑制;同时TGF-β1具有抑制蛋白水解酶合成、刺激蛋白水解酶抑制物产生[3-4]。TGF-β所介导上述纤维化均通过Smad信号通路转导,Smad蛋白是目前所知的唯一TGF-β受体的胞内激酶底物,介导了TGF-β胞内信号转导。TGF-β1信号转导经由Smad完成,作为TGF-β受体系统下游信号转导分子有三种:调节型Smad、辅助型Smad、抑制性Smad。磷酸化后的调节型Smad,结合型辅助型Smad或抑制型Smad进入核内,与DNA结合伴侣作用于相应基因,如Ⅳ型胶原和相关的分解酶基因,调节其转录和表达,使得Ⅳ型胶原的合成增加而分解减少,导致肾小球系膜细胞外和肾小管间质的基质增加。
内源性Smad7的表达是TGF-β致纤维化作用的一个关卡:只有通过它才能出现致纤维化反应。Li等[5]研究发现,正常大鼠肾小管上皮细胞和肾小球系膜细胞在高糖刺激后TGF-β1上调,Smad信号通路被激活,Smad2和Smad3发生磷酸化并移位至细胞核内,同时Ⅰ型胶原的合成增加。Smad7可明显抑制高糖诱导的系膜细胞和肾小管上皮细胞Smad2、Smad3活化及Ⅰ型胶原合成,下调Smad3表达可以抑制TGF-β1诱导的细胞生长[6],应用Smad2/3阻断剂Smad7和联蛋白素连接激酶阻断剂可阻断上皮间充质转化和减轻肾脏纤维化[7],剔除Smad7基因的链脲佐菌素诱导糖尿病大鼠肾小球基质Ⅰ型胶原和Ⅳ型胶原的水平显著增加[8]。这些研究都进一步表明TGF-β1/Smad信号通路是导致进展性肾小管间质纤维化的关键通路,肾纤维化受Smad2和Smad3的正向调节和Smad7的负向调节。
本实验结果显示,罗格列酮组Smad7表达率显著高于生理盐水对照组,TGF-β1、Ⅳ型胶原表达率显著低于生理盐水对照组,说明罗格列酮不但通过上调Smad7表达抑制TGF-β1诱导的Ⅳ型胶原增殖作用,同时具有抑制TGF-β1表达功能,而两组间GHbA1c水平的差异并无统计学意义。因此,上述结果与罗格列酮降糖作用似无关联,是否与其通过抑制其他炎性因子和糖尿病氧化应激而抑制TGF-β1表达尚待进一步研究。尽管罗格列酮因其可能增加临床心力衰竭的风险而备受争议,但动物实验结果显示罗格列酮长期使用不但没有增加心力衰竭风险,相反有助于改善合并心力衰竭大鼠肾脏对水盐调节[9-10]。Arora等[2]实验表明,罗格列酮能够阻止实验性糖尿病大鼠肾病进展,本组实验罗格列酮具有通过调节实验性糖尿病大鼠肾脏Smad7、TGF-β1表达影响肾脏Ⅳ型胶原表达,抑制基质纤维化,具有保护糖尿病肾脏作用。
[1] Blanchette F,Rudd P,Grondin F,etal.Involvement of Smads in TGF-beta1-induced furin (fur) transcription[J].J Cell Physiol,2001,188(2):264-273.
[2] Arora MK,Reddy K,Balakumar P.The low dose combination of fenofibrate and rosiglitazone halts the progression of diabetes-induced experimental nephropathy[J].Eur J Pharmacol,2010,636(1/3):137-144.
[3] Ziyadeh FN,Sharma K,Ericksen M,etal.Stimulation of collagen gene expression and protein synthesis in murine mesangial cells by high glucose is mediated by activation of transforming growth factor-beta[J].J Clin Invest,1994,93(2):536-542.
[4] Slernberg M,Cohen-Fotere L,Peyroux J,etal.Connective tissue in diabetes mellitus:Biochemical alternations of the extracellular matrix with special reference to proteoglycans,collagens and basement membranes[J].Diabet Metab,1985,11(1):27-50.
[5] Li JH,Huang XR,Zhu HJ,etal.Role of TGF-β signaling in extracellula matrix production under high glucose conditions[J].Kidney Int,2003,63(6):2010-2019.
[6] Nicolas FJ,Lehmann K,Warne PH,etal.Epithelial to mesenehymal transition in Madin-Darby can ine kidney cells is accompanied by downregulation of Smad3 expression,leading to resistance to transforming growth factor-beta-induced growth arrest[J].J Biol Chem,2003,278(5):3251-3256.
[7] Li Y,Yang J,Dai C,etal.Role for integrin-linked kinase in mesenchemal tubular epithelial to mesenchymaltransition and renalinterstitialfibrogenesis[J].J Clin Invest,2003,112(4):503-516.
[8] Chen HY,Huang XR,Wang W,etal.The protective role of Smad7 in diabetic kidney disease:mechanism and therapeutic potential[J].Diabetes,2011,60(2):590-601.
[9] Wilson SM,Mansley MK,Getty J,etal.Effects of peroxisome proliferator-activated receptor γ agonists on Na+transport and activity of the kinase SGK1 in epithelial cells from lung and kidney[J].Br J Pharmacol,2010,159(3):678-688.
[10] Goltsman I,Wang X,Lavallie ER,etal.Effects of chronic rosiglitazone treatment on renal handling of salt and water in rats with volume-overload congestive heart failure[J].Circ Heart Fail,2011,4(3):345-354.
