落花生茎叶生物碱的辐照提取及其定性定量分析
2014-03-27鉏晓艳江洪有耿胜荣
鉏晓艳 李 新 谷 峰 廖 涛 江洪有 耿胜荣
(湖北省农业科技创新中心/湖北省农业科学院农产品加工与核农技术研究所/湖北省农产品辐照工程技术中心 武汉 430064)
落花生茎叶为豆科植物落花生属落花生(Arachis hypogaeaL.)的茎叶,落花生茎叶茎高30−70 cm,匍匐或直立;双数羽状复叶互生,长圆形至倒卵圆形,长2.5−5.5 cm,宽1.4−3 cm[1]。一直以来,落花生茎叶被丢弃或晒干焚烧,造成相当严重的资源浪费和环境负担。2011年中国落花生播种面积为470万公顷,总产量约为1620万吨。大面积的落花生种植为我们提供优质落花生产品的同时,也亟需我们为落花生茎叶等秸秆农副产物找到高值转化的出口。多项研究表明落花生茎叶具有宁神降压、促进睡眠的功效[2-4],是具有高值转化潜力的农副产品。
在落花生茎叶有效物质提取技术方面,传统用的浸渍法、渗漉法、煎煮法、热回流提取法等,对植物的天然活性成分破坏很大[5-6]。利用60Co γ-射线辐照技术辅助提取植物中活性物质的文献报道很少,相关专利如公开号 CN101961357A[7]和CN103275136A[8],发明人都是采取辐照预处理植物原料后,再进行溶剂提取,该方法不仅操作繁琐耗时,且工艺过程需要较高能耗(即较高辐射剂量)。
本研究以落花生茎叶为研究对象,通过用60Co γ-射线辐照源进行低剂量常温辐照与溶剂萃取相结合的方法促进落花生茎叶功能成分的溶出,选择性地提取目标化合物,并通过大孔树脂进行分离纯化,获得落花生茎叶生物碱,并对其进行定性定量分析。为落花生茎叶中总生物碱的提取、分离和纯化提供了新颖高效的方法。
1 材料与方法
1.1 材料与试剂
落花生茎叶,采收于武汉市野芷湖周围,采收后清洗、晾干、粉碎过40目备用。大孔吸附树脂HPD100、D-101、AB-8、HPD722、NKA-9、HPD600,郑州勤实科技有限公司提供。盐酸小檗碱(含量≥98%),上海源叶生物科技有限公司提供。胆碱,东京化成工业株式会社提供。其他试剂均为分析纯,国药集团化学试剂有限公司提供。
1.2 仪器与设备
60Co γ-射线辐照源(活度1.11×1016Bq),湖北省辐照实验中心;TU-1810紫外可见分光光度计(北京普析通用);MB99-1液相色谱分离层析仪(上海沪西);RE-52 旋转蒸发仪(上海亚荣);KQ3200DB型超声清洗仪(昆山市超声仪器);LC-20AT高效液相色谱仪(日本岛津)。
1.3 方法
1.3.160Co γ-射线辐照源常温辐照
称取2 g落花生茎叶粉末置于包装袋中,加入三氯甲烷80 mL,封口,60Co γ-射线常温辐照,剂量1−18 kGy(10组剂量),对照组为超声波法,功率100 W,25 ℃超声提取2 h。然后抽滤,上清液用三氯甲烷定容至100 mL,取1 mL于25 mL容量瓶中,用三氯甲烷定容,备用。
1.3.2 总生物碱的测定
标准曲线的绘制:精密称取20 mg盐酸小檗碱标准品,加少量水超声溶解,转移至50 mL容量瓶中,加水定容至刻度,取1 mL置于10 mL容量瓶中,加水定容至刻度,摇匀,即得0.04 mg·mL−1标准品溶液。精密吸取标准品溶液0、0.5、1.0、1.5、2.0、2.5 mL,加三氯甲烷至5 mL,加入溴甲酚绿缓冲液和0.2 mol·L−1NaOH溶液各1 mL,振摇1min,静置30 min,取澄清的三氯甲烷液在415 nm波长处进行测定。以浓度为横坐标,吸光值为纵坐标,制作标准曲线。
样品的测定:取待测液1.0 mL,加三氯甲烷至5 mL,加溴甲酚绿缓冲液和0.2 mol·mL−1NaOH溶液各1 mL,振摇1 min,静置30 min,取澄清的三氯甲烷液,以空白做参比,415 nm处测其吸光度。根据标准曲线计算其浓度。总生物碱含量(%)按公式(1)计算。

公式1中,c为根据标准曲线得到的生物碱浓度(mg·mL−1);b为稀释倍数;v为待测液总体积;m为样品质量。
1.3.3 树脂静态吸附率测定
称取预处理过的6种树脂各4.0 g装入100 mL容量瓶中,按40(大孔吸附树脂,g):1(生物碱,g)加入生物碱0.1 g,用50 mL甲醇溶解后置于振荡器上振荡,加快树脂吸附。振荡1 h放置48 h后,测定溶液中生物碱在最大吸收波长处的吸光度变化,静态吸附率(%)计算见公式2。

公式2中,A0为吸附前溶液中生物碱吸光度;A为吸附后溶液中生物碱吸光度。
1.3.4 洗脱剂的筛选
辐照后的样品,旋转蒸发去除氯仿,分别加入60%、70%、80%甲醇和60%、70%、80%、95%乙醇于离心管中,置于超声仪中,25 ℃下超声2 h后离心(3000 r·min−1,10 min)。取样品上清液各0.5 mL于离心管中,稀释20倍至10 mL,取1 mL稀释液加三氯甲烷至5 mL,加入溴甲酚绿缓冲液和0.2 mol·L−1NaOH溶液各1 mL,摇匀后进紫外分光光度计进行200−800 nm的全波长扫描(参比液为各分离剂稀释液),以吸光值来选择洗脱剂。
1.3.5 大孔树脂纯化
装柱、上样和洗脱:取洁净层析柱(规格:40 cm× 1.6 cm),用玻璃棒将AB-8与95%乙醇(超声除气泡)混合物分多次导流入层析柱,避免出现气泡。树脂预处理:装柱后静置2 h,用蒸馏水淋洗过夜,至洗出液无乙醇味,且洗出液与乙醇混合后无浑浊。取生物碱粗分离物,用0.5 mol·L−1HCL溶解后定容至100 mL,再用NaOH调pH为10.5后上样,上样后静置2 h。考虑到蒸馏水与60%甲醇(pH=2.7)之间的过渡,我们采用20% 甲醇(pH=7.0)、40% 甲醇(pH=7.0)、60% 甲醇(pH=4.0)、60% 甲醇(pH=3.5)、60%甲醇(pH=2.7)各100 mL进行梯度洗脱。
接样及检测:在恒流泵流速600,自动接收器接收间隔2 min 35 s/试管的情况下进行洗脱,洗脱液用小管收集后加入溴甲酚绿缓冲液和0.2 mol·L−1NaOH溶液,进行全波长扫描检测。合并峰值较高的检测液,即为纯化后的生物碱,冻干备用。
1.3.6 落花生茎叶生物碱定性定量分析
对照品溶液制备:取胆碱对照品适量,精密称定,配制成浓度为1.5、3、6、12、24 mg·mL−1的溶液,0.45 μm微孔过滤膜滤过。
供试品溶液制备:取200 mg冻干后的落花生茎叶生物碱粉末,精密称定,置具塞锥形瓶中,加入1%盐酸甲醇10 mL,超声处理(功率100 W,温度25 ℃)60 min,放冷,用1%盐酸甲醇补足减失质量,摇匀,0.45 μm微孔过滤膜滤过,取续滤液。
色谱条件:色谱柱:C18柱(250 mm×4.60 mm,5 μm);流动相:乙腈:0.05 mol·L−1磷酸二氢钾(用磷酸调节pH=2.8)=1:1(内含0.015 mol·L−1己烷基磺酸钠);流速:1 mL·min−1;柱温:35 ℃;进样量:10 μL;检验波长:304 nm。
2 结果与分析
2.1 不同吸收剂量对生物碱提取效果的影响
根据总生物碱标准曲线y=17.834x+0.0006,(R2=0.9999)计算样品中生物碱含量。由图1可知,总生物碱的含量随着吸收剂量的增加,先上升后下降;在吸收剂量为 5 kGy时达到最高(7.970±0.117)%,与超声波法提取结果(1.485±0.061)%相比,统计差异非常显著(t检验,p<0.001);吸收剂量高于5 kGy后,总生物碱含量有所下降。这可能因为,高能射线作用于溶剂三氯甲烷和体系中的水,产生Cl·、OH·和H·等自由基,与物质作用发生降解、聚合或氧化等反应。吸收剂量较小时以降解反应为主,自由基与植物细胞壁中的纤维素和半纤维素反应,使之解离,促进植物细胞中生物碱的溶出,因此总生物碱含量上升。吸收剂量增大后,以聚合反应为主,碱基间相互结合形成新的物质,同时自由基与溶出的生物碱反应形成醛、酮类物质的氧化作用也存在,从而总生物碱含量下降;辐射剂量进一步加大,聚合反应和氧化反应程度增加,生物碱含量则进一步降低[9-10]。该结果表明常温低剂量辐照,可促进落花生茎叶溶液中功能物质的溶出。

图1 超声波法与吸收剂量对生物碱提取效果的影响Fig.1 Effect of ultrasonic method and absorbed dose on total alkaloid yield(***, p<0.001)
2.2 大孔树脂种类对生物碱静态吸附率的影响
大孔吸附树脂是一种不含交换基团的高分子吸附剂,由于所选用的单体分子结构不同,大孔树脂的极性也不同[11-13]。在本研究中我们选择了极性、非极性、弱极性共6种大孔树脂进行实验,树脂的物理结构参数及其吸附结果见表1。由表1可知,NKA-9的静态吸附率较低,其它各种树脂的差别不大。静态吸附1 h,AB-8吸附后溶液在323 nm处静态吸附率最高,生物碱吸附效果最好;静态吸附48 h,波长323 nm处吸收峰消失,波长415 nm处,AB-8静态吸附后溶液的吸附率依然最高,效果最好。结果表明,AB-8适合于分离纯化生物碱类物质,故选择AB-8树脂为下一步层析用树脂。
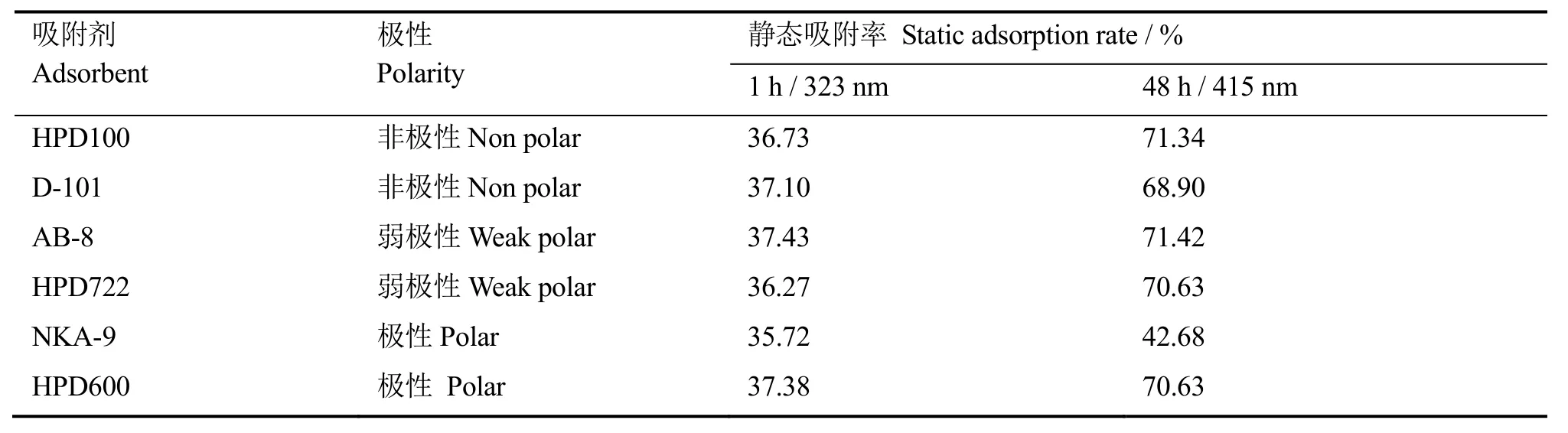
表1 不同大孔树脂对应的生物碱静态吸附率Table 1 Static adsorption rate of alkaloids by using different macroporous resin
2.3 不同洗脱液对生物碱紫外吸收峰的影响
根据图2(A)和图2(B)的结果,以甲醇和乙醇为洗脱液,最大吸收峰的波长集中在303−336 nm。60%甲醇或者70%乙醇为洗脱液时获得落花生茎叶总生物碱的吸光值较高,说明其洗脱效果较好,我们采用60%甲醇进行下一步提纯。此外从图2B可以看出,生物碱的吸收波长除了在303−336 nm外,在415 nm处也有吸收峰,虽然氯仿作为提取剂其吸收波长也为415 nm,但氯仿的毒性较大,所以在生物碱的洗脱纯化时不采用。
2.4 生物碱洗脱曲线及吸收峰
通过结晶法纯化生物碱,将含落花生茎叶生物碱的的甲醇溶液定量取出并减压蒸干后,残留物用0.5 mol·L−1的HCl溶解后,转至分液漏斗,用NaOH溶液调节pH至10.5,将溶液移入装有树脂的层析柱,然后洗脱。由图3结果可知,在15 min和30 min处分别有2个洗脱峰,表明含有两种生物碱或一种生物碱的两种异构体。60 min后的洗脱产物曲线峰值很小,即生物碱含量很少,所以忽略不计。根据图4结果,落花生茎叶生物碱的最大吸收峰分别集中在330 nm和304 nm处。

图4 落花生茎叶生物碱在不同洗脱时间段的吸收峰Fig.4 Absorption peaks of AHSL alkaloids eluted in different time periods
2.5 落花生茎叶中生物碱的HPLC检测结果
生物碱种类庞多,但鲜有关于落花生茎叶生物碱的研究报道,因此课题组在实验初期选择了盐酸小檗碱、花生碱、甜菜碱及胆碱进行高效液相色谱比对分析。结果显示,纯化后的样品中盐酸小檗碱、花生碱、甜菜碱等成分的含量甚微,但含有胆碱。图5为胆碱标品、落花生茎叶生物碱HPLC色谱图及胆碱纯度视图。
由图5A,胆碱标品在色谱上呈现两个峰,可能为胆碱的异构体。出峰保留时间为2.152 min和2.987 min。由图5B,落花生茎叶生物碱出峰保留时间为2.095 min和2.980 min,与图3中两个洗脱峰的结果相符;且与胆碱标品HPLC色谱峰峰形及保留时间一致(允许变化5%),可判定为胆碱类物质。
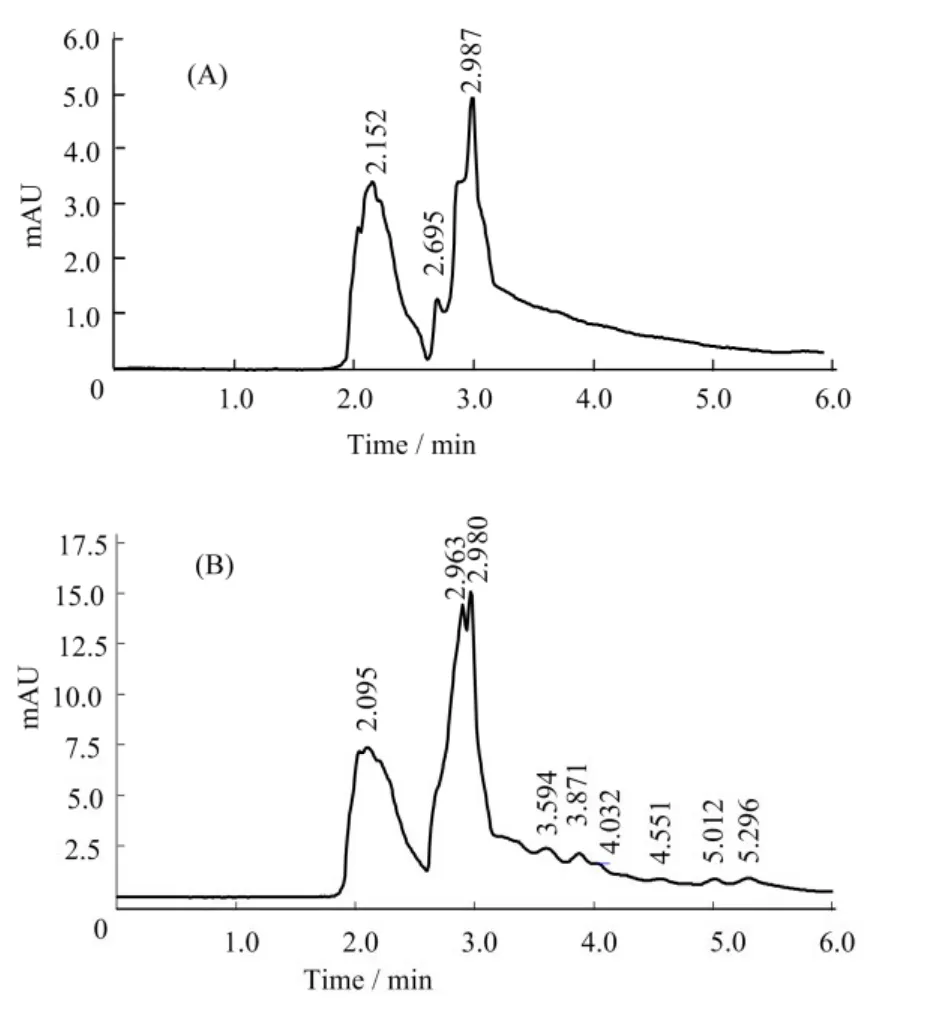
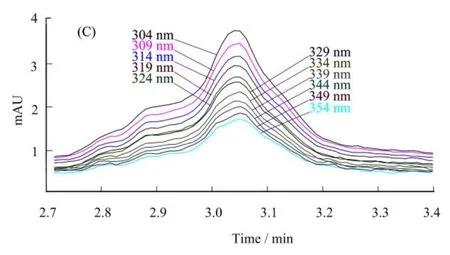
图5 胆碱标品(A)、落花生茎叶生物碱(B)HPLC色谱图及胆碱纯度视图(C)Fig.5 Choline standard (A), Arachis hypogaea L.stem and leaf alkaloids (B) and HPLC chromatogram purity view (C)
根据胆碱标准曲线y=6923.5x+17059,R2=0.9995(线性范围:0.75−24 mg·mL−1)可知,通过结晶法和大孔树脂法纯化的落花生茎叶胆碱的纯度可达99.99%,得率约为2.61 g·kg−1花生茎叶。由图5C可知胆碱在波长304 nm处,峰纯度最高,样品检测波长进一步确定。
3 结论
60Co γ-射线辐照法比超声波法提取的落花生茎叶生物碱含量高,在吸收剂量为5 kGy时总生物碱含量可达(7.970±0.117)%。在生物碱纯化方面,大孔树脂AB-8的纯化效果较好,洗脱溶媒为60%甲醇时洗脱效果较好,通过结晶法和大孔树脂法纯化,可使生物碱纯度达99.99%以上。落花生茎叶生物碱中盐酸小檗碱、花生碱、甜菜碱等成分含量甚微,主要为胆碱,其含量约为2.61 g·kg−1花生茎叶。该方法提取制备纯化落花生茎叶生物碱效果好,工艺新颖高效,可用于工业化生产。
1 江苏新医学院.中药大辞典 [M].下册.上海: 上海科学技术出版社, 1977: 2327.Jiangsu new medical college.Chinese medicine dictionary[M].Part Ⅱ, Shanghai, Shanghai Science and Technology Publishing House, 1977: 2327.
2 ZU Xiaoyan, ZHANG Zhenya, XIONG Guangquan,et al.Sedative effects ofArachis hypogaeaL.stem and leaf extracts on sleep deprivation rats [J].Experimental and Therapeutic Medicine, 2013, 6: 601-605.
3 ZU Xiaoyan, XIONG Guangquan, GENG Shengrong,et al.Arachis hypogaeaL.stem and leaf extracts improve sleep behaviors of pentobarbital-treated rats [J].Biomedical Reports, 2014, 2: 399-391.
4 ZU Xiaoyan ZHANG Zhenya, LIU Jiqiang,et al.Sedative effects of peanut (Arachis hypogaeaL.) leaf aqueous extracts on brain ATP, AMP, Adenosine and Glutamate/GABA of rats [J].Journal of Biomedical Science and Engineering, 2010, 3: 268-273.
5 尹永芹, 沈志滨.中药化学成分提取分离方法的研究进展 [J].中国药业, 2012, 21(2): 19-21.YIN Yongqin, SHEN Zhibin.Research on chemical composition of traditional chinese medicine Extraction methods [J].China Pharmaceuticals, 2012, 21(2): 19-21.
6 杨杰, 王丽莉, 张铁军, 等.落花生茎叶化学成分及药理作用研究进展 [J].安徽农业科学, 2013, 41(26):10563-10566, 10608.YANG Jie, WANG Lili, ZHANG Tiejun,et al.Research progress of chemical constituents and pharmacological action of groundnut stems and leaves [J].Journal of Anhui Agricultural Sciences, 2013, 41(26): 10563-10566, 10608.
7 吴军, 潘俊, 邵明玉, 等.一种采用辐照技术提高香辛料中总黄酮提取率的方法 [P].中国.CN101961357A,2011-02-02.WU Jun, PAN Jun, SHAO Mingyu,et al.A method using irradiation technology to improve the extraction rate of total flavonoids in spices [P].China.CN101961357A,2011-02-02.
8 肖文军, 盛达成, 龚志华, 等.一种采用辐照预处理辅助提制五倍子单宁酸的方法 [P].中国.CN103275136A, 2013-09-04.XIAO Wenjun, SHENG Dacheng, GONG Zhihua,et al.A irradiation assisted method to extract tannic acid from gallnut [P].China.CN103275136A, 2013-09-04.
9 施培新.食品辐照加工原理与技术 [M].北京: 中国农业科学技术出版社, 2004: 356-358.SHI Peixin.Food irradiation processing principles and technology [M].Beijing: Chinese Agricutual Science and Technology Press, 2004: 356-358.
10 汪勋清, 哈益明, 高美须.食品辐照加工技术 [M].北京: 化学工业出版社, 2005 WANG Xunqing, HA Yiming, GAO Meixu.Food Irradiation Processing Technology [M].Beijing:Chemical Industry Press, 2005.
11 王振宇, 田福.大孔树脂吸附纯化蓝靛果红色素的研究 [J].食品研究与开发,2008, 29(8): 184-188.WANG Zhenyu, TIAN Fu.Study on the adsorption and separating of the red pigment from Lonicera edulis tuacz with macroporous resin [J].Food Research and Development, 2008, 29(8): 184-188.
12 高虹, 张洁, 黎碧娜, 等.大孔吸附树脂分离紫荆花红色素 [J].华西药学杂志, 2005, 20(4): 302-305.GAO Hong, ZHANG Jie, LI Bina,et al.Separating the pigment from the flower of Bauhinia aureal lelv.by macroporous resin [J].West China Journal of Pharmaceutical Sciences, 2005, 20(4): 302-305.
13 王瑞芳, 欧来良, 孔德领, 等.大孔吸附树脂对喜树果中喜树碱和喜果苷的分离纯化研究 [J].中草药, 2005,36(6): 849-851.WANG Ruifang, OU Lailiang, KONG Deling,et al.Isolation and purification of camptothecine and vincoside-lactam fromCamptotheca acuminatafruit by macroporous adsorption resins [J].Chinese Traditional and Herbal Drugs, 2005, 36(6): 849-851.
