分根装置中丛枝菌根真菌影响蚕豆秸秆降解作用研究
2014-03-26郭涛石孝均朱敏罗珍
郭涛,石孝均,朱敏,罗珍
(1.西南大学资源环境学院,重庆400716;2.国家紫色土肥力与肥料效益监测基地,重庆400716)
植物凋落物是生态系统中养分的基本载体,是连接植物与土壤养分循环的“纽带”,也是陆地生态系统物质循环和能量转换的主要途径,对生态系统生产力至关重要[1]。凋落物的降解过程是生态系统的养分循环中重要的一环,对整个生态系统的生物群落构建具有重要的作用[2]。植物凋落物的降解过程包括一系列的生物、物理、化学的作用及它们之间协同作用,既受植物本身物质组成的影响,还受人为活动及环境等因素的影响,其过程十分复杂,但本质上是一个微生物驱动的过程[3]。因此,微生物既是土壤的重要组成部分,又是参与凋落物降解的最活跃的生物因素。
在许多陆地生态系统中,丛枝菌根(arbuscular mycorrhizal,AM)真菌是重要的一类微生物,能与80%以上的陆生植物形成共生体,在各类植物共生微生物中,丛枝菌根真菌是唯一直接联系土壤和植物根系的一类,丛枝菌根共生体在生态系统中可以提高植物对土壤矿质营养元素的吸收和累积、促进植物的抗旱、抗涝、抗盐、抗病、耐受重金属胁迫等方面的作用已经得到普遍认同[4-5],近年来,丛枝菌根共生体在养分循环和陆地生态过程中的作用受到越来越多的关注,研究AM真菌影响植物凋落物的降解成为研究的主要切入点[6]。虽然真菌通常被认为是有机物最主要的分解者,但关于AM真菌降解植物残体的研究很少,主要缘于以往的研究普遍认为AM真菌专性活体共生,依靠宿主植物提供碳源,不具腐生性,在Hodge等[7]的里程碑式研究中发现Glomushoi的根外菌丝能利用复杂的有机质中的氮,以13C和15N双标记的研磨后的黑麦草叶作为氮源,并没有发现13C随15N一起转移,说明了AM真菌促进丛枝菌根菌丝具有促进凋落物降解的能力,拓展了AM真菌在生态系统物质循环中的作用。
然而丛枝菌根真菌(AMF)如何参与凋落物降解过程的尚不清楚,由于AMF不能像外生菌根真菌和欧石楠科菌根真菌一样直接分泌胞外酶[8],菌丝单独存在时并不能矿化有机质[9],因此丛枝菌根真菌可能通过增加促进微生物活性或改变微生物群落来促进有机质的降解。AM真菌侵染宿主建立共生体系后,一方面菌根菌丝能释放出多种酶和分泌物,分布于土壤中;另一方面,AM真菌可能增加促进微生物活性或改变微生物群落,形成明显有别于根际的微生物区系[10]。土壤微生物和酶可能直接或间接的参与到植物残体的降解过程,据此推测,在植物残体降解过程中,AM真菌可直接导致土壤微环境的优化。
目前为止,国内外关于AM真菌对植物残体降解的影响研究还不深入,因此,研究过程中采用了四室分根装置,将植物的根系、菌根以及根外菌丝隔开,通过分别比较其对蚕豆(Viciafaba)秸秆降解的影响,以及土壤中微生物和酶活性的变化动态,旨在植物生长状况相同的前提下,对植物根系、菌根和菌丝及根外菌丝降解蚕豆秸秆的作用进行量化比较。深入理解AM真菌在促进植物凋落物降解中的作用。研究AM真菌对植物凋落物降解的影响,初步揭示AM真菌在植物残体降解过程中的作用,对理解AM真菌在生态系统的物质循环中有重要意义,也为进一步阐述其在生态系统中的作用提供理论依据。
1 材料与方法
1.1 试验材料
试验在西南大学资源环境学院植物营养实验室进行。供试土壤为中性紫色土,其基本理化性状为:pH 6.9、有机质21.5g/kg、全氮0.6g/kg、全磷1.0g/kg、全钾15.4g/kg、碱解氮84.2mg/kg、有效磷27.6mg/kg、速效钾73.0mg/kg。土壤经湿热灭菌处理,风干后备用。
供试植物:玉米(Zeamays)“精科糯2000”,种子以10%浓度的H2O2表面消毒10min,去离子水浸泡5h,于25℃暗室催芽30h后,在盛有石英砂的培养盆中育苗,随时补充水分和养分,待根系长出8~10cm时进行分根。
供试AM真菌菌种:Glomusmosseae(G.m),来自中国农业大学资源环境学院,经三叶草(Trifoliumrepens)、玉米盆栽繁殖,接种剂含有AM真菌孢子、根外菌丝和侵染的根段,每克菌剂含有20~30个孢子。
蚕豆秸秆尼龙网袋制备:试验材料为蚕豆成熟后的地上部秸秆,用去离子水漂洗,于60℃下烘干至恒量,磨碎后过筛,使粒径为0.5~2mm。称取2.00g材料分别装入孔径为75μm,长9cm,宽5cm的尼龙网袋中。封口后称整个网袋重量,用万分之一天平精确到小数点后4位。其初始元素含量为:全碳457.3g/kg、全氮20.74 g/kg、碳氮比22.05。
1.2 试验设计
本试验所用装置参照彭思利等[11]的四室隔板分室系统,分别称之为菌根室(M)、菌丝室(H)、非根际土壤室(S)、根室(R)。此装置采用3mm厚的有机玻璃板加工而成,每个室的长×宽×高均为:5cm×10cm×15cm。M室和R室用长14cm,宽10cm,厚3mm的有机玻璃隔板隔开,而S室和R室以及H室和 M室则由37.4 μm(400目)的尼龙网隔开,菌丝和溶液能透过此尼龙网,而根系则不能。每盆土重共计3.6kg,每室盛土0.9 kg,试验进行时,先分别向4个分室中加0.20kg灭菌土壤,然后分别竖放置一个尼龙网袋,然后在M室加入与接种剂均匀混合的0.5kg土壤,接种量为10%,R室则加入等量灭菌的菌种与土壤混合,以保持土壤理化性质一致(不接种的对照处理)。将植物根系平均分为2份置于中间两室中,每盆定植2株玉米,上面再覆盖0.20kg灭菌土壤。S室与H室加入的土壤与R、M室相同。试验过程中采用称重法保持水分含量,使每室土壤含水量保持在田间持水量的60%~70%。试验共设置15个分室装置,每个处理5个重复。试验过程中土壤未施肥。试验于2012年3月至2012年6月在西南大学植物营养网室进行。
根据AM真菌侵染规律,将取样时间分别设定在移栽后第20、30、40、50、60天时,每处理收获3盆,根室与菌根室中根系分开收获,取洗净、混匀的鲜根1g用于侵染率的测定,取出的尼龙网袋于40℃烘干至恒重,用万分之一天平称重。土壤风干后待测。
1.3 测定项目及方法
每个尼龙网袋单独测定:降解量=B0-Bt。式中,B0为蚕豆秸秆初始重量,Bt为蚕豆秸秆剩余重量。网袋内剩余蚕豆秸秆的C含量测定方法为重铬酸钾-硫酸法,N含量测定方法为凯氏定氮法[12];C释放量与N释放量参照申艳等[13]的方法计算;应用Olson的指数模型Bt/B0=e-kt计算玉米秸秆的降解系数k值[14]。玉米根系的菌根侵染率采用方格交叉法测定[15]。土壤菌丝密度按照Abbott等[16]的方法进行。
土壤过氧化氢酶活性测定采用高锰酸钾滴定法,活性单位以30min后1g土壤消耗0.1mol/L KMnO4的毫升数表示(U);蛋白酶活性测定采用茚三酮比色法,活性单位以24h后1g土壤中氨基氮的毫克数表示(U)[17];酸性磷酸酶活性测定采用磷酸苯二钠比色法,活性单位以3h后100g土壤中酚的毫克数表示(U)[18];土壤呼吸强度测定采用碱吸收法;微生物量碳、氮测定采用氯仿熏蒸-K2SO4浸提法[19]。
1.4 数据处理
原始数据在Excel中进行标准化处理,应用SAS软件(Version 9.13;SAS Institute,Cary,NC)对试验数据进行方差分析,5%水平下LSD多重比较检验各处理平均值之间的差异显著性。
2 结果与分析
2.1 植物与菌根结构生长情况
从表1可以看出,接种G.m的M室形成了良好的菌根共生体,并且随着时间的延长,侵染率和菌丝密度不断增加,根系侵染率在60d时为78.85%,而不接种的R室均未形成菌根共生体。由于AM真菌根外菌丝可以通过M室和H室之间的尼龙网到达H室,在M室和H室均有大量的菌丝,60d时菌丝密度在76.27~102.63 cm/g之间,M室最高,R室和S室没有菌丝存在。M室和R室根系生物量除60d时差异均不显著(表2)。
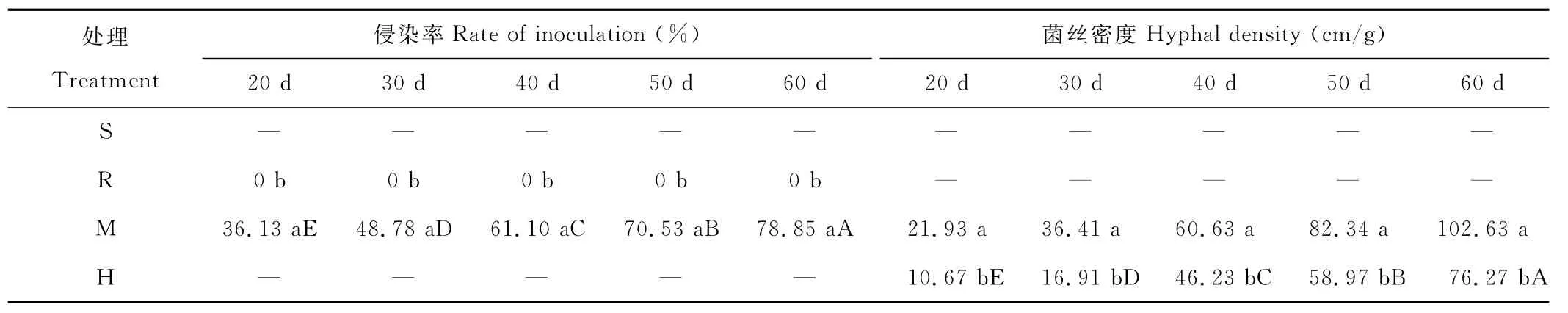
表1 分根装置中接种菌根真菌的宿主植物根系侵染率及菌丝密度Table 1 Inoculation rate and hyphal density of non-mycorrhizal and mycorrhizal host plants in the split-root device

表2 分根装置中接种菌根真菌的宿主植物地上部、根系干重Table 2 Shoot dry weight,root dry weight of non-mycorrhizal and mycorrhizal host plants in the split-root device g
2.2 接种AM真菌对蚕豆秸秆降解的影响
如表3所示,各室降解量随着培养时间的增加而增加。在相同取样时间,各室的蚕豆秸秆降解量有显著差异,且均表现为:M室>R室>H室>S室,即同一宿主植物条件下,与根系相比,前期菌根系土壤环境对蚕豆秸秆的降解有明显优势,而后期这一优势变缓;60d时,与S室相比,R室、M室和H室蚕豆秸秆降解量分别提高了15.61%,20.54%和7.74%。由此可见,接种G.m的M室不仅有提高蚕豆秸秆降解率的趋势,而且当一定数量的根外菌丝进入到H室后,也加快了蚕豆秸秆降解,但菌丝的作用仍不及根系。

表3 接种AM真菌对蚕豆秸秆降解量的影响Table 3 Effect of AM fungi inoculation on degradation mass of vicia faba straw g
降解系数是衡量分解速率的一个指标,降解系数越大其分解速度就越快。由图1可以看出,各室蚕豆秸秆的降解系数随时间的增加逐渐减小,即蚕豆秸秆的降解速度到后期越来越缓慢;且同一取样时期,各室降解系数均为:M室>R室>H室>S室;植物生长到60d时,R室、M室和H室的降解系数比S室分别高出25.87%、35.00%和12.17%。说明接种 AM 真菌能加快蚕豆秸秆的降解速度,并带动菌丝的作用,但根系的影响却不容忽视,这与表3中接种AM真菌处理增加蚕豆秸秆降解量结果相一致。
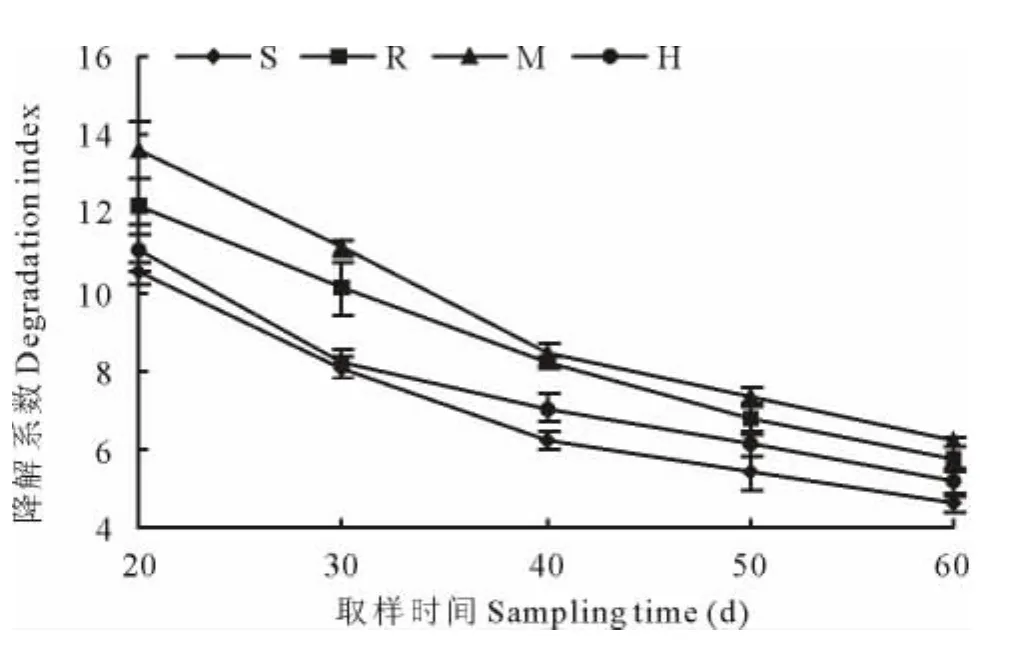
图1 接种AM真菌对蚕豆秸秆降解系数的影响Fig.1 Effect of AM fungi inoculation on degradation coefficient of vicia faba straw
2.3 接种AM真菌对蚕豆秸秆C、N释放量及C/N的影响
如表4所示,各室蚕豆秸秆中碳素随时间延长表现为净释放特性,即C释放量不断增加;60d时,R室、M室和 H室较S室相比,C释放量增加了16.06%、21.09%、8.35%,以 M 室为最高;对于 C释放量,同一取样时期四室均表现出相同的趋势:M室>R室>H室>S室。在整个培养过程中,氮素释放规律也表现为随时间逐渐增加。60d时,R室、M室和H室较S室相比,N释放量提高了6.17%、7.46%、1.10%,以 M 室为最高。由此可见,接种AM真菌对蚕豆秸秆中碳、氮释放均有促进作用。
蚕豆秸秆中碳素与氮素释放量的不同必然引起C/N的变化。图2反映了蚕豆秸秆降解过程中C/N的变化动态。可以看出,整个降解过程中,除S室外,包埋与其他分室中的蚕豆秸秆C/N与初始值相比,都显著下降,尤以M室下降最多。
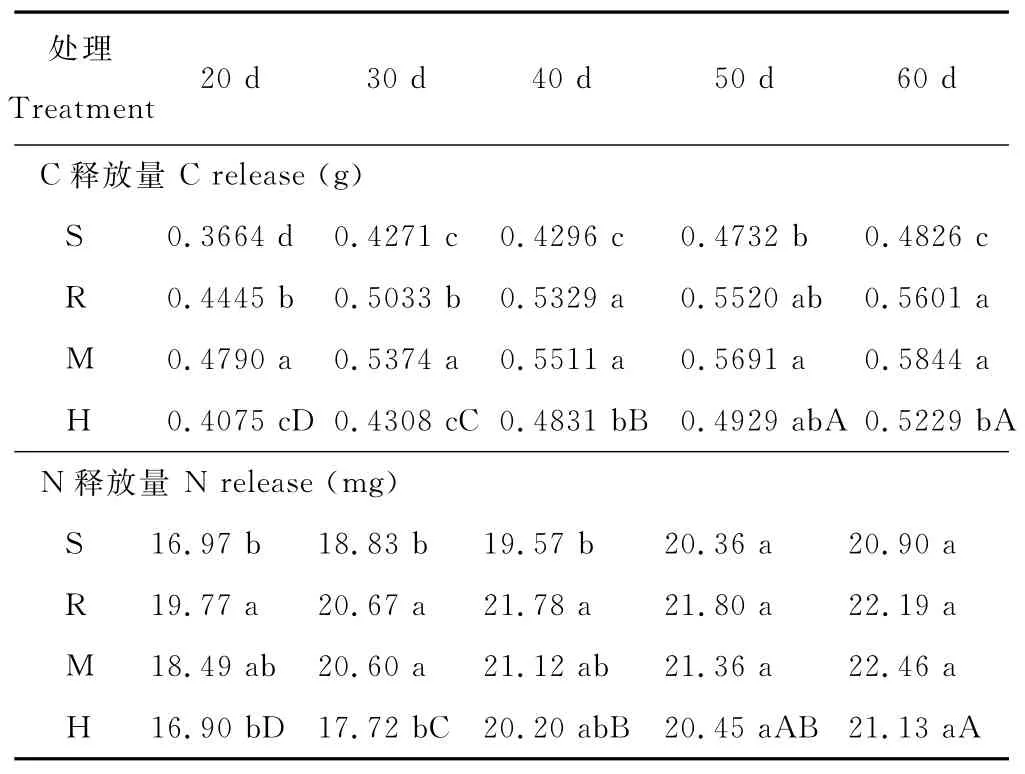
表4 接种AM真菌对蚕豆秸秆C、N释放量的影响Table 4 Effect of AM fungi inoculation on C release and N release of vicia faba straw
2.4 接种AM真菌对土壤中酶活性的影响
图3分别为土壤中酸性磷酸酶、蛋白酶和过氧化氢酶的活性。结果显示,AM真菌菌丝能通过与细菌的协同作用来提高磷酸酶活性,促进有机磷化合物的水解,以活化植物通常不能直接利用的有机磷源。整个过程中各处理的酸性磷酸酶活性均表现为先升高后下降的趋势,以40d时M室为最高;在相同取样时期,四室中M室始终显著高于其他三室,且H室高于S室。
蛋白酶是水解酶类的一种,它参与土壤中氨基酸、蛋白质及含氮有机化合物的酶解,可将蛋白质水解为肽,最终形成氨基酸为植物提供氮源。如图3所示,蛋白酶活性总体表现为波浪式变化,且在30d时均有一定程度下降;但在相同取样时期,四室均表现为相同的趋势,M室>R室>H室>S室。
过氧化氢酶能解除由生物呼吸和生物化学反应而产生的过氧化氢的毒害,参与土壤中物质和能量转化,其活性表示土壤腐质化强度大小和有机质积累程度。图3可以看出,对于过氧化氢酶活性,在相同取样时期四室均表现为相同的趋势,M室>R室>H室>S室。
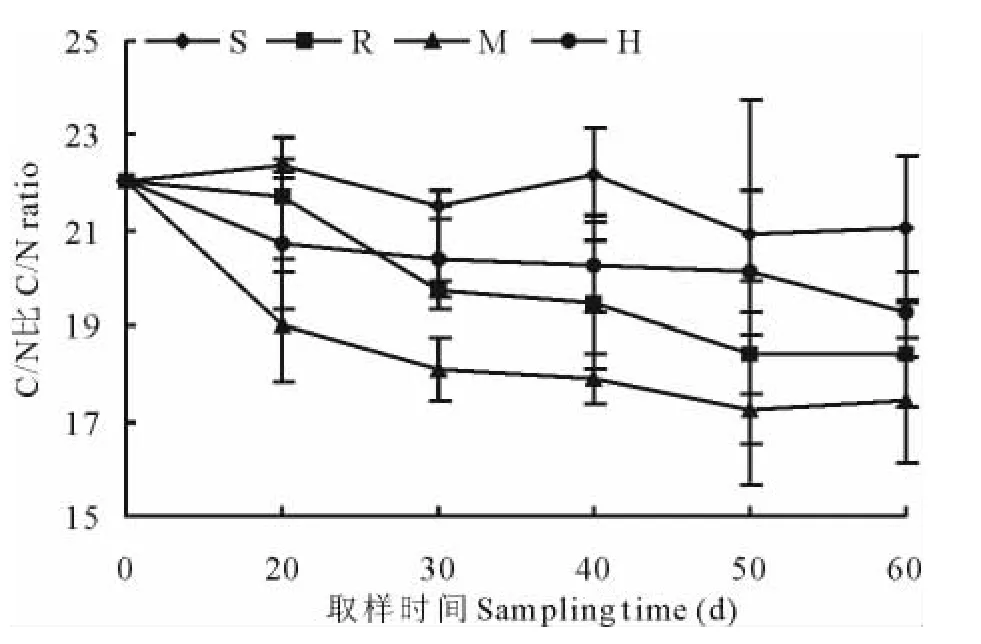
图2 接种AM真菌对蚕豆秸秆C/N的影响Fig.2 Effect of AM fungi inoculation on C/N ratio of vicia faba straw
2.5 接种AM真菌蚕豆秸秆降解过程中土壤微生物量碳、氮的动态变化
表5数据可以看出,接种与否对土壤微生物量碳、氮产生很大影响。整个培养过程中,同一时期四室的微生物量碳均表现为M室最高,60d时比S室、R室和 H室分别高出109.70%、59.75%和59.19%。微生物量氮也是如此,60d时接种G.m的M室最高,比S室、R室和 H 室分别高出64.02%、23.38%和29.44%。
2.6 接种AM真菌蚕豆秸秆降解过程中土壤呼吸与呼吸熵的动态变化
土壤呼吸(soil respiration)是评价土壤基质中碳稳定性的重要指标,同时也反映了土壤微生物的活性。表6数据表明,同一取样时间下,接种G.m的菌根室土壤呼吸均高于相应不接种的根室。因此可以认为,接种AM真菌相对提高了土壤中的微生物活性。对土壤呼吸熵(respiration quotient,qCO2)而言,接种G.m的菌根室有所下降,均低于相应不接种的根室。
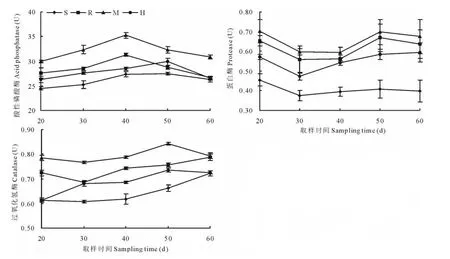
图3 分根装置中接种AM真菌对土壤酶活性的影响Fig.3 Effect of AM fungi inoculation on soil enzymatic activity in the split-root device

表5 分根装置中接种AM真菌对土壤微生物量碳、氮的影响Table 5 Effect of AM fungi inoculation on soil microbial biomass carbon and nitrogen in the split-root device mg/kg
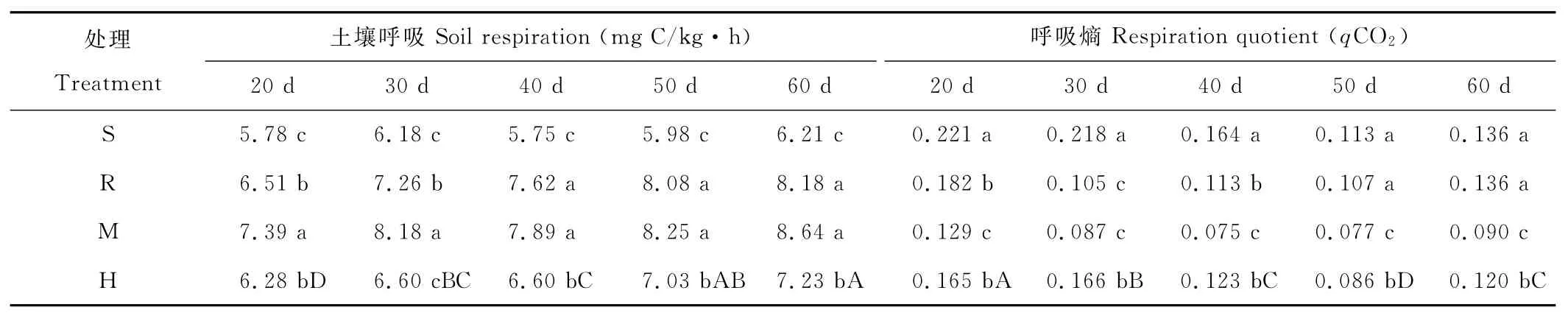
表6 分根装置中接种AM真菌对土壤呼吸及呼吸熵的影响Table 6 Effect of AM fungi inoculation on soil respiration and qCO2in the split-root device
3 讨论
本试验采用四室分根装置,在同一宿主植物的前提下,通过比较非根际土壤室(S)、根际土壤室(R)、菌根际土壤室(M)和菌丝际土壤室(H)中土壤酶活性、微生物量碳、氮以及土壤呼吸的变化动态,分析了其对蚕豆秸秆降解的影响。
结果表明,接种G.m的M室与S室、R室和H室相比,显著促进了蚕豆秸秆的降解,已有的研究也发现AM真菌侵染形成共生体系后,会引起植物残体降解速率发生变化[20-22]。在本试验为期60d的试验过程中,根室的降解作用均高于只有菌丝的H室,但显著低于M室,在一定程度上说明根系在植物残体降解过程中的作用超过了单独的菌丝作用,但还是小于菌丝和根系共同的作用(表3)。
由于AM真菌不能像外生菌根真菌和欧石楠科菌根真菌一样直接分泌胞外酶[8],菌丝单独存在时并不能矿化植物的凋落物[9],因此丛枝菌根真菌可能通过增加参与有机质降解过程中的各种土壤的酶活性来促进有机质的降解[6,23-25]。本研究数据表明,接种AMF后,显著提高了M室中土壤中酸性磷酸酶、蛋白酶和过氧化氢酶活性,且H室的酶活性相对于S室也有显著提高,这些酶可能参与蚕豆秸秆的降解过程,进而影响了秸秆的降解。作为土壤中生化反应的调控者,土壤酶在土壤氮素循环和有机质的形成扮演着重要角色[26],影响土壤中的各种代谢过程和能量转化,并能参与土壤中有机物质的分解和转化,这是AM真菌加快植物残体降解的原因。另外,AM真菌还促使某些腐生微生物在植物残体附近快速繁殖[27],并缓慢释放易利用的有机碳辅助其生长[28]。因此接种AM真菌会引起土壤微生物量、区系组成以及代谢过程发生变化[29],主要表现为M室微生物量碳、氮和土壤呼吸相对于其他三室均有增加(表6),且H室相比S室,微生物量的大小和活性均有提高,利于土壤微生物质量的稳定与提高[30],可能成为蚕豆秸秆降解加快的重要驱动力。
菌根室土壤呼吸(表6)相对于根室均明显增加。土壤呼吸熵,又称微生物代谢熵(qCO2),能够反映土壤微生物种群利用土壤有机成分的效率,还可以同时表示微生物量的大小和活性[31]。qCO2值越低表明微生物碳利用效率就越高[32]。这些数据证实菌根室中的微生物量大小和活性相对根室均有提高,进而对蚕豆秸秆的降解产生影响。
植物凋落物的C/N是影响秸秆降解的重要因素[33],一般认为,较低的C/N有利于凋落物中矿质态养分的释放[34]。结果显示,包埋于M室的蚕豆秸秆降解速率最快,同时C/N与初始值相比,显著下降,说明了随着降解的进行,接种AM真菌的M室显著降低了玉米秸秆C/N,使其更易于降解。原因可能有两个,一是秸秆中碳素与氮素不同程度释放,进而影响了秸秆C/N的变化;二是在分室装置的M室中分布着大量的菌丝,而菌丝的氮含量可高达5%[21],加之AM真菌具有在有机质斑块中富集生长的特性[35],造成包埋于M室中的蚕豆秸秆氮总量的增加,从而降低了C/N。
本研究结果表明接种丛枝菌根真菌能够显著加快蚕豆秸秆降解,源于AM真菌和宿主植物形成共生体系后,通过提高土壤酶活性、增加微生物量的大小和活性作用于蚕豆秸秆的降解过程,成为导致蚕豆秸秆降解加快的重要原因,同时菌丝的大量生长造成局部C/N的下降从而有利于蚕豆秸秆的进一步降解也是一个重要的因素;在进一步的研究过程中,将重点研究菌根际或者菌丝际参加植物凋落物降解的微生物功能群落的变化[25],以进一步阐明丛枝菌根影响凋落物降解的作用机制及其在生态系统碳氮循环中的作用。
[1] Lecerf A,Marie G,Kominoski J S,etal.Incubation time,functional litter diversity,and habitat characteristics predict littermixing effects on decomposition[J].Ecology,2011,92(1):160-169.
[2] 赵哈林,刘任涛,周瑞莲,等.沙漠化对科尔沁沙质草地大型土壤动物群落的影响及其成因分析[J].草业学报,2013,22(3):70-77.
[3] Berg B,McClaugherty C.Plant Litter:Decomposition,Humus Formation,Carbon Sequestration(2nd Edition)[M].Springer:Verlag Berlin Heidelberg,2008.
[4] 林双双,孙向伟,王晓娟,等.我国菌根学研究进展及其应用展望[J].草业学报,2013,22(5):310-325.
[5] 叶少萍,曾秀华,辛国荣,等.不同磷水平下丛枝菌根真菌(AMF)对狗牙根生长与再生的影响[J].草业学报,2013,22(1):46-52.
[6] Talbot J M,Allison S D,Treseder K K.Decomposers in disguise:mycorrhizal fungi as regulators of soil C dynamics in ecosystems under global change[J].Functional Ecology,2008,22:955-963.
[7] Hodge A,Campbell C,Fitter A H.An arbuscular mycorrhizal fungus accelerates decomposition and acquisition nitrogen directly from organic material[J].Nature,2001,413:297-299.
[8] Smith S E,Read D J.Mycorrhizal Symbiosis(3rd ed.)[M].London:Academic Press,2008.
[9] Andrew T N,Benjamin L T,Klaus W,etal.Root and arbuscular mycorrhizal mycelial interactions with soil microorganisms in lowland tropical forest[J].FEMS Microbiol Ecology,2013,85(1):37-50.
[10] Lerat S,Lapointe L,Gutjahr S,etal.Carbon portioning in a split-root system of arbuscular mycorrhizal plants is fungal and plant species dependent[J].New Phytologist,2003,157(3):589-595.
[11] 彭思利,申鸿,张宇亭,等.不同丛枝菌根真菌侵染对土壤结构的影响[J].生态学报,2012,32(3):863-870.
[12] 鲍士旦.土壤农化分析(第3版)[M].北京:中国农业出版社,2000:76-79.
[13] 申艳,杨慧玲,何维明.冬小麦生境中土壤养分对凋落物碳氮释放的影响[J].植物生态学报,2010,34(5):498-504.
[14] Olson J A.Energy storage and the balance of producers and decomposers in ecological systems[J].Ecology,1963,44(2):322-332.
[15] Giovannett M,Mosse B.An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in root[J].New Phytologist,1980,84:489-500.
[16] Abbott L K,Robson A D,Deboer G.The effect of phosphorus on the formation of hyphae in soil by the vesicular arbuscular mycorrhizal fungus,Glomusfasciculatum[J].New Phytologist,1984,97:437-446.
[17] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:260-353.
[18] 哈兹耶夫.土壤酶活性[M].郑洪元,周礼恺,译.北京:科学出版社,1980:24-75.
[19] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999:231-233.
[20] Leigh J,Hodge A,Fitter A H.Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material[J].New Phytologist,2009,181:199-207.
[21] Hodge A,Fitter A H.Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling[J].Proceedings of the National Academy of Sciences,2010,107(31):13754-13759.
[22] 罗珍,王晓峰,朱敏,等.接种丛枝菌根真菌对玉米秸秆降解的影响[J].水土保持学报,2012,26(4):267-270.
[23] Cheng L,Booker F L,Tu C,etal.Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2[J].Science,2012,337:1084-1087.
[24] Tu C,Booker F L,Watson D M,etal.Mycorrhizal mediation of plant N acquisition and residue decomposition:impact of mineral N inputs[J].Global Change Biology,2006,12:793-803.
[25] Singh B K,Nunan N,Ridgway K P,etal.Relationship between assemblages of mycorrhizal fungi and bacteria on grass roots[J].Environmental Microbiology,2008,10:534-541.
[26] Yao X H,Hang M,LüZ H,etal.Influence of acetamiprid on soil enzymatic activities and respiration[J].European Journal of Soil Biology,2006,42:120-126.
[27] Bonfante P,Anca I A.Plants,mycorrhizal fungi,and bacteria:A network of interactions[J].Annual Review of Microbiolo-gy,2009,63:363-383.
[28] Barbara D,Agata S P,Henk D,etal.Shifting carbon flow from roots into associated microbial communities in response to elevated atmospheric CO2[J].Proceedings of the National Academy of Sciences,2010,107(24):10938-10942.
[29] Bomberg M,Jurgens G,Saano A,etal.Nested PCR detection of Archaea in defined compartments of pine mycorrhizospheres developed in boreal forest humus microcosms[J].FEMS Microbiology Ecologist,2003,43(2):163-171.
[30] 于淼,毕银丽,张翠青.菌根与根瘤菌联合应用对复垦矿区根际土壤环境的改良后效[J].农业工程学报,2013,29(8):242-248.
[31] Anderson T H,Domsch K H.Application of eco-physiological quotients(qCO2andqD)on microbial biomasses from soils of different cropping histories[J].Soil Biology and Biochemistry,1990,22:251-255.
[32] Dilly O,Munch J C.Microbial biomass content,basal respiration and enzyme activities during the course of decomposition of leaf litter in a Black Alder(Alnusglutinosa(L.)Gaertn.)forest[J].Soil Biology and Biochemistry,1996,28(8):1073-1081.
[33] Melin E.Biological decomposition of some types of litter from North American forests[J].Ecology,1930,11:72-101.
[34] 査同刚,张志强,孙阁,等.凋落物分解主场效应及其土壤生物驱动[J].生态学报,2012,32(24):7991-8000.
[35] Hodge A,Robinson D,Fitter A H.An arbuscular mycorrhizal inoculum enhances root proliferation in,but not nitrogen capture from,nutrient-rich patches in soil[J].New Phytologist,2000,145:575-584.
