高寒生态脆弱区“黑土滩”草地植被与土壤微生物数量特征研究
2014-03-26卢虎李显刚姚拓蒲小鹏
卢虎,李显刚,姚拓*,蒲小鹏
(1.甘肃农业大学草业学院 中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.贵州省黔南州饲草饲料工作站,贵州 黔南558000)
黑土滩是指严重退化的高寒草甸,是当地群众对这一特殊景观的俗称。在青藏高原独特及严酷的自然条件下,高寒草甸退化后经风蚀和水蚀形成的大面积裸地产物,即黑土滩[1-2]。这一特殊、恶化了的高寒草甸给当地牧民和草食家畜及其他生物的生存带来了直接威胁,严重阻碍着当地草地畜牧业的持续发展[1-4]。近年来,许多学者及草地工作者对黑土滩进行了大量的研究,且主要集中于黑土滩这种生态环境改变产生的标示性现象及其恢复建植的相关研究[1-7]。如李希来[8]对高原黑土滩形成的自然因素与生物学机制进行了研究,认为人为过度放牧是导致秃斑地形成的主导因素;害鼠破坏、风蚀、水蚀和冻融剥离等自然因素加速了黑土滩的形成[1]。程晓月等[5]研究认为,毒杂草的化感抑制作用是影响利用垂穗披碱草(Elymusnutans)改建黑土滩的重要因素。李世雄等[6]研究表明,“黑土滩”草地土壤种子库在植被返青前、种子成熟前和枯黄期均有种子萌发,种子萌发数量为返青前>枯黄期>种子成熟期前。马玉寿等[2]对黄河源区“黑土滩”退化草地群落类型多样性及其群落结构进行了研究,表明黄河源区7个类型的“黑土滩”草地都完全失去了牧用价值,短期内自然恢复的物质基础也已丧失,该类草地的恢复治理必须通过人工植被的重建来实现。王彦龙等[7]对黄河源区“黑土滩”混播草地牧草植物量及营养动态研究表明,对于黄河源区的极度退化草地黑土滩,改建成人工草地是一种重要的恢复途径。李希来[8]通过研究,选定种类不多的禾本科牧草作为先锋植物以定居黑土滩。在土壤理化性质的调查研究中,陈生云等[9]对疏勒河上游地区植被物种多样性和环境因子的关系进行了研究,认为土壤改良仍然在大面积区域很难实现。
土壤微生物在生物地球化学循环中起着重要的作用,也是判断土壤生物活性的重要指标。土壤三大类微生物(细菌、真菌和放线菌)运用自身酶系统直接参与植物凋落物及有机残体的物质分解和循环过程,是衡量土壤肥力的重要指标之一[10]。土壤微生物氮素生理群整体运行参与土壤氮素循环中,作为一类功能群体生物是微量元素与能量转换的主要“催化剂”,与植物营养具有密不可分的联系,其中氨化细菌、硝化细菌、固氮细菌和反硝化细菌在土壤氮素转化中发挥着重要作用,土壤中微生物氮素生理群的存在与活动对于土壤肥力以及植物营养具有重要意义[11]。在草地生态系统的“植被-土壤”亚系统中,土壤微生物起着相当重要的作用,虽然众多学者在“黑土滩”草地的治理与植被恢复、重建中做了大量研究,但是对于“黑土滩”草地土壤微生物及其变化的研究目前报道极少。为此,本研究以甘肃天祝高寒“黑土滩”草地为对象,研究“黑土滩”草地不同土壤空间层次及季节,草地土壤三大类微生物及氮素生理群的数量变化特征及其与植被的关系,为从微观视野探索“黑土滩”草地退化机制及土壤改良和植被恢复提供理论依据和科技支撑。
1 材料与方法
1.1 研究地自然概况
研究地位于甘肃省天祝县金强河(甘肃农业大学高山草原试验站),37°11′~37°13′N,102°29′~102°33′E,海拔2700~3300m(本研究采样地2970~2990m),气候寒冷潮湿,年均温-0.1℃,1月均温-18.3℃,7月均温12.7℃,>0℃年积温1380℃,水热同期,年日照时数2600h;年降水量416mm,多为地形雨,集中于7-9三个月,年蒸发量1592mm。无绝对无霜期,仅分冷、热2季,春季常有旱象,并有暴风雪。土层厚约40~80cm。土壤pH值7.0~8.2,有机质含量10%~16%。土壤以亚高山草甸土、亚高山黑钙土等为主。植被以嵩草(Kobresiabellardii)、苔草(Carexspp.)、针茅(Stipacapillata)、莎草(Cyperusspp.)、珠芽蓼(Polygonumviviparum)、金露梅(Potentillafruticosa)、棘豆(Oxytropisspp.)、狼毒(Stellerachamaejasme)、委陵菜(Potentilla chinensis)、杜鹃(Rhododendronspp.)等为主。
1.2 样地选择及地上植物量测定
在研究地的典型“黑土滩”草地设置样地10hm2,随机选取5处裸露土壤呈黑色的大面积次生裸地,在确定取样点后,每1个样点取3个样方,每一样方面积为1m×1m。记录样方内的植物种类,同时将样方内所有植物齐地面刈割,除去粘附在植物上的土壤、砾石等杂质后带回实验室,在65℃恒温箱内烘干至恒重,计算样方地上生物量[12-16]。
1.3 土壤样品采集
分别于2011年4,6,8和10月,在1.2的刈割了地上植物的样方内,除地面的枯枝落叶及砾石等杂质,按0~20cm和20~40cm两个层面分别采集土壤样品,并将各点相同层次土样混合,按四分法除去多余土样,留1kg左右装入无菌聚乙烯袋密封,土壤带回实验室后立即进行各类微生物分离(4℃保存不超过24h)、计数[17]及土壤氮素测定。
1.4 土壤三大类微生物数量测定
1)真菌数量测定。采用马丁-孟加拉红培养基,以平板涂抹法计数[17]。即称取土壤样品10g,在无菌条件下用无菌水配成不同浓度梯度悬浮液,取稀释度为10-1,10-2的土壤悬浮液各50μL,接种于盛有灭菌的马丁-孟加拉红培养基的培养皿中,用无菌刮刀涂抹均匀。每个浓度3个重复,恒温(25℃)培养5~7d,选取每皿菌落数为15~150的1个稀释度统计菌落数,按下列公式计算真菌数量[10]。
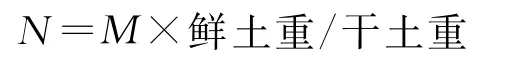
其中:M=a×u/v,N为每1g干土的菌数;M为每1g鲜土的菌数;v为每个培养皿中加悬浮液体积(本研究为50μL);a为培养皿中平均菌落数;u为稀释倍数。
2)细菌数量测定。采用牛肉膏蛋白胨琼脂培养基[17],以平板涂抹法计数。取稀释度为10-3,10-4,恒温(28℃)培养3d以外,测定方法同上。按上述方法和公式统计菌落数并计算细菌数量。
3)放线菌数量测定。采用改良高氏一号培养基[16],以平板涂抹法计数。取稀释度为10-3,10-4恒温(28℃)培养7~10d,测定方法同上。按上述方法和公式统计菌落数并计算放线菌数量。
1.5 土壤微生物氮素生理群及数量测定
1)氨化细菌数量测定。采用蛋白胨氨化培养基[18],以平板涂抹法计数。取稀释度为10-3,10-4,恒温(28℃)培养3d以外,测定方法同1.4。按上述方法和公式统计菌落数并计算氨化细菌数量。
2)硝化细菌数量测定。采用改良的斯蒂芬逊(Stephenson)培养基,以稀释法测定[16]。将15mL培养基分装于试管中(深层造成嫌气条件)。高压蒸汽灭菌25min。将稀释度为10-4,10-5,10-6,10-7,10-8的土壤悬液1mL接入试管,每稀释度重复3次。另取3支试管接种1mL无菌水作对照,于28~30℃培养14d后检查是否有菌生长,如有细菌生长,一般有气泡出现,培养液变浊。同时用格里斯试剂做显色反应(如有亚硝酸存在,则呈红色),根据测得数量指标结果,按下列公式计算每g干土中的菌数。

3)反硝化细菌数量测定。采用组合培养基[17],以稀释法测定。取稀释度为10-4,10-5,10-6,10-7,10-8,于28~30℃培养14d后使用奈氏试剂检查是否有氨气产生,根据测得数量指标结果,按1.5的公式计算每g干土中的菌数。
4)好气性固氮菌。采用阿须贝(Ashby)培养基[17],平板涂抹法计数。取稀释度为10-2,10-3,恒温(28℃)培养7d后,统计菌落数,按1.4的公式计算每g干土中的菌数。
5)嫌气性固氮菌。采用玉米面培养基[17],以稀释法测定。取稀释度10-4,10-5,10-6,10-7,10-8,于28~30℃培养7d后,观察气泡及丁酸的形成外,还需观察菌盖的形状和培养基的变清。在确定了嫌气性自生固氮菌的发育后,按1.5的公式计算每g干土中的菌数。
1.6 土壤全氮测定
土壤全氮按常规法测定[19]。所有数据使用Excel 2007和SPSS 17.0处理,并通过Pearson相关性分析计算各数据间的相关性。
2 结果与分析
2.1 黑土滩植被状况及地上植物量
天祝高寒地区“黑土滩”草地的植被状况测定结果表明,有6种主要的定植次生演替植物:微孔草(Microula sikkimensis)、香薷(Elsholtziaciliate)、珠芽蓼、棘豆、委陵菜、蒿草。它们的植物量各不相同,其中微孔草和香薷作为优势种,植物量分别为42.41和26.16g/m2,分别占总地上植物量的39.27%和24.22%(表1)。
2.2 土壤三大类微生物数量空间分布特征及季节动态
2.2.1 土壤三大类微生物空间数量特征 土壤微生物以真菌、细菌和放线菌为主,是土壤最具有活性的成分。“黑土滩”草地土壤三大类微生物数量测定结果表明,三大类微生物数量在不同土壤深度的空间层次变化较大,以0~20cm土层数量高,随层次增加(20~40cm),数量下降。0~20cm土层真菌、细菌和放线菌的数量分别是20~40cm土层的4.02,1.12和1.92倍。2个土壤层次之间真菌、细菌、放线菌以及三大类微生物总数均呈显著差异水平(P<0.05)。土壤三大类微生物中,以细菌数量最多,占微生物总数的84.60%,真菌数量最低,占微生物总数的0.17%,细菌和放线菌占微生物总数的99.83%(表2)。这一结果表明,土壤三大类微生物的数量主要分布在0~20cm土层。这是因为在草原生态系统中,植物根系主要分布在0~20cm层,这一深度是植物-土壤-微生物系统最活跃的土壤层次。由于地上调落物的营养物质聚集、良好的土壤通气性及水热条件,这里分布着大量的植物根系与土壤之间物质与能量的交换活动,而微生物正是这些代谢活动的主要参与者。

表1 黑土滩植被状况及地上植物量Table 1 Vegetation and above-ground biomass

表2 土壤三大类微生物数量的空间分布Table 2 Spatial distribution of fungi,bacteria and actinomycetes
2.2.2 土壤三大类微生物数量的季节动态 微生物的生命活动主要受到环境中温度及湿度的影响。测定结果(图1)表明,天祝高寒草地土壤三大类微生物数量在不同时间(温度及降雨量差异大)动态中土壤真菌、细菌和放线菌数量存在差异性。2个土壤层呈现相似的变化趋势,即单驼峰变化曲线:数量从4月份开始平缓升高,至8月份达到顶峰,随后逐渐下降,但是0~20cm土层的数量变化幅度要高于20~40cm土层(图1)。0~20cm土层中三大类微生物数量最大值均出现在8月份,最小值在4月份,如土壤细菌的最大值为17.25×106cfu/g,土壤真菌的最小值为16.83×103cfu/g;20~40cm土层中,除了土壤细菌的最小值出现在10月份,其他土壤微生物的时间变化规律与0~20cm土壤基本保持一致,如土壤放线菌的最大值为5.79×106cfu/g,土壤细菌的最小值为6.70×106cfu/g。此外,土壤三大类微生物的总数量从4月的21.03×106cfu/g到8月的49.40×106cfu/g,10月25.95×106cfu/g,呈现先增长后降低的过程(图1)。
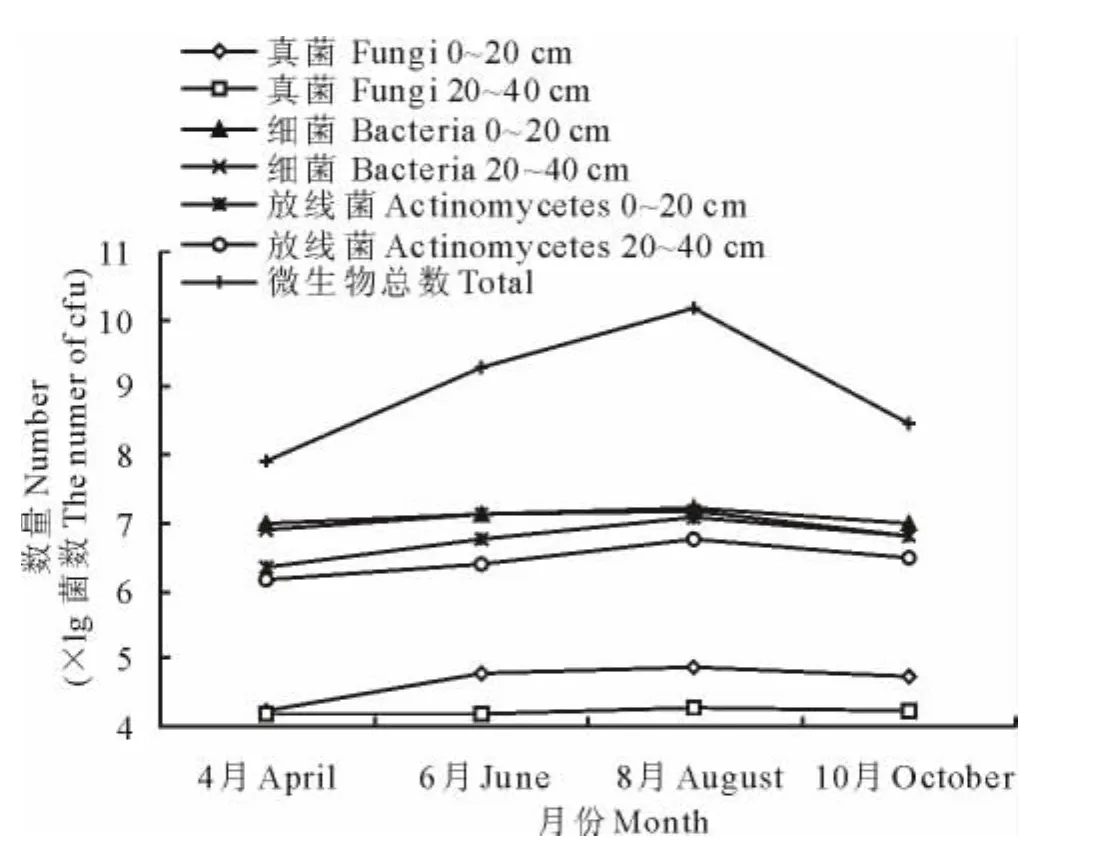
图1 土壤三大类微生物季节动态Fig.1 Seasonal dynamic of fungi,bacteria and actinomycetes
结果表明,土壤三大类微生物的数量存在一定的季节动态变化,这是植物-土壤-微生物系统中环境温、湿度变化的结果。在研究区,4-5月温度回升,土壤微生物活动逐步增强,数量逐渐增加;6-8月,温度和降雨量达到最大,植物生长和微生物的活动也最为活跃,三大类微生物的数量也达到最高,之后随时间延伸,气温下降,降水减少,植物生长和微生物生命活动减弱,三大类微生物的数量也在逐渐减少。亦即土壤三大类微生物的数量随水热条件的季节变化而同步变化。
2.3 土壤微生物氮素生理群数量空间分布特征及季节动态
2.3.1 土壤微生物氮素生理群的空间层次分布特征 土壤微生物氮素生理群以氨化细菌、硝化细菌、反硝化细菌和固氮菌为主要组成成分,是土壤氮素循环中重要的成分。“黑土滩”草地土壤微生物氮素生理群测定结果表明,氮素生理群数量空间层次分布以0~20cm土层数高,随层次增加(20~40cm),数量下降,土壤微生物0~20 cm土层数量与20~40cm数量之间的比例最低为1.18(氨化细菌),最高为2.63(硝化细菌)。如嫌气性固氮菌在0~20cm土壤中4月间平均值为7.52×103cfu/g,20~40cm土壤中为4.47×103cfu/g,2个层次间比例为1.68倍;且2个土壤层之间氨化细菌、硝化细菌、反硝化细菌以及固氮菌和微生物总数的差异均呈现显著水平(P<0.05)。氮素生理群中,以好气性固氮菌数量最多,占微生物总数的57.51%,嫌气性固氮菌数量最少,占微生物总数的0.05%(表3)。
结果表明,土壤微生物氮素生理群的分布主要集中在植物-土壤-微生物系统最活跃的0~20cm土层,其空间层次分布与土壤三大类微生物一致。这主要是因为有机氮源的主要来源——地上调落物残体和植物根系等聚集在该层次,同时植物根系与土壤之间物质与能量的交换活动也在该层次发生。

表3 土壤微生物氮素生理群的空间层次Table 3 Spatial distribution of physiological bacteria group of nitrogen
2.3.2 土壤微生物氮素生理群季节动态 “黑土滩”草地土壤微生物氮素生理群季节动态测定结果表明,不同时间动态中氨化细菌、硝化细菌、反硝化细菌、好气性固氮菌和嫌气性固氮菌数量存在差异性。2个土壤层次与土壤三大类微生物变化规律一致,呈现单驼峰变化曲线:数量从4月份开始平缓升高,至8月份达到顶峰,随即转而下降(图2)。0~20cm土壤中氮素生理群数量最大值均出现在8月份,最小值在4月份,如土壤氨化细菌的最大值为17.14×106cfu/g,土壤嫌气性固氮菌的最小值为3.86×103cfu/g;20~40 cm土壤中,除了土壤氨化细菌和好气性固氮菌的最小值出现在10月份,其他土壤微生物的时间变化规律与0~20cm土壤基本保持一致,如好气性固氮菌的最大值为6.60×104cfu/g,土壤硝化细菌的最小值为3.53×103cfu/g。土壤微生物氮素生理群的总数(图2)也表现出相似的动态变化。微生物总数中8月与其他月份差异显著,而6月与10月差异不显著,4月与6月差异不显著。

图2 土壤氮素生理群的季节动态Fig.2 Seasonal dynamic of physiological group of nitrogen
2.4 土壤微生物氮素生理群数量与草地生物量和土壤氮素的相关性
土壤中的氮素含量由全氮来表示,包含了有机氮与无机氮。植物群落的地上生物量反映了植物群落的生物积累量,对于研究草食动物的环境容纳量、草地植被的恢复等是必不可少的定量化指标,也是草地管理的重要依据[20]。对天祝高寒草地的五种土壤微生物氮素生理群数量、草地植物量和土壤全氮含量进行相关性分析(表4),结果表明,土壤全氮含量与氮素生理群中的硝化细菌、好气性固氮菌数量的相关系数分别为0.834和0.785,达到显著水平(P<0.05);与氨化细菌的数量无相关性或相关性极小;与反硝化细菌数量的相关系数为-0.801,也达到了显著水平(P<0.05)。同时,草地植物量和土壤微生物氮素生理群的数量之间的相关性结果表明,草地植物量与氮素生理群中的好气性固氮菌、氨化细菌和硝化细菌数量的相关系数分别为0.887,0.839和0.822,均达到了显著水平(P<0.05);与反硝化细菌数量的相关系数为-0.922,也达到了极显著水平(P<0.05)。
3 讨论
3.1 土壤微生物的空间变化
本研究中微生物(真菌、细菌和放线菌及氨化细菌、硝化细菌、反硝化细菌、好气性固氮菌和嫌气性固氮菌)主要分布在0~20cm土壤中,随着土壤深度的增加,数量逐步减少,这与前人研究土壤微生物空间分布的情况一致。如王素娟等[21](2008)对库布齐沙地不同生境下土壤微生物细菌、真菌、放线菌、自身固氮菌数量进行研究中得出不同菌种之间表现为细菌最多,其次是自身固氮菌、放线菌,最后是真菌。土壤微生物数量垂直分布顺序是5~10cm>10~20cm。丁玲玲等[22](2007)对青藏高原东祁连山6种不同的高寒草地型土壤微生物数量的研究中得出土壤微生物数量在表土层(0~10cm)居多。土壤微生物氮素生理群根据其相同或不同的形态,参与土壤氮素循环的活动。其中氨化细菌、硝化细菌、固氮细菌和反硝化细菌在土壤氮素转化中发挥着重要作用。土壤中氮素生理群的存在与活动对于土壤肥力以及植物营养具有重要意义。氨化细菌类群参与土壤中有机态氮转化为氨的过程,还将动植物残体中的氮素分解回归于环境中。生物体的含氮物质主要是蛋白质,生物死亡后,蛋白质主要被细菌分解氨化。天祝高寒草原黑土滩氨化细菌在0~20cm和20~40cm两层土壤中,总数量为2.31×104cfu/g,是土壤微生物氮素生理群总数量的9.06%。硝化细菌是一种自养需氧型细菌,以二氧化碳为碳源,通过代谢将氨或铵盐氧化成硝酸盐。在土壤中氮素循环硝化作用的第一阶段和第二阶段连续进行,包括亚硝化菌和硝化菌,通常测定亚硝化细菌的数量。反硝化细菌是一种能引起反硝化作用的细菌,多为异养、兼性厌氧细菌,如反硝化杆菌和斯氏杆菌等。它在土壤中还原那些因消化作用所累积的硝酸盐。天祝高寒草原地区黑土滩硝化细菌的数量在土壤微生物氮素生理群中较少,在0~20cm和20~40cm两层土壤中,总数量为13.75×103cfu/g,是土壤微生物氮素生理群总数量的0.06%;反硝化细菌的数量比硝化细菌多,在0~20cm和20~40cm两层土壤中,总数量为5.88×104cfu/g,是土壤微生物氮素生理群总数量的0.25%,几乎是硝化细菌的4.3倍。好气性以及嫌气性固氮菌与植物体内共生固氮菌不同,它们不会定殖在植物体内并且能从空气中吸收氮气,繁殖后代,残体还将营养留给植物,让植物得到大量氮肥。好气性固氮菌在土壤及大气的氮素平衡中起重大作用,他们固氮能力较强。嫌气性固氮菌同好气性固氮菌一样具有一定固氮能力,只是生活在严格的厌氧条件中。天祝高寒草原黑土滩中好气性固氮菌比嫌气性固氮菌数量多,在0~20cm和20~40cm两层土壤中,好气性固氮菌总数量为14.67×104cfu/g,是土壤微生物氮素生理群总数量的0.63%,而嫌气性固氮菌总数量为1.30×103cfu/g,是土壤微生物氮素生理群总数量的0.06%,是好气性固氮菌的0.09倍。如姚拓和龙瑞军[10](2006)研究5种不同干扰生境,得到不同空间层次草地土壤微生物数量变化均较大,0~20cm土层的数量均大于20~40cm,一般0~20cm土层的数量是20~40cm的2~7倍。高晓星等[23](2013)在与本实验相同地段获得嵩草内生细菌,其生物防治作用发生在线叶嵩草(Kobresiacapillifolia)的根茎(0~10cm)甚至地上部位。微生物群落变化也会影响其空间分布,古丽君等[24](2013)研究中发现木霉的定殖会对微生物群落发生改变,土壤细菌大量增加,土壤真菌繁殖得到抑制。Grundmann和Debouzie[25](2000)利用1mm直径的土壤探针测得氮素生理群中的硝化杆菌仅在2~4mm中存在空间上的聚集,认为形成这种分布的主要原因由于土壤团聚体和细根的存在。
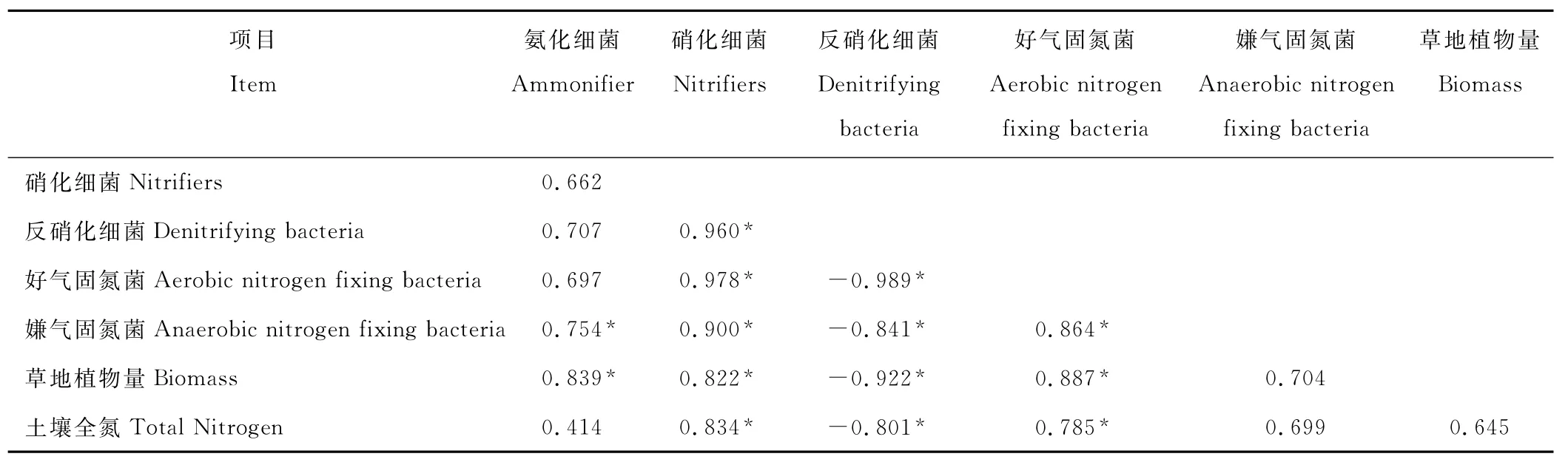
表4 土壤微生物氮素生理群数量、草地植物量和土壤全氮含量相关系数Table 4 Coefficient of population of physiological group,content of above-ground biomass and soil total nitrogen
3.2 土壤微生物季节变化
本研究中微生物数量的变化均随季节(温度及降雨量差异大)的推移,呈现出先升高后降低的季节动态规律,这与前人研究结论相似。如张崇邦[26](2002)研究东北羊草(Leymuschinensis)草原杂草土壤微生物生物量以及土壤环境因子的季节动态得出,杂草土壤微生物生物量和呼吸速率具有明显的季节变化规律,最大值出现在8月(12.78×10-3g/g干土,16.24×10-3g/g干土·d),呈单峰曲线变化趋势;其认为这主要与土壤营养成分、水热条件有密切关系。王素娟等[21](2008)的研究中,细菌、真菌、放线菌、自身固氮菌4种微生物数量的季节变化为夏季是秋季的2.25倍,是冬季的26.13倍,秋季是冬季的11.64倍。本研究中微生物数量8月夏季最多,4月或10月冬春季最少与此一致。Eviner和Chapin[27](2005)的研究中,春季末期由于哺育等活动出现的小型洞穴对土壤的扰动很小,对氮素循环的影响也只限于短期作用,这与本研究中4月中整体氮素生理群的数量最低相一致。而冬季出现的大型鼠丘堆对于土壤有很大程度的扰动,并且极大地增加了固氮速率,这是因为土壤温度是微生物数量与活性的重要影响因子。植物根系附近存在着一系列生理生化反应,土壤微生物通过自身酶系统参与氮素循环硝化作用以及固定大气中氮气的反应,且微生物的生命活动本身又是由一系列的生物化学反应组成,温度的改变直接影响着整个生理生化反应的水平。天祝地区从4月份开始地面逐渐解冻,地表积温不断增加,土壤中的生理生化反应不断加剧,微生物的数量也随之上升;8月份过后气温下降,10月份进入冬季,土壤中生理生化反应逐渐减少,微生物的数量也随之下降。因此温度与土壤微生物数量呈现正相关的关系。
3.3 “黑土滩”草地中氮素生理群与氮素的关系
土壤中氮素的变化与土壤微生物的改变相关联,本研究中参与土壤氮素循环的硝化细菌及固氮菌与土壤全氮量之间相关性较高。丁玲玲等[22](2007)的研究中得出土壤微生物总数与土壤全氮相关性显著。Tresserras和lvarez[28](2004)得到的研究证明黑土滩的扰动和土壤中氮素的可利用性之间有关联,最近受到扰动的土壤中有机氮的含量高于周边牧场;并且研究得出高山草原有机氮的利用率帮助形成了最早定殖在黑土滩上的杂草还有非菌根物种。Canals等[29](2005)在最早的定殖植物物种对氮素动态的影响研究中发现这些物种对衣囊鼠鼠丘上整个草地群落后续动态都有重要的作用。豆科牧草的轮作对土壤中氮素含量的改变很大,在曹莉等[30](2013)对连作马铃薯(Solanumtuberosum)田土壤微生物菌群的研究中,与种植牧草前相比好气型固氮菌数量最高增加283.69%。黑土滩上小型哺乳动物的扰动对土壤的理化性质产生改变:在Dinesman[31](1967)的研究中,鼹鼠(Talpaeuropea)的打洞作用使得大量钙与镁元素重回土壤中,而这些钙和镁原本被密集的根系活动所吸收过滤。在Ross等[32](1968)的研究中,“黑土滩”草地土壤都具有以下特点:土壤密度较低,土壤结构较松散,比相邻未经扰动土壤有较高透水性。在Zlotin和Kodashova[33](1974)的研究中,小型哺乳动物挖掘的黑土滩土壤温度明显增高,并且快速形成的地表碎块阻止了蒸发作用。在5~20cm的土壤深度,黑土滩的水分含量比未经扰动的土壤中高7~8倍。Wearn和Gange[34](2007)的研究表明,对地下以菌根真菌为主的生物合成起决定性作用的因素主要是地上草食动物的种类和啃食强度。
[1] 李希来.青藏高原“黑土滩”形成的自然因素与生物学机制[J].草业科学,2002,19(1):20-22.
[2] 马玉寿,尚占环,施建军,等.黄河源区“黑土滩”退化草地群落类型多样性及其群落结构研究[J].草业科学,2006,23(12):6-11.
[3] 李希来,黄葆宁.青海黑土滩草地成因及治理途径[J].中国草地,1995,4:64-67,51.
[4] 刘维香,马寿,刘贵萍.天峻县黑土滩成因及治理对策[J].青海草业,2010,19(1):21-24.
[5] 程晓月,后源,任国华,等.“黑土滩”退化高寒草地6种常见毒杂草水浸液对垂穗披碱草的化感作用[J].西北植物学报,2011,31(10):2057-2064.
[6] 李世雄,马玉寿,王彦龙,等.黑土滩人工草地土壤种子库季节动态研究[J].青海畜牧兽医杂志,2011,41(5):4-6.
[7] 王彦龙,马玉寿,施建军,等.黄河源区“黑土滩”混播草地牧草植物量及营养动态初探[J].草业科学,2010,27(5):19-22.
[8] 李希来.补播禾草恢复“黑土滩”植被的效果[J].草业科学,1996,13(5):17-19.
[9] 陈生云,刘文杰,叶柏生,等.疏勒河上游地区植被物种多样性和生物量及其与环境因子的关系[J].草业学报,2011,20(3):70-83.
[10] 姚拓,龙瑞军.天祝高寒草地不同扰动生境土壤三大类微生物数量动态研究[J].草业学报,2006,15(4):93-96.
[11] 姚拓,龙瑞军,师尚礼,等.高寒草地不同扰动生境土壤微生物氮素生理群数量特征研究[J].土壤学报,2007,44(1):122-129.
[12] 肖风劲,欧阳华.生态系统健康及其评价指标和方法[J].自然资源学报,2002,17(2):203-209.
[13] 高清竹,段敏杰,李玉娥,等.1981-2006年藏西北地区草地植被盖度动态变化分析[J].中国农业气象,2010,31(4):582-585.
[14] 张云霞,李晓兵,陈云浩.草地植被盖度的多尺度遥感与实地测量方法综述[J].地球科学进展,2003,18(1):85-93.
[15] 范永刚,胡玉昆,李凯辉,等.不同干扰对高寒草原群落物种多样性和生物量的影响[J].干旱区研究,2008,25(4):531-536.
[16] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[17] 许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[18] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2007.
[19] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:147-195.
[20] 王一博,王根绪,吴青柏,等.植被退化对高寒土壤水文特征的影响[J].冰川冻土,2010,32(5):989-998.
[21] 王素娟,苏和,高丽.库布齐沙地土壤微生物数量初步研究[J].中国草地学报,2008,(6):91-95.
[22] 丁玲玲,祁彪,尚占环,等.东祁连山不同高寒草地型土壤微生物数量分布特征研究[J].农业环境科学学报,2007,(6):106-113
[23] 高晓星,满百膺,陈秀蓉,等.东祁连山线叶嵩草内生细菌X4的产吲哚乙酸、解磷、抗菌和耐盐特性研究及分子鉴定[J].草业学报,2013,22(4):137-146.
[24] 古丽君,徐秉良,梁巧兰,等.生防木霉对草坪土壤微生物区系的影响及定殖能力研究[J].草业学报,2013,22(3):321-326.
[25] Grundmann G L,Debouzie D.Geostatistical analysis of the distribution of NH4+-and NO2-oxidizing bacteria and serotypes at the millimeter scale along a soil transect[J].FEMS Microbial Ecology,2000,34:57-62.
[26] 张崇邦.东北羊草草原土壤微生物生长动态模型的研究[J].草地学报,2002,10(1):134-138.
[27] Eviner V T,Chapin III F S.Selective gopher disturbance influences plant species effects on nitrogen cycling[J].OIKOS,2005,109:154-166.
[28] Tresserras R M C,lvarez M T S.Role of small mammal disturbances in mountain grasslands[J].PASTOS,2004,1:47-60.
[29] Canals R M,Eviner V T,Herman D J,etal.Plant colonizers shape early N-dynamics in gopher-mounds[J].Plant and Soil,2005,276:327-334.
[30] 曹莉,秦舒浩,张俊莲,等.轮作豆科牧草对连作马铃薯田土壤微生物菌群及酶活性的影响[J].草业学报,2013,22(3):139-145.
[31] Dinesman L G.Influence of vertebrates on primary production of terrestrial communities[A].In:Petrusewica K.Secondary Productivity of Terrestrial Ecosystems[M].Minnesota,1967:261-266.
[32] Ross B A,Tester J R,Breckenridge W J.Ecology of mima-type mounds in north-western Minnesota[J].Ecology,1968,49:172-177.
[33] Zlotin R E,Kodashova K S.The Role of Animals in the Biological Cycle of the Forest-steppe Ecosystem[M].Moscow:Science Publishing House,1974.
[34] Wearn J A,Gange A C.Above-ground herbivory causes rapid and sustained changes in mycorrhizal colonization of grasses[J].Oecologia,2007,153:959-971.
