4A和13X分子筛去除水中重金属Cd2+及其吸附性能研究
2014-03-26刘鲁建
石 飞,刘 红,刘鲁建,董 俊
(1.湖北科亮生物工程有限公司,湖北 武汉,430065;2.武汉科技大学资源与环境工程学院,湖北 武汉,430081)
重金属离子废水处理方法有化学沉淀法、氧化还原法、电解法、离子交换法和吸附法等,其中化学沉淀法应用最为广泛[1-4]。但是对于低浓度废水,采用化学沉淀法存在投资大、运行成本高、易产生二次污染等问题。吸附法因材料便宜易得、成本低、去除效果好而成为研究的重点[5-8]。可采用累托石改性吸附水中重金属离子,也可直接采用天然沸石或用改性沸石对重金属离子进行吸附,但是这些材料的制备及改性过程往往复杂繁琐,且吸附效率不高[9-10]。
分子筛是一种人工合成的具有连通孔道、呈架构状的含水铝硅酸盐化合物,特殊的晶体结构使之拥有离子交换、高效选择性吸附、催化等优异性能,而且容易再生,被吸附离子容易回收,已成为水处理材料研究的热点[11-12]。由于分子筛晶体结构中部分四价硅被三价铝所取代,致使负电荷过剩,结构中有一价或二价阳离子如Na+、K+、Ca2+、Mg2+等来补偿过剩电荷,这些阳离子存在于分子筛的大空洞中,可与通过静电作用吸附于分子筛表面的阳离子或带正电荷的基团发生离子交换反应[13]。此外,分子筛有很大的比表面积,也可通过表面吸附重金属离子使其浓度降低[14-15]。为此,本文以分子筛作为吸附剂对废水中Cd2+进行吸附,考察分子筛种类、废水初始pH值、Cd2+浓度等对Cd2+去除率的影响,并探讨了分子筛对Cd2+的吸附模型、吸附动力学和吸附性能,以期为分子筛在重金属离子废水处理中的应用提供依据。
1 试验
1.1 材料与药剂
本试验所用吸附材料分别为4A分子筛、13X分子筛和MCM-41分子筛,以上均为市售;所用药剂分别为氯化镉、盐酸和氢氧化钠,以上均为分析纯。
1.2 试验方法
在室温下,配制一定初始浓度的含重金属离子Cd2+废水,调节废水初始pH值,加入一定量的分子筛吸附材料并充分混合,在JJ-4型六联电动搅拌器中搅拌一段时间,搅拌速度为200 r/min,静置分层时间为30 min,然后取上清液检测。利用GGX-9型原子吸收分光光度计检测溶液中Cd2+的浓度并计算Cd2+的去除率[16],η值计算式为
η=(C0-Ct)/C0×100%=
(A0-At)/A0×100%
(1)
式中:C0为Cd2+的初始浓度;Ct为反应t时间后Cd2+的浓度;A0为Cd2+的初始吸光度;At为反应t时间后Cd2+的吸光度。
1.3 Cd2+检测
准确称取氯化镉1.019 g,用去离子水溶解,在500 mL容量瓶中定容,得到浓度为1 g/L的Cd2+标准储备液。取5 mL的Cd2+标准储备液于1 L的容量瓶中定容,得到浓度为5 mg/L标准使用液,再分别移取0、0.5、1、3、5和10 mL的5mg/L标准使用液于50mL的比色管中定容,得到浓度分别为0、0.05、0.1、0.3、0.5和1mg/L的标准溶液。采用原子吸收分光光度计检测标准溶液并绘制标准曲线,依此确定样品中的Cd2+浓度。
2 结果与分析
2.1 分子筛种类对废水Cd2+去除率的影响
常用的分子筛种类有A型、X型和M型等,分别以不同投加量的4A、13X和MCM-41分子筛去除废水中Cd2+,Cd2+初始浓度为20 mg/L、废水的pH值为5、吸附时间为50 min,其结果如图1所示。由图1可看出,4A和13X分子筛对Cd2+的去除效果均明显高于MCM-41分子筛对Ca2+的去除效果。随着分子筛投加量的增加,Cd2+的去除率提高,在4A和13X分子筛投加量仅为0.16 g/L时,Cd2+去除率已达到95%以上,此后随分子筛投加量的增加,Cd2+去除率基本保持不变。
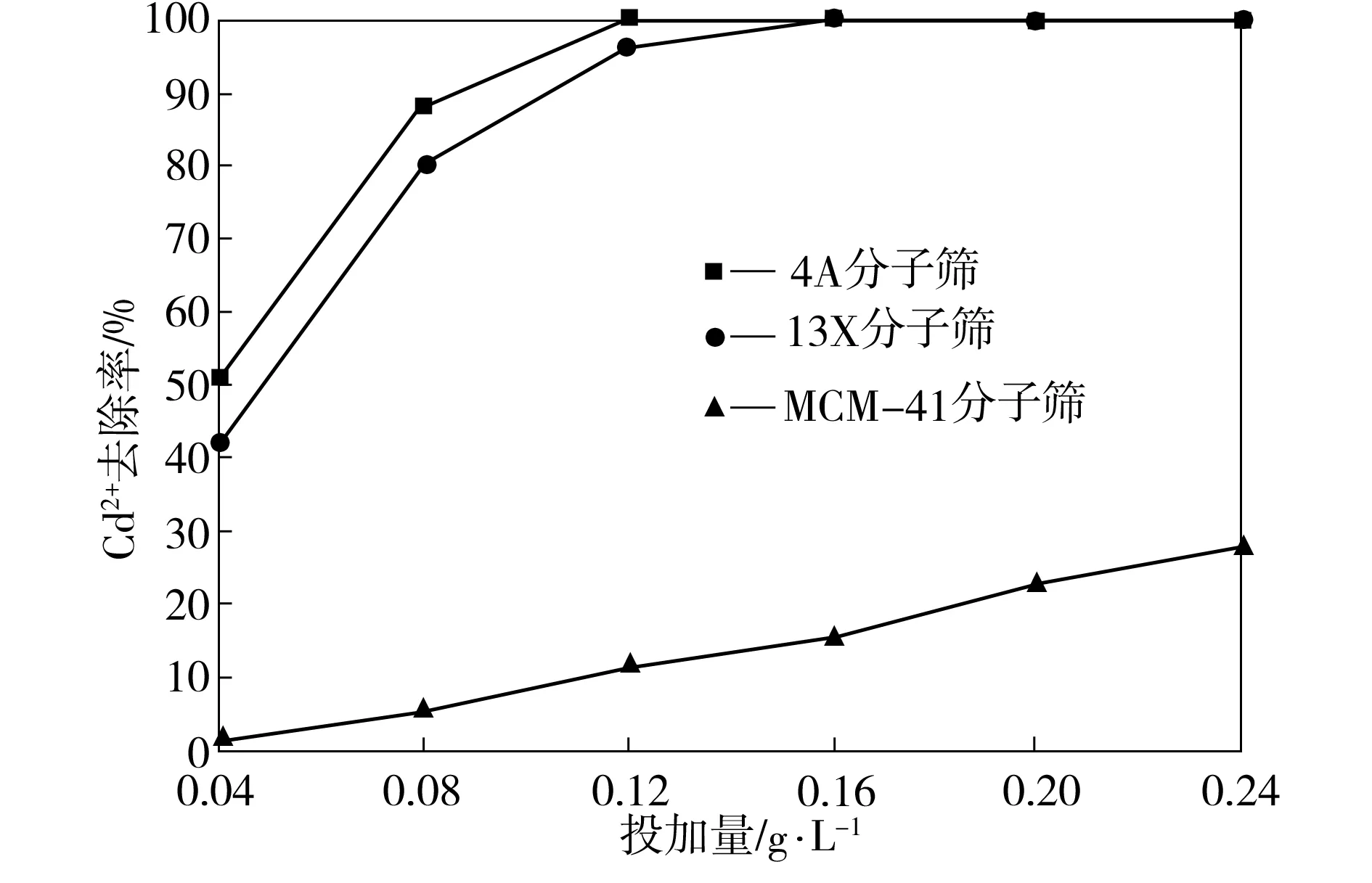
图1 分子筛种类对Cd2+去除率的影响
Fig.1EffectofthemolecularsievevarietyontheremovalrateofCd2+
由于分子筛结构的不同,对废水中Cd2+的去除机制和效果不一样。4A和13X分子筛结构中Na+、K+等阳离子补偿过剩负电荷,可与Cd2+进行交换反应,从而能有效地去除废水中的Cd2+,而MCM-41分子筛的化学组成为SiO2,不存在Na+、K+等阳离子,与Cd2+不能发生离子交换作用,去除Cd2+的作用主要为表面吸附,但由于表面羟基的存在,MCM-41表面带负电,在pH值为5的弱酸性条件下,H+减弱了表面负电性,不利于吸附带正电的Cd2+。
2.2 pH值对废水Cd2+去除率的影响
为了对比不同废水pH值对Cd2+去除率的影响,在4A和13X分子筛投加量为0.25 g/L、Cd2+初始浓度为20 mg/L、吸附时间为50 min的条件下进行吸附,其结果如图2所示。由图2可看出,4A和13X分子筛对Cd2+的去除率随着废水pH值的升高而提高,且当pH值大于4时,分子筛对Cd2+的去除率基本上达到稳定。这是因为在较低pH值时,H+浓度较高,与Cd2+存在着竞争吸附,且H+竞争能力优于Cd2+,因此两种分子筛对Cd2+的去除率都不高;当pH值升高时,H+的影响减弱,Cd2+得以与分子筛表面的Na+、K+等阳离子发生离子交换作用。
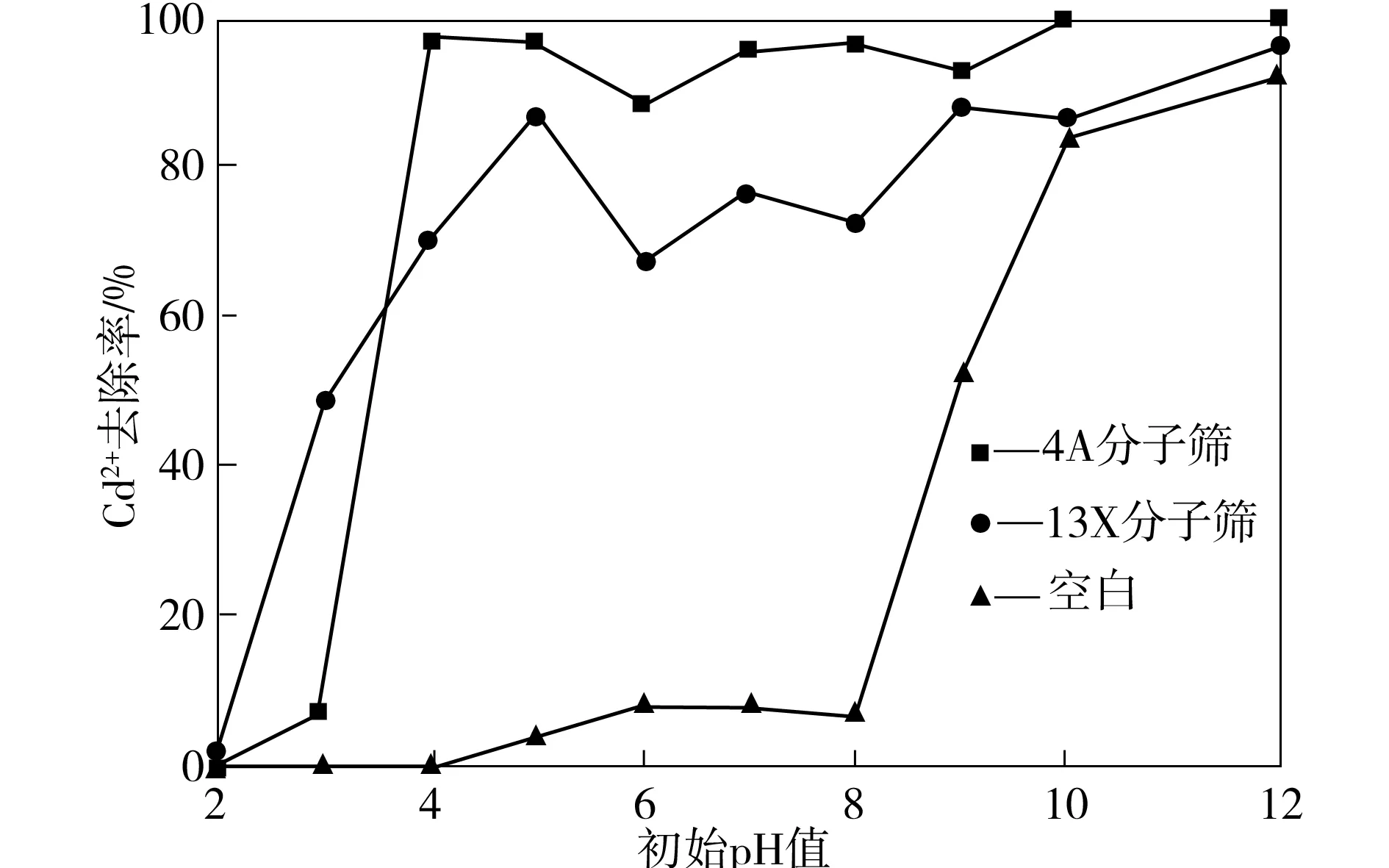
图2 pH值对废水Cd2+去除率的影响Fig.2 Effect of pH value on the removal rate of Cd2+
图3为废水pH值对羟基镉离子分布系数的影响。由图3可看出,Cd在废水中的存在形式随着pH值的变化而改变。当pH值小于9.8时,主要以游离Cd2+以及少量CdOH+和Cd(OH)2存在,因此分子筛对Cd2+的吸附作用较强,Cd2+去除率较高。随着pH值的增加,Cd在水中的形态逐渐由Cd(OH)+向Cd(OH)2转化,当pH值增至12左右时,Cd主要存在形态为Cd(OH)2沉淀,此时镉的高去除率主要来自Cd(OH)2从废水中的沉淀分离。为了减少生成Cd(OH)2沉淀对Cd2+去除率的影响以及出水尽可能保持在中性,应选择分子筛吸附时废水的初始pH值为5。
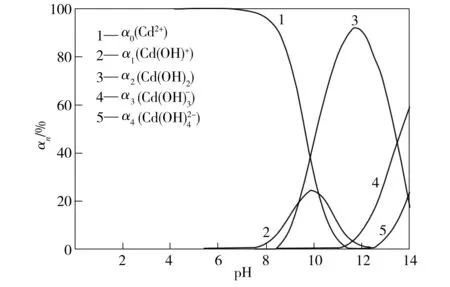
图3 pH值对羟基镉离子分布系数的影响
Fig.3EffectofpHvalueonthedistributionrateofhydroxycadmiumion
2.3 Cd2+浓度对Cd2+去除率的影响
图4为Cd2+初始浓度对Cd2+去除率的影响(分子筛投加量为0.25 g/L,吸附时间为50 min)。由图4可看出,Cd2+初始浓度小于40 mg/L时,4A和13X分子筛对Cd2+的去除率较为稳定,且4A分子筛对Cd2+的去除效果明显优于13X分子筛对Cd2+的去除效果,其Cd2+去除率达到99%以上。当Cd2+初始浓度大于40 mg/L时,两种分子筛对Cd2+的去除率随着Cd2+初始浓度的增加而明显下降。
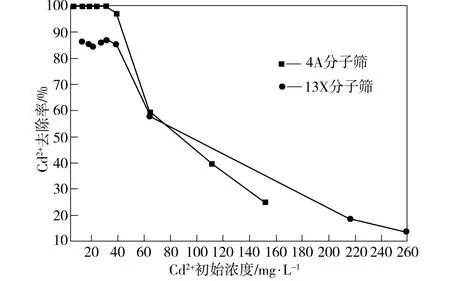
图4 Cd2+浓度对Cd2+去除率的影响Fig.4 Effect of concentration of Cd2+ on its removal rate
为研究单位质量分子筛对Cd2+的吸附量,按式(2)计算吸附容量,其结果如图5所示。
Qa=(C0-Ct)V×10-3/m
(2)
式中:Qa为吸附容量,mg/g;C0为Cd2+的初始浓度,mg/L;Ct为取样时Cd2+浓度,mg/L;V为溶液体积,mL;m为吸附剂用量,g。
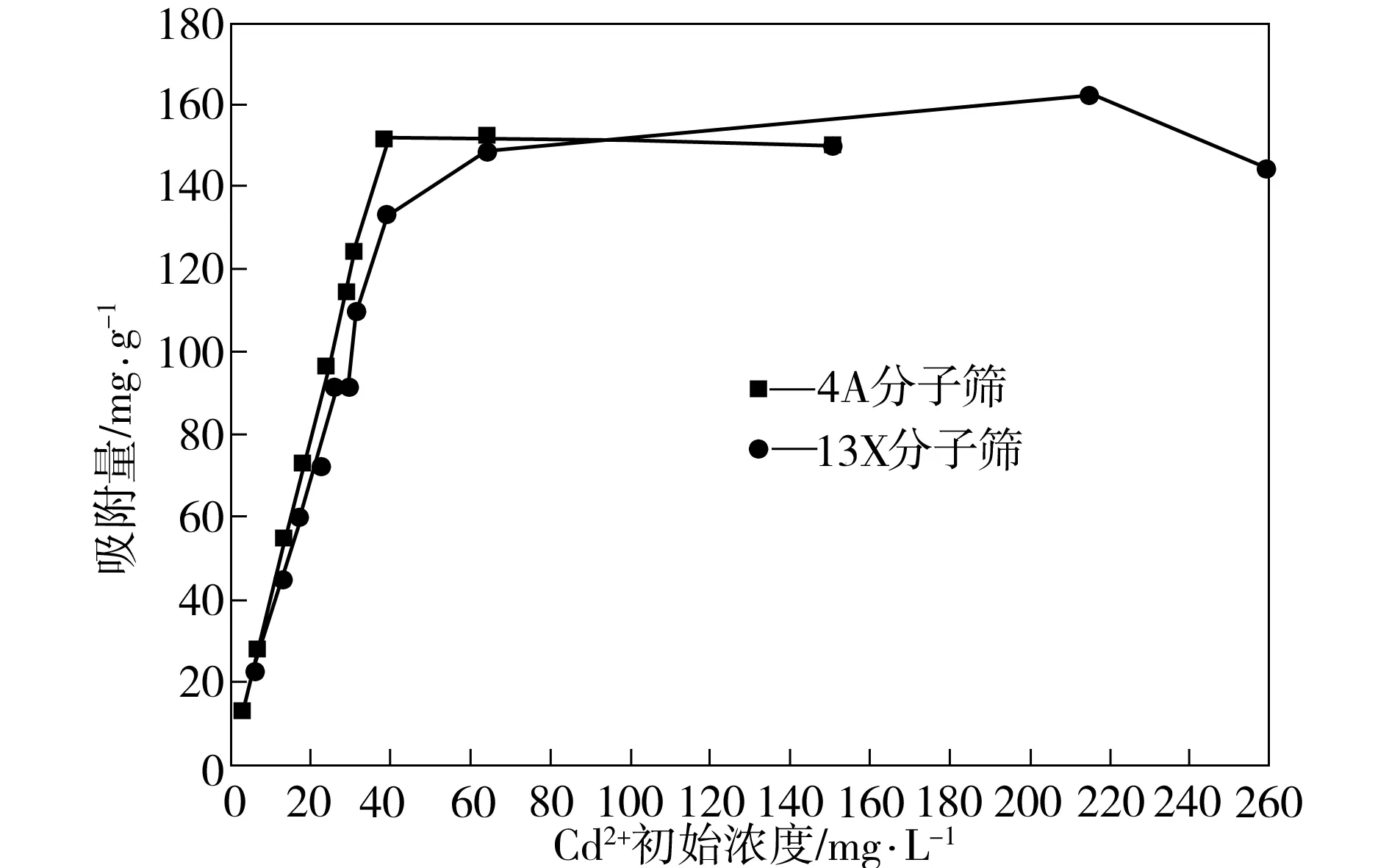
图5 Cd2+初始浓度对Cd2+吸附量的影响Fig.5 Effect of initial concentration of Cd2+ on its adsorption capacity
由图5可看出,Cd2+初始浓度小于40 mg/L时,4A和13X分子筛对Cd2+的吸附量随Cd2+浓度的增大而增加,Cd2+初始浓度大于40 mg/L,分子筛对Cd2+的吸附量基本保持稳定。这是因为分子筛对重金属离子的吸附量与其吸附位点的饱和程度有关。当Cd2+初始浓度小于某一值时,分子筛的吸附未达到饱和,因此其吸附容量随Cd2+初始浓度的增大而增加。Cd2+浓度继续增大后,由于吸附位点逐渐饱和,Cd2+浓度的增大不能再引起吸附容量的增加。因此在应用分子筛去除废水中的Cd2+时,应根据分子筛对Cd2+的吸附容量来确定分子筛的用量,以保证有效地利用分子筛,使出水达到预定要求。
2.4 吸附等温线模型分析
通过对不同初始浓度下4A和13X分子筛吸附Cd2+的平衡吸附容量数据按Langmuir和Freundlich吸附模型进行线性方程拟合,其结果如表1和表2所示。
表1Langmuir吸附等温模型拟合参数
Table1FittingparametersbyLangmuiradsorptionisothermmodel
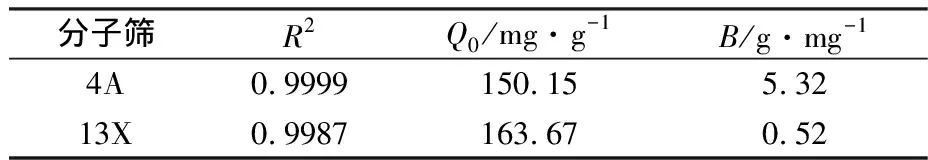
R2Q0/mg·g-1B/g·mg-14A0.9999150.155.3213X0.9987163.670.52
注:Q0为最大吸附量;B为吸附强度。
表2Freundlich吸附等温模型拟合参数
Table2FittingparametersbyFreundlichadsorptionisothermalmodel
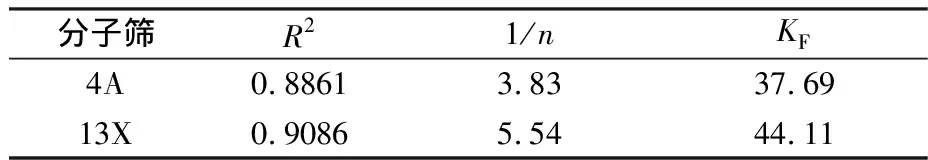
R21/nKF4A0.88613.8337.6913X0.90865.5444.11
注:1/n为吸附指数;KF为吸附系数。
由表1和表2中的相关系数R2可知,4A和13X分子筛对废水中Cd2+的吸附均更符合Langmuir吸附模型。吸附是单分子层,且被吸附的物质之间不存在相互作用。
4A和13X分子筛中Na+能与水中Cd2+发生离子交换吸附,是由于分子筛独特的结构特性,其中可交换的Na+之间的空间间距较大,因而交换后的重金属离子之间无相互作用。这些均与Langmuir吸附模型的基本假设相吻合。
2.5 吸附动力学分析
在不同搅拌吸附时间下,测定4A和13X分子筛对Cd2+的去除效果,其结果如图6所示。由图6可看出,在吸附时间不足2 min时,4A和13X分子筛对Cd2+的去除率都达到了95%以上,表明吸附速率非常快,此后随着吸附时间延长至60 min,其去除率也基本保持稳定。
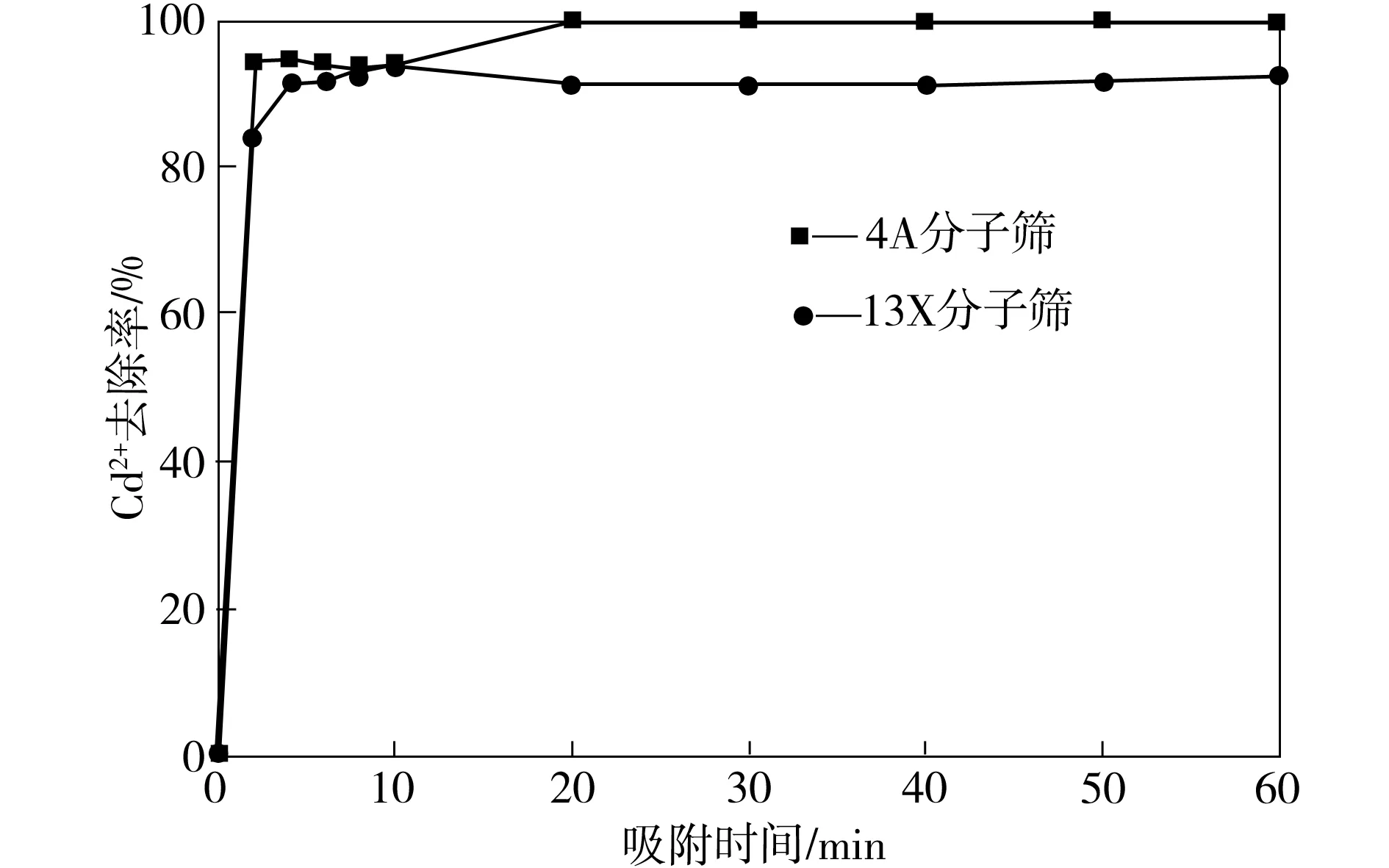
图6 吸附时间对Cd2+去除率的影响Fig.6 Effect of stirring time on the removal rate of Cd2+
4A和13X分子筛对Cd2+能如此快速地吸附,除了与分子筛的多孔结构、巨大的比表面积、表面电性及良好的表面吸附和离子交换功能有关外,还可能与Cd2+所带电荷数、离子半径等密切相关,这尚有待于进一步研究。
根据分子筛吸附Cd2+的数据,可按Lagergren二级速率方程进行拟合[17-18],拟合结果如表3所示。二级速率方程模型是一种较为快速的吸附行为,其速率方程为
(3)
式中:Qe为吸附平衡时的吸附容量,mg/g;Qt为吸附时间t时的吸附容量,mg/g;K2为二级吸附速率常数,g/(mg·s)。
表3Lagergren二级速率方程拟合参数
Table3FittingparametersofLagergrensecondaryrateequation
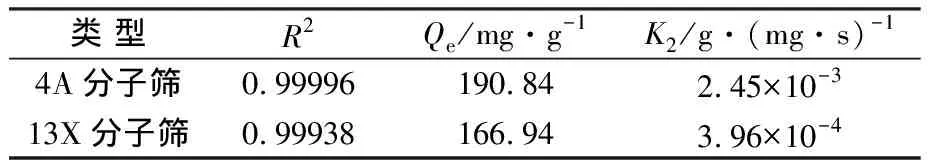
R2Qe/mg·g-1K2/g·(mg·s)-14A0.99996190.842.45×10-313X0.99938166.943.96×10-4
由表3可看出,4A和13X分子筛对Cd2+的吸附均符合Lagergren二级速率方程,相关系数R2均在0.999以上。计算得出的4A和13X分子筛平衡吸附量分别为190.84、166.94 mg/g。
为了进一步确定分子筛对Cd2+的作用机理,对吸附时间为10 min内废水中剩余的Cd2+浓度和交换下来的Na+浓度进行检测,并计算两者的比值,其结果如表4所示。
从表4中可看出,交换出来的Na+与分子筛吸附的Cd2+摩尔浓度比接近2,可以得出分子筛对Cd2+的去除作用主要是离子交换吸附。其作用原理为
表4Na+交换量和Cd2+吸附量摩尔浓度比
Table4MolarconcentrationratioforexchangecapacityofNa+andadsorptioncapacityofCd2+

/min2468104A2.52.71.81.91.813X2.11.61.91.91.9

(4)
式中:M为分子筛;X+为分子筛中可交换的阳离子;Y+为废水中阳离子。
离子交换反应进行程度与分子筛中可交换阳离子的数量和水溶液中阳离子的浓度密切相关。在反应初期,Na+与Cd2+浓度比值大于2,是因为水中的H+与Cd2+存在竞争吸附,置换下来的Na+浓度较高。
2.6 几类吸附剂性能对比
以4A和13X分子筛、阳离子交换树脂、累托石、活性炭和活性氧化铝作为吸附剂,配制Cd2+浓度为50 mg/L的废水,体积为400 mL,初始pH值为5,吸附剂投加量为0.25 g/L。计算不同吸附材料对Cd2+去除率的影响,其结果如图7所示。由图7可看出,同等反应条件下4A和13X分子筛对Cd2+的去除率高达90%以上,而离子交换树脂、累括石、活性炭和活性氧化铝对Cd2+的去除率不到20%,这表明靠单一的物理吸附或者离子交换作用,其去除效果不好。而分子筛既有类似离子交换树脂的阳离子交换性,又有类似活性炭的热稳定性、耐高温性能及吸附性,是一种性能良好的吸附材料。

图7 吸附剂种类对废水Cd2+去除率的影响
Fig.7EffectofadsorbentvarietyontheremovalrateofCd2+
3 结论
(1)分子筛能有效地去除废水中的重金属离子,当4A和13X分子筛投加量为0.16 g/L、水溶液初始pH值为5、Cd2+浓度为20 mg/L时,吸附平衡后Cd2+去除率达到95%以上。
(2)4A和13X分子筛对Cd2+的吸附均符合Langmuir吸附等温模型和Lagergren二级速率方程,平衡吸附量分别为190.84、166.94 mg/g。
(3)分子筛去除废水中Cd2+主要是通过离子交换吸附实现的,交换出来的Na+与分子筛吸附的Cd2+摩尔浓度比为2。
[1] M Rao, A V Parwate, A G Bhole. Removal of Cr6+and Ni2+from aqueous solution using bagasse and fly ash[J]. Waste Management, 2002, 22: 821-830.
[2] Chien Jung, Juu En Chang. Effect of fly characteristics on the removal of Cu(II) from aqueous solution[J]. Chemosphere, 2001, 44: 1185-1192.
[3] Cengiz Duran Atis. High volume fly ash abrasion resistant contrete[J]. Mater Civ Eng, 2002, l4(3): 274-277.
[4] Mott H V, Weber W J. Soption of low molecular weight organic contaminants by fly ash: consideration for the enhancement of cut off barrier performance[J]. Environ Sci Technol, 1992, 26: 1234-1242.
[5] 黄君涛,熊帆,谢伟立.吸附法处理重金属废水研究进展[J].水处理技术,2006,32(2):9-12.
[6] Kim Dong Seog. The removal by crab shell of mixed heavy metal ions in aqueous solution[J]. Bioresource Technology, 2003, 87(3): 355-357.
[7] 李霞,李风亭,张冰如.生物吸附法除水中重金属离子[J].工业水处理,2004,24(4):1-4
[8] 梁莎,冯宁川,郭学益.生物吸附法处理重金属废水研究进展[J].水处理技术,2009,35(3):13-17.
[9] 胡克伟,贾冬艳,查春梅,等.天然沸石对重金属离子的竞争性吸附研究[J].中国土壤与肥料,2008(3):66-69.
[10]何宏平,郭九皋,朱建喜,等.蒙脱石、高岭石、伊利石对重金属离子吸附容量的实验研究[J].岩石矿物学杂志,200l,20(4):573-578.
[11]邹照华,何素芳,韩彩芸.重金属废水处理技术研究进展[J].水处理技术,2010,6(6):19-20.
[12]孙霞.粉煤灰合成NaA和NaX型分子筛及其对重金属废水的吸附研究[D].南京:南京理工大学,2007.
[13]徐如人,庞文琴,于吉红,等.分子筛与多孔材料化学[M].北京:科学出版社,2004:168-172.
[14]李华伟,郑寿荣,许昭怡,等.13X分子筛去除水中重金属离子的研究[J].离子交换与吸附,2007,32(5):410-411.
[15]E Erden, N Karapinar, R Donat. The removal of heavy metal cations by natural zeolites[J]. Collid and Interface Science, 2004, 280:309-314.
[16]C Kormann,D W Bahnemann, M R Hoffman. Band strengths of fundamentals and overtones of the CF and CH chromophores in CHD2F[J]. Chemical Physics Letters, 1988, 149(8):429-432.
[17]马红梅,朱志良,张荣华,等.弱碱性环氧阴离子交换树脂去除水中铜的动力学研究[J].离子交换与吸附,2006,22(6):519-526.
[18]王学江,张全兴,李爱民,等.NDA-100大孔树脂对水溶液中水杨酸的吸附行为研究[J].环境科学学报,2002,22(5):658-660.
