PF127修饰的石墨烯复合材料的制备及其载药系统研究
2014-03-25张龙姣张阳德申玉璞申玉坤
张龙姣, 张阳德, 申玉璞, 申玉坤, 2
(1.中南大学 卫生计生委肝胆肠外科研究中心, 长沙 410008; 2.长治医学院,山西 长治 046000)
石墨烯是一种集高光学吸收、高强度、极大比表面积、较低生产成本(相对于碳纳米管)等多种优异性质于一体的新型二维碳纳米材料,由sp2碳原子组成,是研究碳材料各种晶体理论计算和推导的基础结构,非常适合于开发高性能的复合材料[1];它凭借纳米尺寸的结构、优异的生物相容性和长的体内循环时间使其在纳米药物载体领域拥有极大的潜能;而氧化石墨烯还能稳定地分散于水中,并且表面经过良好修饰的氧化石墨烯能够稳定存在于高盐溶液和生理条件下,这都归功于氧化石墨烯的表面拥有非常丰富的亲水性官能团,这些特性为其在生物医学领域中的应用奠定了重要基础[2]。普朗尼克PF127是一种两亲性高分子聚氧乙烯-聚氧丙烯-聚氧乙烯三嵌段共聚物,它能对氧化石墨烯上各种亲水性官能团进行共价修饰,从而可获得水溶性良好的功能化石墨烯基底材料;独特的两亲性三嵌段微区结构,使其与石墨烯复合后,结构更加稳定[3]。
目前,全球癌症患者呈现增长的趋势,主要是缺少有效的治疗手段,而化学治疗是治疗肿瘤的重要手段之一[4]。 化疗药物的细胞毒性缺乏选择性,常引起严重不良反应,尽管目前的研究已经取得重大进步,但是化疗的副作用还是很大,我们仍然需要对传统的化疗药物进行改进。于是增强药物的靶向性运输、提高肿瘤选择性毒性是提高化疗效果并降低药物的毒副反应的有效方法,那么选择一个高效的药物运输载体是至关重要的[5]。由于氧化石墨烯具有单原子层结构,其比表面积很大,且两个基面都可以吸附药物,因此非常适合用作药物载体[6, 7]。
阿霉素是一种抗肿瘤抗生素,对多种肿瘤细胞具有杀灭作用,由于其本身存在强烈的细胞毒性,使之无法在临床医学上得到广泛应用[8]。而如将阿霉素负载在胶质载体上经过合成后再进行用药,不仅可以降低其细胞毒性带来的不良反应,还可有效提高药物疗效。
目前,关于功能化石墨烯的研究还主要集中在物理学、化学等领域,而其在生物医学领域的研究还相对较少,如靶向药物输运、生物检测、肿瘤治疗以及石墨烯生物安全性等的研究还处于刚刚起步的阶段[9, 10]。本研究通过对负载阿霉素的PF127修饰的还原态石墨烯复合材料(PF127/GN/DOX)进行药物缓释,细胞吞噬以及细胞毒性方面的研究,发现这种材料质量可靠,性能良好,这为中国发展更为理想的新型智能型纳米药物载体提供了一个新的思路和方法。
1 实验部分
1.1 试剂与仪器
天然鳞片石墨粉(粒径为40~50 μm),纯度 > 99.9%,青岛欧尔石墨有限公司产品;盐酸阿霉素,上海华蓝化学科技有限公司,使用前用三乙醇胺脱盐酸盐;三嵌段共聚物普朗尼克 PF127(WPMF542B),上海BASF公司产品;透析袋,宽度 34 mm,容量3.4 mL/cm,截留分子量8000~14000,国药集团化学试剂有限公司;氧化石墨烯通过 Hummers 自制;水合肼(88%),浓硫酸(95%),双氧水(30%),氨水,高锰酸钾等常规试剂均为分析纯,国药集团化学试剂有限公司产品,使用前未经进一步纯化处理。实验中所有用水均为二次蒸馏水。
水平摇床(北京六一仪器有限公司);SIGMA超速冷冻离心机(德国SIGMA公司);85-2A 控温恒速搅拌器(上海德洋意邦仪器有限公司);JY98-III 超声波细胞粉碎机(宁波新芝生物科技股份有限公司);81-2 型恒温磁力搅拌器(上海司乐仪器厂); PS-100A 超声波清洗器(昆山超声波清洗器有限公司);拉曼光谱仪(英国雷尼绍公司);电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Multimode V 型原子力显微镜(美国Veeco精密仪器有限公司) TCSSP5 激光共聚焦显微镜(德国Leica仪器公司); NanoDrop ND-2000C 紫外-可见分光光度仪(美国Thermo公司)。
1.2 氧化石墨烯(GO)的制备
采用Hummer法制备氧化石墨:移取 200 mL 的浓硫酸,在冰浴条件下放置一段时间使浓硫酸的温度接近冰浴温度,在不断搅拌的情况下慢慢将 5 g 石墨粉加入浓硫酸当中,然后再称取 18 g的高锰酸钾也逐渐加入到浓硫酸中,保持冰浴条件下持续搅拌 3 h 使之混匀。之后,从冰浴中取出在室温条件下继续搅拌反应 5 d,回到冰浴条件下,再次加入 18 g高锰酸钾,持续搅拌 3 h,重复上述步骤1次。量筒量取 46 mL 的水,逐滴缓慢滴加,保持混合物温度不要过高,之后将其放在 90~100℃ 的水浴中,继续搅拌反应 30 min ,从热水浴中取出之后再加入 140 mL 水和 10 mL 30wt% 的双氧水变成亮黄色,混匀之后离心分离,配制质量分数 5% 的盐酸溶液和无水乙醇分别对分离出的产物进行离心清洗至中性,恒温干燥箱 50°C 下烘干即得氧化石墨烯。
1.3 氧化石墨烯的剥离及纯化
取适量干燥后的氧化石墨烯,加入 50 mL 蒸馏水,在冰浴条件下,使用超声粉碎机在 500 W 的功率下对混合物进行超声震荡1 h ,氧化石墨片层剥落,获得棕黄色的分散液,将分散液在 12000 r/min下离心15 min,收集棕黄色上清,将沉淀再次加入蒸馏水,重复上述步骤,最终得到氧化石墨烯水溶液。
将氧化石墨烯水溶液加入适量蒸馏水后以截留分子量为 8000~14000 的透析袋透析 2 d,获得滤液即为纯化后的氧化石墨烯分散液。此时的石墨烯尺寸较小且分散完全。
1.4 PF127 修饰还原态石墨烯(PF127/GN)的制备
取 500 mg PF127,加入到石墨烯分散液中,超声使其分散均匀,磁力搅拌30 min,然后边搅拌边向混合物中加入500 μL的水合肼和2 μL的氨水溶液,保持温度在90℃的条件下进行回流反应24 h,进行透析操作48 h,然后,将透析液在12000 r/min下离心15 min,去除沉淀,该沉淀物一般为未被PF127修饰的还原态石墨烯,获得黑色半透明的离心液,最后得到的黑色上清液即为石墨烯稳定分散液,确定浓度后密封保存备用。
1.5 阿霉素(DOX)对PF127修饰的石墨烯复合材料(PF127/GN)的负载
阿霉素的负载是通过将阿霉素溶液和纳米载体PF127/GN简单的混合实现。为了更为严谨的分析阿霉素在PF127/GN上的负载效果,我们采用不同浓度的阿霉素溶液对PF127/GN进行混合。本实验将阿霉素溶液的浓度分别定量为:0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL和1.0 mg/mL 。具体操作步骤如下:首先,取不同浓度的阿霉素溶液缓慢滴入称有石墨烯分散液(15 mL,0.05 mg/mL)的烧瓶中,均匀搅拌 24 h,搅拌过程中注意避免阳光直射。反应完成后,将烧杯中的合成液在 12000 r/min条件下离心1 h ,将沉淀物去除,取得负载了阿霉素的石墨烯分散液,记为PF127/GN/DOX,利用紫外-可见分光光度计可计算出负载在合成液上的阿霉素量。计算公式如下:
PF127/GN/DOX上的阿霉素量=初始加入的阿霉素含量-上层清液中阿霉素含量
其中,上层清液中阿霉素的含量可通过使用紫外-可见分光光度计测量离心后上层清液在480 nm紫外吸收峰的吸光度,然后对照阿霉素标准浓度曲线后计算获得。
1.6 不同pH值生理缓冲液条件下 PF127/GN/DOX 中阿霉素的药物释放实验
将3种不同pH值的缓冲液放入烧杯中,取PF127/GN/DOX(2 mL,1 mg/mL) 作为样品分别装入3个透析袋中,然后分别放入3个烧杯中,将烧杯放在摇床中,在转速为180 r/min,37℃的条件下恒温震荡进行药物的体外释放考察。在此过程中,定时量取 5 mL 烧杯中的溶液测量药物释放量,注意每次取出溶液后应在烧杯中相应补充 5 mL 的新鲜介质以使杯中总体积保持不变,待释药一段时间后,即可利用UV-Vis分光光度计和药物标准浓度计算出阿霉素的释放量。
1.7 MTT法检测负载阿霉素的 PF127/GN/DOX 与 PF127/GN 的细胞毒性
取乳腺癌细胞 ZR-75-30以5×103cells/well 的密度均匀接种到96孔板内,使用每孔 2000 μL 的细胞培养基DMEM, 于37°C,5%CO2培养箱中培养 24 h 至细胞融合度达 80%~90% 后,去除孔板中的DMEM,将含有不同浓度 PF127/GN/DOX 与 PF127/GN 样品的细胞培养基分别放在孔板中,每孔中加入 200 μL 培养液,分别在 37°C、5 % CO2条件下处理细胞 24 h。吸弃原培养液, 倒置相差显微镜下观察细胞形态。各孔用 DPBS 小心清洗 1 遍, 加入DMEM 培养液 200 μL, 再加入 5 g/LMTT 溶液 10 μL, 继续培养 4 h 后中止培养, 小心吸去孔内培养液,每孔加入 100 μL 二甲基亚砜, 置摇床上低速振荡10 min。同时设置对照组(即无药物处理的细胞)在酶标仪OD值 570 nm处测量各孔的吸光值。利用反向相差显微镜拍照获得乳腺癌细胞的形貌变化。利用SPSS17.0版本软件进行统计分析。群组间的差异通过方差分析试验进行评估,检验水准为0.05。按下式计算细胞存活率:
细胞相对增殖率(%) = 实验组平均OD值/对照组OD均值×100%
细胞相对增殖率( RGR) 计算及细胞毒性评价标准参考ISO2109932-5细胞毒性试验采用5分制法进行细胞毒性分级[11](见表1)。
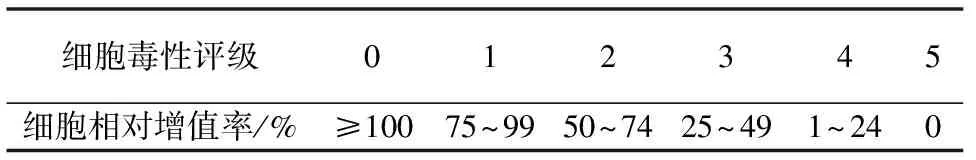
表1 材料毒性等级评价
1.8 PF127/GN 对 DOX 的细胞递送行为实验
先将乳腺癌细胞 ZR-75-30 以 1×105cells/well的密度接种在激光共聚焦显微镜专用培养板内,每孔加入 1 mL DMEM 培养基,在 37°C 恒温条件下培养。 24 h 后,将浓度为 1 mg/mL 的 PF127/GN/DOX 溶液加入培养板中,每孔加入 1 mL,与 ZR-75-30 细胞共同培养 6 h。6 h 后,用PBS缓冲液冲洗7次,再向培养板内加入新的 1 mL 的DMEM培养基,以备观察。
2 结果与讨论
2.1 PF127 修饰还原态石墨烯后形貌与尺寸分析
我们对氧化石墨烯以及 PF127 功能化修饰的石墨烯进行了原子力显微镜(AFM)表征,分别从两种材料的微观形貌和尺寸大小进行分析。随机选择区域扫描AFM,图像显示(图1),经过PF127修饰的还原氧化石墨烯粒子与未经修饰的GO相比,尺寸变化不大,分布相对均匀,该结果证明实验中延长氧化时间及增大氧化剂用量等方法的使用可有效减小GO尺寸。单纯的氧化石墨烯粒子厚度约为0.7~0.8 nm左右,PF127/GN的粒子厚度大约为 9.646 nm,因此我们认为,GO本身为单层,修饰后所增加的厚度为PF127在还原态氧化石墨烯表面包裹所增加的厚度,并没有对石墨烯层数产生影响。
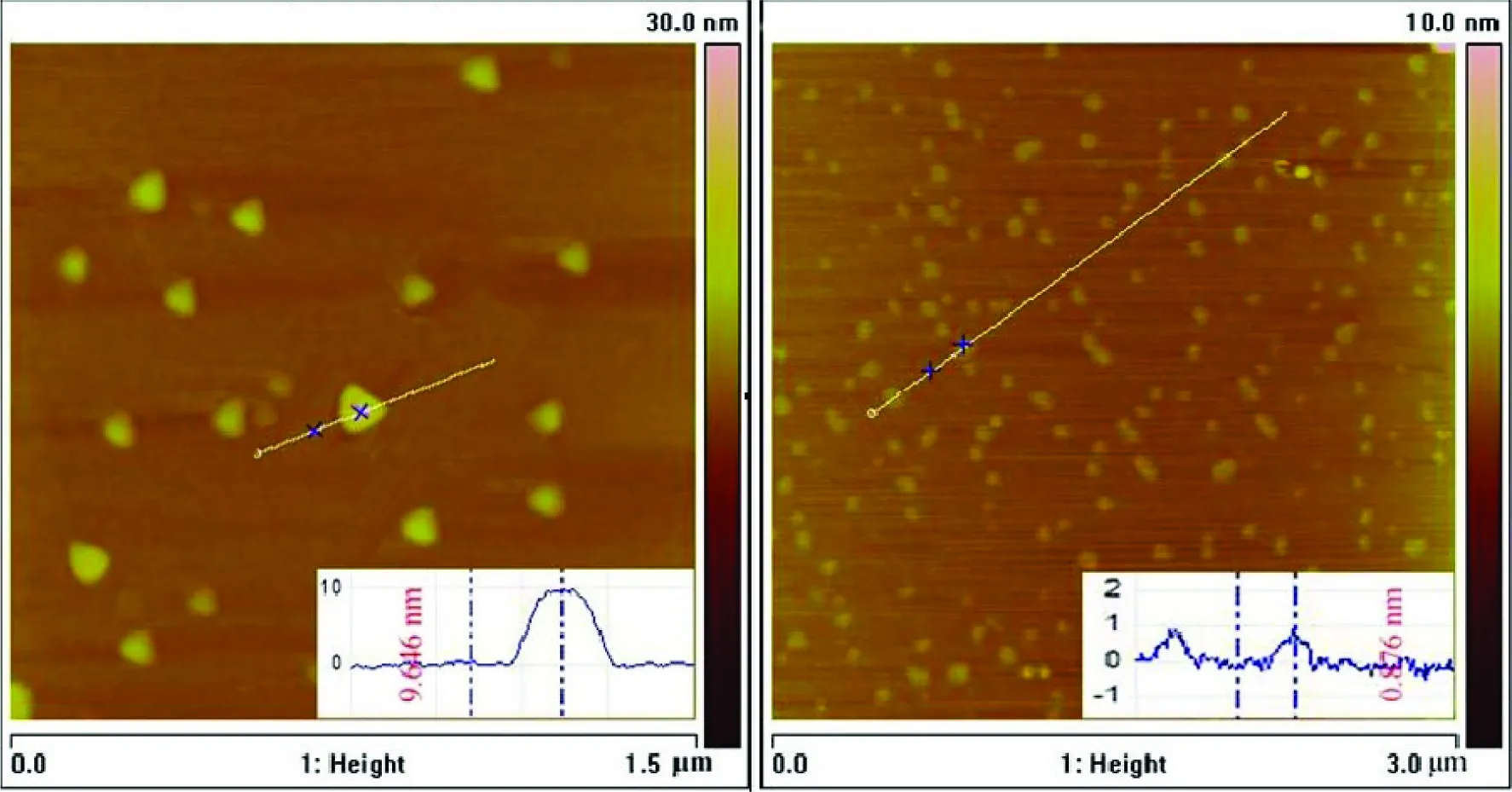
图1 PF127/GN(左) 和 GO(右) 的 AFM 图像

图 2 氧化石墨烯的透射电镜图
图2是氧化石墨烯的透射电镜图。从图2中可以看出,剥离后的氧化石墨烯薄片衬度不同,大小不均一,片层不规则。光能部分透过它的片层,说明氧化石墨烯在厚度方向上很薄,但片层各部分衬度不同,导致透光性不尽相同,颜色浅的部分透光性好,表明此处较薄;颜色深的部分透光性较差,说明此处片层较厚;这表明制得的氧化石墨烯不全是单片层结构,有些是几个片层的叠加。
2.2 PF127/GN 对阿霉素的药物负载研究
将阿霉素作为药物模型分析阿霉素在PF127/GN上的负载效果,结果发现,在阿霉素浓度达到1 mg/mL 时, PF127/GN 的药物载药率达到 290%,(如图3所示),PF127/GN上阿霉素的载药率随初始阿霉素浓度的升高而呈线性增长。研究表明, PF127/GN 纳米载体与传统纳米药物载体相比,对阿霉素药物的负载率更为理想。这主要是因为石墨烯巨大的比表面积为阿霉素的负载提供了良好的基础,因此,可通过调节阿霉素在 PF127/GN 中的含量来适度安排有效载药率。
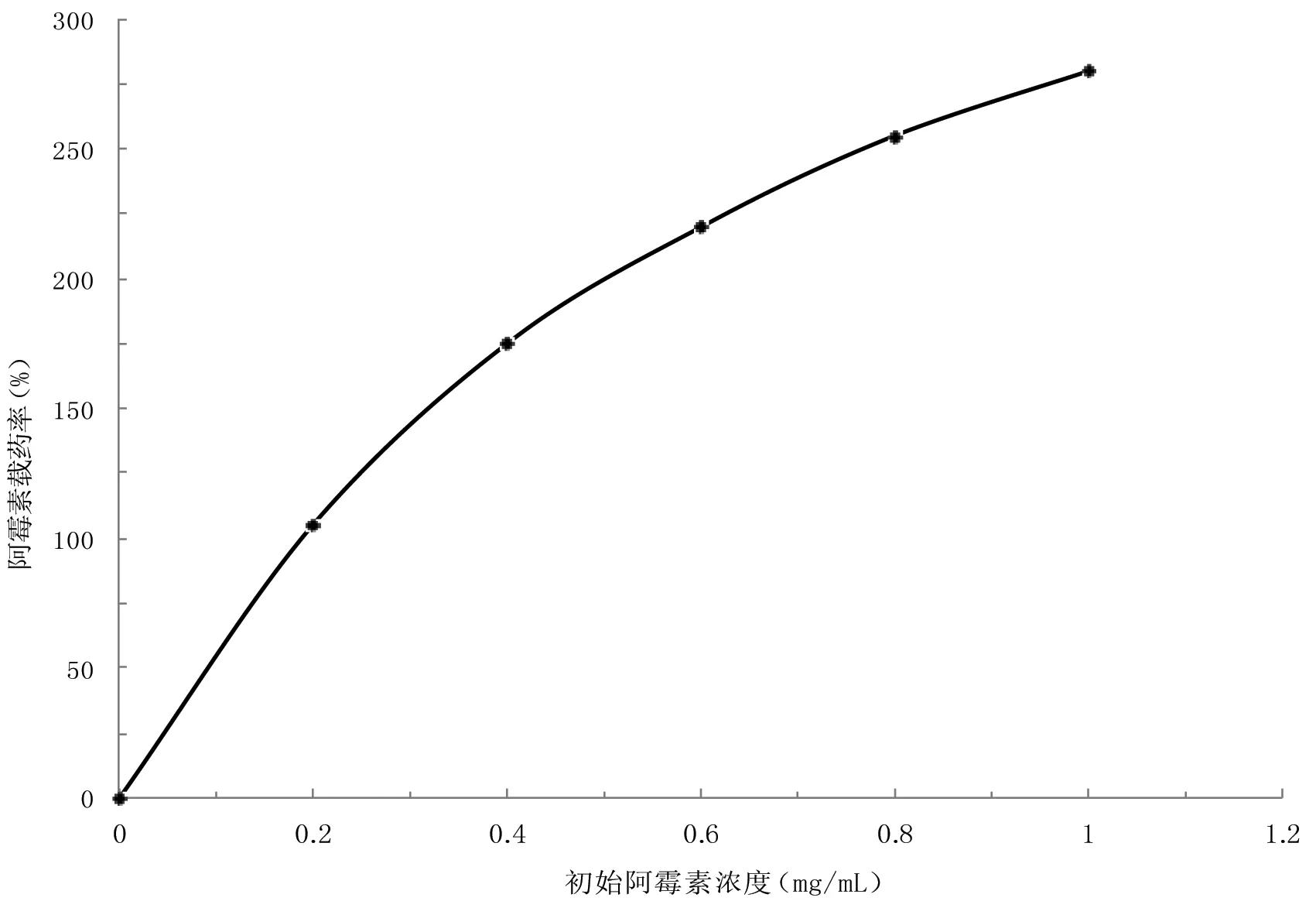
图3 负载了DOX 的PF127/GN的载药率曲线
2.3 PF127/GN/DOX的药物释放研究
我们对PF127/GN上的阿霉素在3种pH值的释放介质中的释放过程进行了观察,图4是3种pH值的释放介质中的释放曲线。结果图像显示,当pH值>6.5或者pH值<6.5时,阿霉素的释放速率1~7 h间释放迅速,而7 h后逐渐平缓并停止增加,释放量分别为24%和57%。而当pH值为6.5时,6 h后阿霉素的释放速率达到 15% 后基本不再变化,这说明阿霉素在中性介质中的释放能力不如在碱性或者酸性下强。这是因为阿霉素与石墨烯间的作用力大小受外界pH值环境的影响,这种作用力在中性条件下比偏酸性或偏碱性下弱,而在酸性条件下,该作用力比在碱性下弱,所以酸性环境中会释放更多阿霉素。这种对pH值的敏感性对肿瘤细胞的消灭具有重要作用。

图4 3种pH值条件下的药物释放曲线
2.4 PF127/GN/DOX 的细胞毒性研究
采用乳腺癌细胞 ZR-75-30 作为模型来对负载阿霉素的PF127/GN/DOX与未负载阿霉素的PF127/GN的细胞毒性进行分析比较(如表2),结果显示,当PF127/GN/DOX的浓度分别为63 μg/mL、250 μg/mL、500 μg/mL和1000 μg/mL时,其细胞相对增殖率分别为49%、38%、26%和21%,细胞毒性分级均为3-4级,相比较下,PF127/GN在这4种浓度下的细胞相对增值率则分别高达94%、87%、81%和76%,细胞毒性分级均为1级。
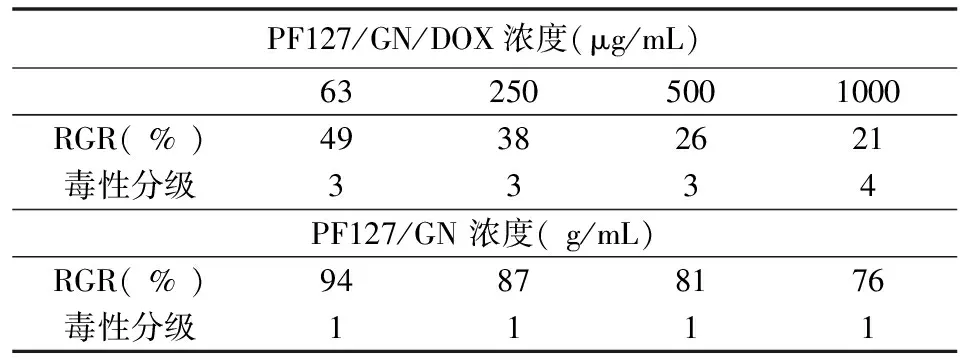
表2 MTT法和细胞毒性分级结果
2.5 PF127/GN/DOX 的细胞递送研究
纳米载体 PF127/GN可将阿霉素药物输送到细胞内,该递送过程在通过激光共聚焦显微镜(激发波长为 240 nm)拍摄到的细胞的荧光照片中得到证实。
以乳腺癌细胞 ZR-75-30 作为模型来观察负载阿霉素的PF127/GN/DOX 的细胞吞噬过程,结果如图5所示。首先在共聚焦显微镜下,阿霉素细胞有明显红色荧光(c),然后我们将乳腺癌细胞 ZR-75-30 细胞核用DAPI复染,可以在显微镜下可看到细胞核具有绿色荧光(b),最后,我们看到红色荧光与绿色荧光重叠了的ZR-75-30 的细胞核(d),这说明负载在PF127/GN上的阿霉素进入了ZR-75-30细胞的细胞核。
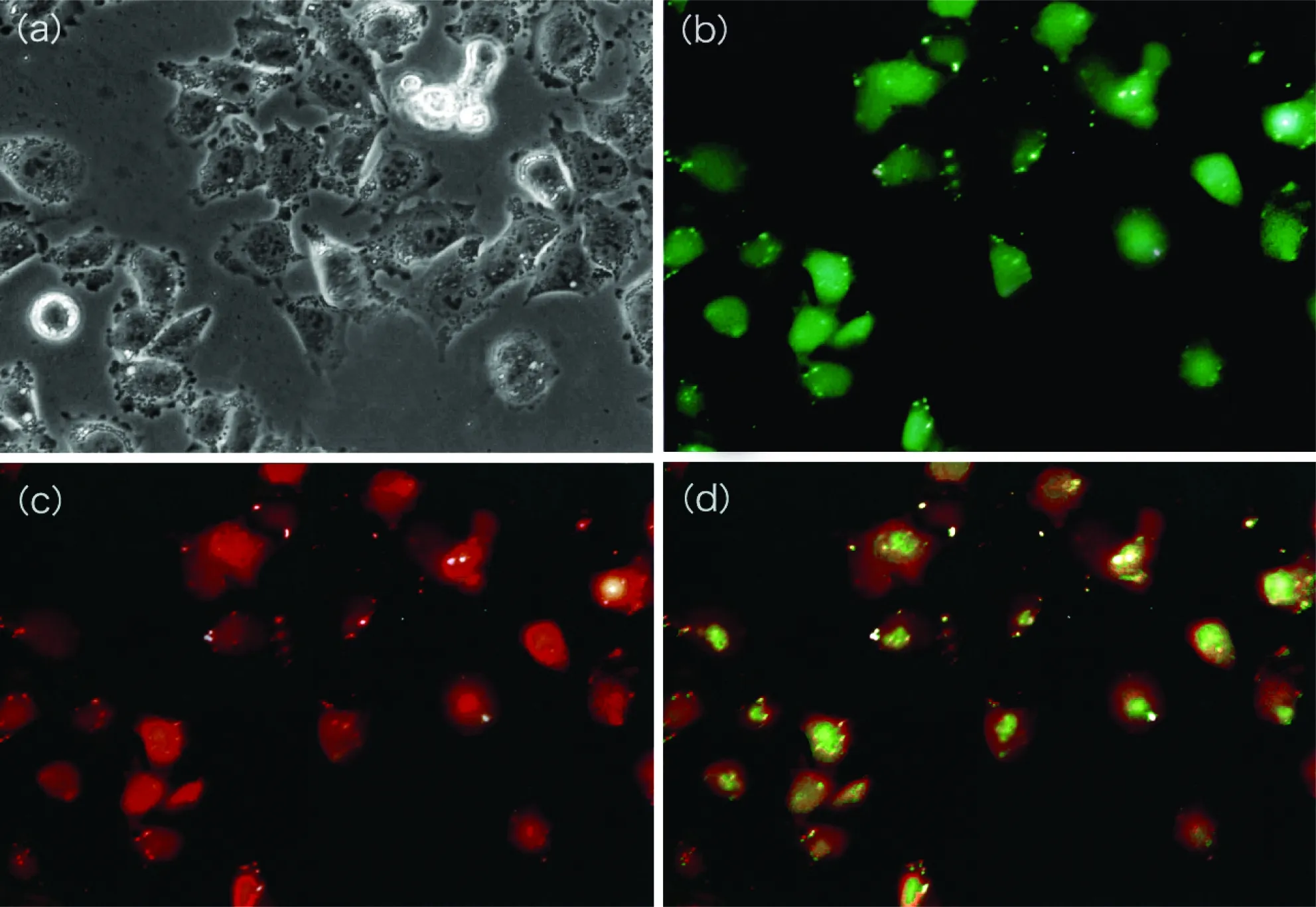
图5 PF127/GN/DOX对ZR-75-30的激光共聚焦图像
3 小结
这种新型的纳米载药体系的载药量高达290%,拥有较高的生物利用率。同时,在引入了阿霉素后,该纳米载药体系具有了pH值敏感性和细胞毒性。本文研究了其在37°C时不同pH环境下的释药行为,发现药物释放速度在pH为酸性时较快,而在碱性和中性时较慢,这有助于对酸性肿瘤组织部位的释放。该纳米药物复合材料为中国发展一类新型的纳米载药体系提供了一个新的思路和方法,具有广阔的应用前景[12,13]。
参考文献:
[1]Wang C, Cheng L, Liu Z, et, al. Drug delivery with upconversion nanoparticles formulti-functional targeted cancer cell imaging and therapy[J]. Biomaterials, 2011, 32: 1110-1120.
[2]Chang Y L, Yang S T, Liu J H, et. al. In vitro toxicity evaluation of graphene oxide onA549 cells[J]. Toxicology Letters, 2011, 200: 201-210.
[3]Yang X Y, Zhang X Y, Liu Z F, et, al. High-efficiency loading and controlled release of doxorubicin hydrochloride on graphene oxide[J]. Journal of Physical Chemistry C, 2008, 112: 17554-17558.
[4]Pan Y Z, Bao H Q, Sahoo N G, et al. Water-soluble poly( N-isopropylacrylamide) graphene sheets synthesized via click chemistry for drug delivery [J]. Adv Funct Mater, 2011, 21: 2754-2763.
[5]Bao H, Pan Y, Ping Y, et al. Chitosan-functionalized graphene oxide as a nanocarrier for drug and gene delivery [J]. Small, 2011(7): 1569-1578.
[6]Feng L Z, Liu Z A. The ex vivo and in vivo biological performances of graphene oxide and the impact of surfactant on graphene oxide′s biocompatibility[J]. Nanomedicine, 2011(6): 317-324.
[7]Burdick J A, Prestwich G D. Hyaluronic acid hydrogels for biomedical applications [J]. Adv Mater, 2011, 23: 41-56.
[8]Lee J H, Yigit M V, Mazumdar D, et, al. Doxorubicin hydrochloride on graphene-nanomaterial conjugates[J]. Advanced Drug Delivery Reviews, 2010, 62:592-605.
[9]Brewer E, Coleman J, Lowman A. Emerging technologies of polymeric nanoparticles in cancer drug delivery[J]. Journal of Nanomaterials, 2011, doi:10.1155/2011/408675.
[10]黄 毅, 陈永胜. 石墨烯的功能化及其相关应用 [J]. 中国科学B辑: 化学, 2009,39(9): 887-896.
[11]薛月珍, 邵红芳, 朱佩英,等. MTT法检测卵巢癌化疗敏感性[J]. 上海第二医科大学学报, 2005, 25(8): 847-849.
[12]李志花, 陈汝福. 半乳糖化阿霉素白蛋白纳米粒的制备及其质量评价[J]. 岭南现代临床外科, 2005(7): 141-144.
[13]张阳德. 磁性阿霉素白蛋白纳米粒[J]. 中国现代医学杂志,2001,11(3):141-145.
