刺松藻内生真菌长枝木霉的化学成分研究
2014-03-25纪珍玲马德顺苗凤萍
纪珍玲, 马德顺, 苗凤萍
(1. 沈阳大学 生命科学与工程学院, 辽宁 沈阳 110044;2. 中国科学院 烟台海岸带研究所, 山东 烟台 264003)
木霉(Trichodermaspp.)是自然界中分布较为广泛的真菌类群,具有重要的生防作用,并且表现出丰富的次生代谢产物结构类型,包括萜类、甾体、聚酮和生物碱等[1].海洋环境来源的木霉也具有丰富的次生代谢产物,近年来对来源不同海洋环境(沉积物、海鞘、海绵、海藻等)的棘孢木霉(T.asperellum)、绿木霉(T.virens)、深绿木霉(T.atroviride)、康氏木霉(T.koningii)、长枝木霉(T.longibrachiatum)、里氏木霉(T.reesei)等的研究中获得了一系列活性新结构,包括trichodermatides、trichodermaketones、trichoder-ins、sorbicillinoids、bisorbicillinoids、peptaibols、二肽、环肽、蒽醌和xanthone衍生物等[2-6],并且部分产物表现出一定的结构特异性,例如卤代等.本研究组从海洋绿藻刺松藻(Codiumfragile)的一株内生长枝木霉(T.longibrachiatum)的马铃薯-葡萄糖液体培养基(PDB)发酵产物中分离鉴定了一种罕见的harziane二萜(6)[7]3815.以菊芋-葡萄糖液体培养(JDB)基再次发酵,也获得了化合物6.对两种培养基发酵剩余产物的研究中,继续分离鉴定了5种化合物1~5,其中化合物4和5均为首次从木霉中分离得到.
1 材料与方法
1.1 菌种与培养
长枝木霉(T.longibrachiatumcf-11)是由本实验室分离自烟台近岸采集的海洋绿藻刺松藻(C.fragile)的内生丝状真菌,该真菌是经形态学和克隆真菌核糖体rDNA基因ITS分子序列分析进行鉴定的,保存在中国科学院烟台海岸带研究所生物资源实验室和中国典型培养物保藏中心(保藏号为CCTCCM2012141).
菌种分别以PDB培养基(葡萄糖20 g,酵母膏3 g,蛋白胨5 g,马铃薯浸汁200 mL(200 g马铃薯煮汁),陈海水500 mL,蒸馏水300 mL,琼脂15 g,pH=6.5~7.0)和JDB(每升含菊芋块茎煮汁500 mL,葡萄糖10 g,硝酸钠2 g,陈海水500 mL;pH =7.0)发酵.1 000 mL三角烧瓶中装液体培养基300 mL,121 ℃灭菌20 min后接种.两种培养基分别接种15 L PDB和30 L JDB,自然光下,室温静置培养30 d.
1.2 仪器与试剂
Bruker Avance Ⅲ 500型核磁共振(NMR)仪;EYELA N-1001旋转蒸发仪;Agilent 1260 infinity 高效液相色谱(HPLC)仪(Eclipse SB-C18 柱,9.4×250 mm,5 μm);GF254薄层色谱硅胶;100~200目和200~300目柱色谱硅胶;Sephadex LH-20葡聚糖凝胶;显色剂为茴香醛-硫酸溶液;提取、柱色谱和薄层色谱有机溶剂均为分析纯;HPLC流动相为Pall超纯水和色谱纯甲醇.
1.3 次生代谢产物提取、分离与鉴定
将自然光下室温静置培养30 d的菌丝体,用乙酸乙酯杀菌2 d后,过滤出菌丝体,收集发酵液.菌丝体干燥并粉碎后用V(氯仿)∶V(甲醇)=1∶1的溶液提取3次,再用乙酸乙酯萃取,减压浓缩为菌丝体提取物;发酵液经乙酸乙酯萃取,减压浓缩后得发酵液提取物,合并两部分提取物为总浸膏.总浸膏经硅胶柱层析,以V(石油醚)∶V(乙酸乙酯)为0∶100至100∶0梯度的溶液洗脱,收集各组分,再经反复硅胶柱层析、Sephadex LH-20柱层析、反相硅胶柱层析、制备薄层层析、半制备HPLC分离、重结晶,分离纯化得到单体化合物.综合运用现代波谱技术(IR、UV、EI-MS、FAB-MS、HR-ESI-MS、1H-NMR、13C-NMR、DEPT、1H-1H COSY、HMQC、HMBC)、化学方法及已报道的文献确定各单体化合物的结构.
1.4 抑菌活性检测
利用滤纸片进行抗菌活性检测[8],将化合物1~5用DMSO进行溶解,配成的终浓度为30 μg/片,静置30 min,使有机溶剂完全挥发.在培养平板中分别加入1 mL金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、苹果炭疽菌(Colletotrichumgloeos-porioides)和西瓜枯萎病菌(Fusariumoxysporumf.sp.niveum)的菌悬液,然后将加油样品的滤纸片贴在带菌平板上,置于37 ℃静置培养,细菌培养24 h,真菌培养48 h.测量抑菌圈大小,每个样品做三个平行样,取平均值.
2 结 果
2.1 提取、分离与鉴定
JDB发酵产物的菌丝体提取物为18.5 g,发酵液提取物为20.2 g.两部分提取物经薄层层析(TLC)检测结果类似,合并得总浸膏(38.7 g).总浸膏经硅胶柱层析,以V(石油醚)∶V(乙酸乙酯)为0∶100至100∶0梯度的溶液洗脱,TLC检测合并后得8个组分(Ⅰ~Ⅷ).组分Ⅲ经Sephadex LH-20柱(V(氯仿)∶V(甲醇)=1∶1)和制备薄层(V(石油醚)∶V(乙酸乙酯)=2∶1)层析,得化合物3(4.2 mg);组分Ⅳ经硅胶柱(V(石油醚)∶V(乙酸乙酯)=2∶1)和Sephadex LH-20柱(V(氯仿)∶V(甲醇)=1∶1)层析,再经HPLC(甲醇)纯化,得化合物1(12.3 mg);组分Ⅴ经硅胶柱(V(石油醚)∶V(乙酸乙酯)=10∶1)和Sephadex LH-20柱(V(氯仿)∶V(甲醇)=1∶1)层析,以及HPLC(V(甲醇)∶V(水)溶液由30%~100%梯度)纯化,得化合物4(19.0 mg);组分Ⅵ经Sephadex LH-20柱(V(氯仿)∶V(甲醇)=1∶1)和制备薄层(乙酸乙酯)层析,得化合物2(10.4 mg).
PDB培养基发酵产物的菌丝体提取物为9.2 g,发酵液提取物为13.7 g,将其合并最后得到总浸膏22.9 g.将总浸膏通过硅胶柱层析进行了洗脱,然后再用制备薄层TLC检测,最后合并得到Ⅶ个组分.将总浸膏经硅胶柱层析,以V(石油醚)∶V(乙酸乙酯)为0∶100至100∶0梯度的溶液洗脱后得5个小组分(Ⅰ~Ⅵ).组分Ⅰ经Sephadex LH-20柱(V(氯仿)∶V(甲醇)=1∶1)层析后,再经HPLC(体积分数85%甲醇)纯化,得化合物5(1.8 mg);组分Ⅵ经甲醇重结晶,得化合物1(11.5 mg).
两种培养基发酵的长枝木霉次生代谢产物中共分离获得6个化合物,其结构式见图1.
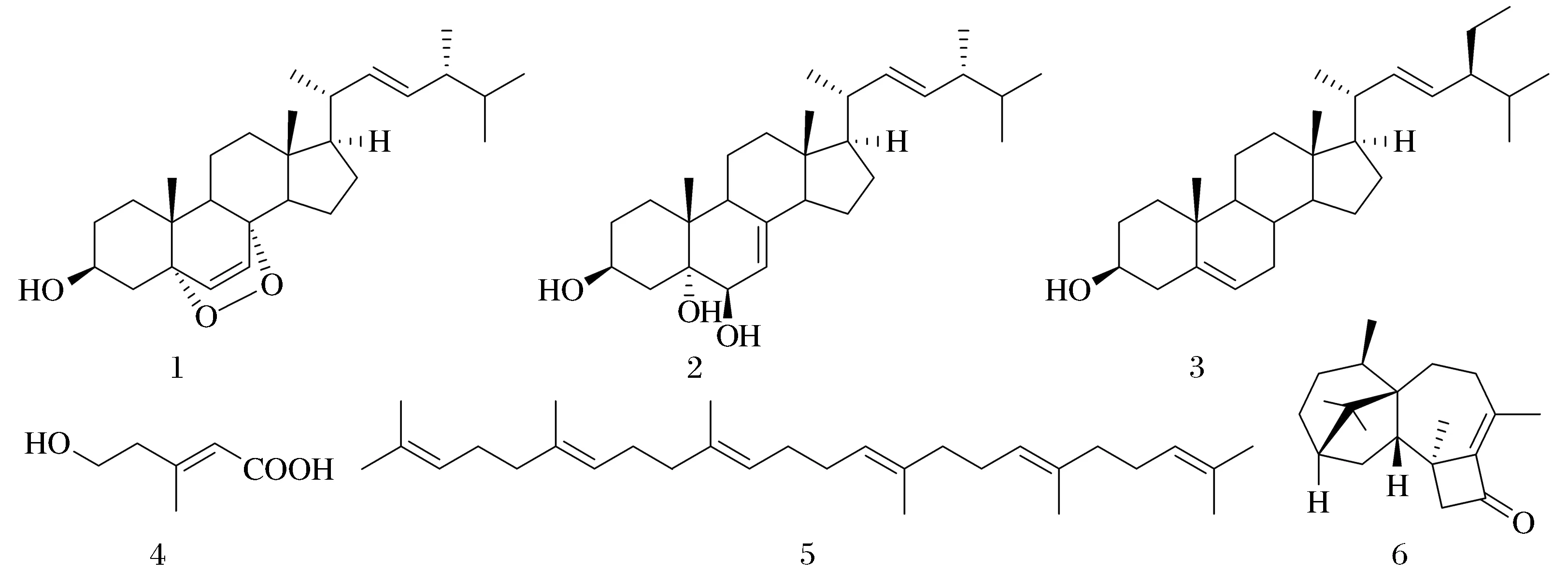
图1 化合物1~6的结构Fig.1 Structures of compounds 1~6
2.2 化合物结构鉴定
化合物1:无色晶体;1H-NMR (500 MHz,CDCl3)δ6.50(1H,d,J=8.5 Hz,H-6),6.24(1H,d,J=8.5 Hz,H-7),5.22(1H,dd,J=15.2,7.5 Hz,H-23),5.14(1H,dd,J=15.3,8.3 Hz,H-22),3.97(1 H,m,H-3),1.00(3H,d,J=6.5 Hz,H-21),0.91(3H,d,J=6.8 Hz,H-28),0.88(3H,s,H-19),0.83(3H,d,J=6.6 Hz,H-27),0.82(3H,d,J=6.5 Hz,H-26),0.81(3H,s,H-18);13C-NMR(125 MHz,CDCl3)δ135.4(C-6),135.2(C-22),132.3(C-23),130.1(C-7),82.2(C-5),79.4(C-8),66.5(C-3),56.2(C-17),51.7(C-14),51.1(C-9),44.6(C-13),42.8(C-24),39.7(C-20),39.3(C-4),37.0(C-12),36.9(C-10),34.7(C-1),33.1(C-25),30.1(C-2),28.7(C-16),23.4(C-15),20.9(C-21),20.6(C-11),20.0(C-27),19.6(C-26),18.2(C-19),17.6(C-28),12.9(C-18).以上波谱数据与文献报道的5α,8α-环氧麦角甾-6,22-二烯-3β-醇一致[9],鉴定其为5α,8α-环氧麦角甾-6,22-二烯-3β-醇(过氧化麦角甾醇).
化合物2:无色晶体;1H-NMR(500 MHz,DMSO-d6)δ5.23(1H,dd,J=15.3,7.2 Hz,H-23),5.17(1H,dd,J=15.2,8.1 Hz,H-22),5.08(1H,m,H-7),3.77(1H,dt,J=16.1,5.6 Hz,H-3),3.59(1H,s,H-6),1.00(3H,d,J=6.5 Hz,H-21),0.92(3H,d,J=6.8 Hz,H-28),0.91(3H,s,H-19),0.84(3H,d,J=7.2 Hz,H-27),0.82(3H,d,J=7.2 Hz,H-26),0.55(3H,s,H-18);13C-NMR(125 MHz,DMSO-d6)δ140.1(C-8),135.9(C-22),131.9(C-23),120.0(C-7),75.0(C-5),72.6(C-6),66.4(C-3),55.8(C-17),54.6(C-14),43.5(C-13),42.7(C-9),42.5(C-24),40.4(C-4),40.2(C-20),39.5(C-12),37.1(C-10),32.9(C-25),31.7(C-1),28.2(C-16),23.1(C-15),21.8(C-11),21.5(C-21),20.2(C-26),19.9(C-27),18.2(C-19),17.8(C-28),12.5(C-18).以上波谱数据与文献报道的麦-7,22-二烯-3β,5α,6β-三醇数据一致[10],鉴定其为麦角-7,22-二烯-3β,5α,6β-三醇(啤酒甾醇).
化合物3:无色晶体;1H-NMR(500 MHz,CDCl3)δ5.35(1H,d,J= 5.1 Hz,H-6),3.53(1H,ddd,J=17.0,11.6,5.1 Hz,H-3),1.01(3H,s,H-19),0.92(3H,d,J=6.6 Hz,H-21),0.87(3H,m,H-29),0.83(3H,d,J=6.8 Hz,H-26),0.81(3H,d,J=6.9 Hz,H-27),0.68(3H,s,H-18);13C-NMR(125 MHz,CDCl3)δ37.3(C-1),31.7(C-2),71.8(C-3),42.3(C-4),140.8(C-5),121.7(C-6),31.9(C-7),31.9(C-8),50.1(C-9),36.5(C-10),21.1(C-11),39.8(C-12),42.3(C-13),56.7(C-14),24.3(C-15),28.2(C-16),56.1(C-17),12.0(C-18),19.4(C-19),36.1(C-20),18.8(C-21),33.9(C-22),26.1(C-23),45.8(C-24),29.1(C-25),19.8(C-26),19.0(C-27),23.1(C-28),11.9(C-29).以上波谱数据与文献报道的β-谷甾醇数据一致[11],鉴定其为β-谷甾醇.
化合物4:无色油状;1H-NMR(500 MHz,CD3OD)δ5.72(1H,s,H-2),3.71(2H,t,J=6.5 Hz,H-5),2.37(2H,t,J=6.5 Hz,H-4),2.16(3H,d,J=0.8 Hz,H-6);13C-NMR(125 MHz,CD3OD)δ168.9(C-1),156.5(C-3),117.2(C-2),59.3(C-5),43.3(C-4),17.5(C-6).以上谱学数据与文献报道的5-羟基-3-甲基戊-2-烯酸一致[12],鉴定其为5-羟基-3-甲基戊-2-烯酸.
化合物5:无色油状;1H-NMR(500 MHz,CDCl3)δ5.15-5.08(6H,m,H-3,7,11,14,18,22),2.10-1.96(20H,m,H-4,5,8,9,12,13,16,17,20,21),1.68(6H,d,J=1.0 Hz,H-1,24),1.59(18H,s,H-2′,6′,10′,15′,19′,23′);13C-NMR(125 MHz,CDCl3)δ135.1(C-10,15),134.8(C-6,19),131.1(C-2,23),124.4(C-3,22),124.4(C-7,11,14,18),39.8(C-5,6,16,20),28.3(C-12,13),26.8(C-4,21),26.8(C-8,17),25.6(C-2′,23′),17.6(C-1,24),16.0(C-6′,10′,15′,19′).以上波谱数据与文献报道的角鲨烯数据一致[13],故化合物5鉴定为角鲨烯.
2.3 化合物抑菌活性
抑菌活性筛选表明化合物1~5对金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)、苹果炭疽菌(C.gloeosporioides)和西瓜枯萎病菌(F.oxysporumf.sp.niveum)均无明显抑制作用.
3 讨 论
海洋微生物具有独特的代谢途径,研究者从其代谢产物中发现了多种结构新颖并且表现出抗菌、抗氧化、抗肿瘤、诱导细胞凋亡等生物活性的化合物,其种类资源丰富,具有广阔的应用前景及研究价值.海洋藻栖真菌是一类具有丰富次生代谢途径的海洋真菌类群,但藻栖木霉的研究工作相对较少.Garo等在对一株藻栖绿木霉的研究中发现了一个具有显著细胞毒活性的氯代二肽,并且氯代对活性具有重要的贡献[4]423;厦门大学的杜希萍等对一株藻栖木霉(PT2)的研究中获得了一个新的倍半萜糖苷类结构trichodermoside,具有弱的细胞毒活性[14].本研究利用两种培养基(PDB和JDB)分别对海洋绿藻刺松藻的一株内生长枝木霉(T.longibrachiatumcf-11)进行发酵,并对其次生代谢产物进行分离纯化,从中分离得到5个化合物(1~5),并且5-羟基-3-甲基戊-2-烯酸和角鲨烯均为首次从木霉中分离得到,该研究丰富了海洋藻栖木霉次生代谢产物的结构类型和这两个化合物的来源.过氧化麦角甾醇(1)和二萜harzianone(6)从PDB和JDB培养基发酵产物中均有发现[7]3815,表明其代谢生产对培养基种类的依赖性不强,但化合物2、4和5仅在一种培养基中发现,其代谢生产可能对培养基具有依赖性.同时这也说明不同的营养成分对该长枝木霉的次级代谢具有不同的影响,从而导致产生了不同的代谢产物.下一步研究可考虑通过改变不同的培养基和培养条件来诱导产生不同的次生代谢产物,以期获得具有较好抑菌活性的化合物,为新型抑菌剂的开发与应用研究提供参考.β-谷甾醇曾经由本研究组从菊芋块茎的乙醇提取物中分离得到[15],并且从PDB培养基发酵产物中未获得此结构,故推测其可能来源于JDB培养基.此外,化合物1~5无抗细菌活性,进一步表明化合物6可能是关键的抗细菌活性成分[7]3816.
参考文献:
[ 1 ]Reino J L, Guerrero R F, Hernndez-Galn R, et al. Secondary Metabolites from Species of the Biocontrol AgentTrichoderma[J]. Phytochemistry Reviews, 2008,7(1):89-123.
[ 2 ]Sun Y, Tian L, Huang J, et al. Trichodermatides A-D, Novel Polyketides from the Marine-Derived FungusTrichodermareesei[J]. Organic Letters, 2008,10(3):393-396.
[ 3 ]Song F, Dai H, Tong Y, et al. Trichodermaketones A-D and 7-O-methylkoninginin D from the Marine FungusTrichodermakoningii[J]. Journal of Natural Products, 2010,73(5):806-810.
[ 4 ]Garo E,Starks C M, Jensen R R,et al. Trichodermamides A and B, Cytotoxic Modified Dipeptides from the Marine-Derived FungusTrichodermavirens[J]. Journal of Natural Products, 2003,66(3):423-426.
[ 5 ]Pruksakorn P, Arai M, Kotoku N,et al. Trichoderins, Novel Aminolipopeptides from a Marine Sponge-DerivedTrichodermasp., are Active against Dormant Mycobacteria[J]. Bioorganic & Medicinal Chemistry Letters, 2010,20(12):3658-3663.
[ 6 ]Du L, Zhu T, Li L, et al.Cytotoxic Sorbicillinoids and Bisorbicillinoids from a Marine-Derived FungusTrichodermasp[J]. Chemical & Pharmaceutical Bulletin, 2009,57(2):220-223.
[ 7 ]Miao F P, Liang X R, Yin X L, et al. Absolute Configurations of Unique Harziane Diterpenes fromTrichodermaspecies[J]. Organic Letters, 2012,14(15):3815-3817.
[ 8 ]Schulz B, Sucker J, Aust H J, et al. Biologically Active Secondary Metabolites of Endophytic Pezicula Species [J]. Mycological Research, 1995, 99(8):1007-1015.
[ 9 ]Khan S, Kazmi M H, Ahmed E, et al. Phytochemical Studies onSorbuscashmiriana[J]. Journal of the Chemical Society of Pakistan, 2013,35(1):130-134.
[10]李冬利,李晓明,崔传明,等. 鸭毛藻内生真菌Hypocrealessp.的化学成分研究[J]. 海洋科学, 2008,32(11):51-55.
(Li Dongli, Li Xiaoming, Cui Chuanming, et al. Chemical Constituents of Hypocreales sp., an Endophytic Fungus Derived from the Red AlgaSymphyocladialatiuscula[J]. Marine Sciences, 2008,32(11):51-55.)
[11]Zhang X, Geoffroy P, Miesch M, et al. Gram-Scale Chromatographic Purification ofβ-sitosterol: Synthesis and Characterization ofβ-sitosterol Oxides[J]. Steroids, 2005,70(13): 886-895.
[12]Xu J, AlyA H, Wray V, et al. Polyketide Derivatives of Endophytic Fungus Pestalotiopsis sp. Isolated from the Chinese Mangrove PlantRhizophoramucronata[J]. Tetrahedron Letters, 2011,52(1):21-25.
[13]刘净,谢韬,魏秀丽,等. 冬凌草化学成分的研究[J]. 中国天然药物, 2004,2(5):276-279.
(Liu Jing, Xie Tao,Wei Xiuli, et al. Chemical Studies onRabdosiarubenscens[J]. Chinese Journal of Natural Medicines, 2004,2(5):276-279.)
[14]杜希萍,李瑶瑶,鲁春华,等. 分离自木霉PT2的一个新倍半萜糖苷[J]. 天然产物研究与开发, 2010,22(4):544-547.
(Du Xiping, Li Yaoyao, Lu Chunhua, et al. A Novel Sesquiterpene Glucoside fromTrichodermaspPT2[J]. Natural Product Research and Development, 2010,22(4):544-547.)
[15]Li X D, Miao F P, Ji N Y. Two New Epoxysteroids fromHelianthustuberosus[J]. Molecules, 2011,16(10):8646-8653.
