Cu(Ⅱ)对纤维蛋白原硝化影响的研究
2014-03-24史建龙罗云敬叶三仙
史建龙,罗云敬,崔 爽,叶三仙,鲁 绯
(1.北京工业大学生命科学与生物工程学院,北京 100124;2.北京市食品与酿酒产业产品质量监督检验一站,北京 100075)
纤维蛋白原是人体内具有调节凝血、炎症及组织修复功能的大分子糖蛋白,由3对非等同的多肽链α2β2γ2形成六聚体[1-2]。纤维蛋白原的损伤能够增大血液黏滞度和细胞内胆固醇的堆积、加速动脉粥样硬化及其它心血管疾病的形成和发展[3-4]。纤维蛋白原的氧化会导致其α链间酪氨酸发生交联[5],金属离子诱导的纤维蛋白原氧化修饰能诱发血纤维蛋白原异常症,抑制血栓的形成[6-7]。
过氧亚硝酸根(ONOO-)是人体内一种强氧化硝化细胞毒性物质,能够引发自由基链式反应[8],对蛋白质进行翻译后修饰,引起一系列生理病理过程,最终导致癌症[9]、帕金森症、中风以及心血管疾病[10]。研究发现,一些金属离子如Co(Ⅱ)、Mn(Ⅱ)能够催化ONOO-介导的纤维蛋白原硝化反应[11-12]。铜作为人体必需的微量元素,参与多种金属酶的构成,催化心血管基质胶原蛋白的合成,对于维持心血管功能及凝血功能具有重要作用。
鉴于此,作者对Cu(Ⅱ)参与的ONOO-硝化损伤纤维蛋白原过程进行研究,采用衰减全反射傅立叶变换红外光谱(ATR-FTIR)、SDS-PAGE电泳和冯克劳斯(Von Clauss)法对该过程中纤维蛋白原二级结构以及凝聚活性的变化进行了分析。
1 实验
1.1 试剂与仪器
纤维蛋白原、凝血酶,美国Sigma公司;蛋白Marker(board),北京鼎国;ONOO-溶液,根据Uppu等[13]提出的两相反应体系制备,-20 ℃保存备用,实验前用紫外分光光度计在302 nm处测定其吸光度,并根据ε302=1 670 L·mol-1·cm-1计算ONOO-浓度;其它试剂均为分析纯;实验用水为二次去离子水。
U3010型紫外分光光度计,日本日立公司;Vertex70型傅立叶变换红外光谱仪,德国Bruker公司;J-KEM型平行合成仪,美国Thermo Scientific公司;DYY-12C型电泳仪,北京六一仪器厂。
1.2 纤维蛋白原的硝化
将纤维蛋白原溶于0.5 mol·L-1、pH值为7.4的Tris-HCl(含0.15 mol·L-1NaCl)缓冲溶液中。在比色管中分别加入3 mL浓度为3 mg·mL-1的纤维蛋白原溶液,然后加入不同量浓度为100 mmol·L-1的CuSO4溶液,使体系中Cu(Ⅱ)的终浓度(mmol·L-1)分别为0.00、0.17、0.30、0.50、0.67、0.83和1.66,37 ℃孵育5 min。将ONOO-以0.018 mmol·L-1·min-1的恒定速率注入到不断搅拌的纤维蛋白原溶液中,37 ℃孵育30 min。
1.3 Cu(Ⅱ)对纤维蛋白原硝化的影响
1.3.1二级结构变化实验
将上述硝化后的纤维蛋白原溶液均匀地铺满ATR的ZeSe晶片,在4 cm-1分辨率、室温敞开状态下,扫描2 048次,采集红外光谱。
同法采集纤维蛋白原溶液和缓冲溶液的红外光谱。用纤维蛋白原溶液的红外谱图差减缓冲溶液的红外谱图,以差减谱图在2 200~1 800 cm-1呈一条平滑直线作为终点。对差减谱图在酰胺I带(1 700~1 600 cm-1)内进行两点基线校正,采用9点Savits Golay函数平滑后,做二阶导数和傅立叶去卷积。手动选定各子峰的峰位和峰宽,采用Gausse函数进行拟合,重复操作使残差最小。当确定了各子峰与不同二级结构的对应关系后,根据其积分面积计算各种二级结构的相对百分含量。
1.3.2凝聚活性变化实验
将凝血酶溶于0.05 mol·L-1的CaCl2溶液中,酶活力单位为0.5 U·mL-1。37 ℃孵育5 min后,向硝化后的纤维蛋白原反应溶液中以1∶1(体积比)的比例加入凝血酶,用带钩的小棒以一定速度上下钩动溶液,当出现明显纤维丝和凝聚块时,记录其凝聚时间,每个样品重复测定3次[14]。
1.3.3SDS-PAGE电泳实验
对硝化后的纤维蛋白原溶液进行SDS-PAGE电泳分析。电泳条件:采用8%的分离胶和5%的浓缩胶,加样后,起始电压设为80 V,待前沿指示到达分离胶后将电压增加到120 V;当前沿指示距胶底端约1 cm时,切断电源;染色1 h,脱色至背景色完全消失。
2 结果与讨论
2.1 二级结构变化实验结果
2.1.1不同Cu(Ⅱ)浓度的硝化纤维蛋白原的红外光谱(图1)
由图1可看出,硝化后的纤维蛋白原红外光谱酰胺Ⅰ带分别在1 657 cm-1、1 649 cm-1和1 644 cm-1处有吸收峰,酰胺Ⅱ带在1 551 cm-1处有吸收峰,分别对应α-螺旋和无规卷曲。
对红外光谱酰胺Ⅰ带求二阶导数,作平滑处理并进行差减,得到硝化纤维蛋白原酰胺Ⅰ带红外差减谱图,如图2所示。

a~g,Cu(Ⅱ)浓度(mmol·L-1):0.00,0.17,0.30,0.50,0.67,0.83,1.66
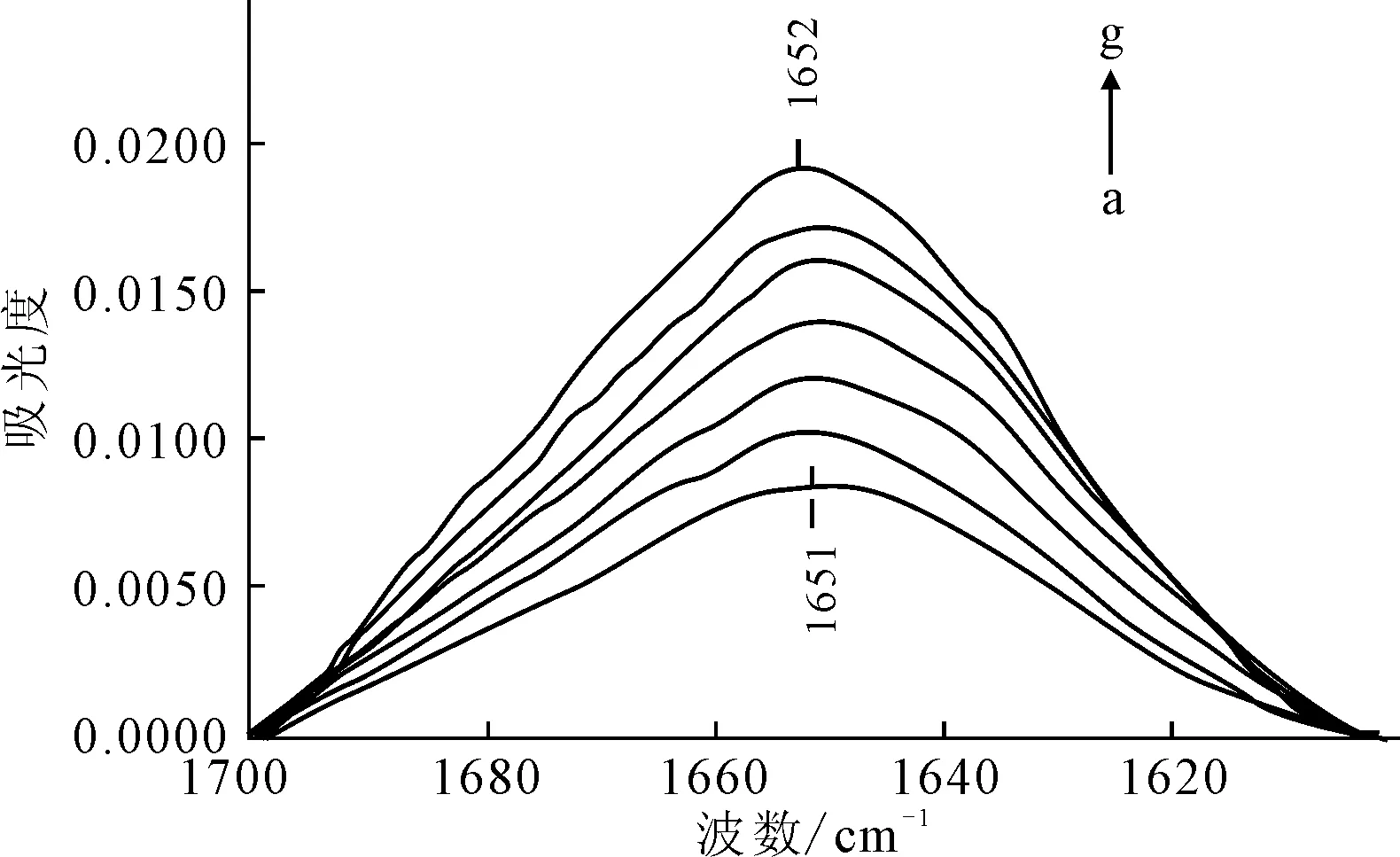
a~g,Cu(Ⅱ)浓度(mmol·L-1):0.00,0.17,0.30,0.50,0.67,0.83,1.66
由图2可看出:随着反应体系中Cu(Ⅱ)浓度由0.00 mmol·L-1增大到1.66 mmol·L-1,硝化纤维蛋白原残基吸光度逐渐增大;二阶求导并平滑处理前纤维蛋白原的峰形较平缓,处理后随着Cu(Ⅱ)浓度的增加峰形越来越尖锐;酰胺Ⅰ带的吸收峰由1 651 cm-1移动到了1 652 cm-1。
2.1.2不同浓度的Cu(Ⅱ)对硝化纤维蛋白原二级结构的影响
硝化纤维蛋白原二级结构的变化在一定程度上可以反映ONOO-对纤维蛋白原的损伤程度。定量分析显示,天然纤维蛋白原中α-螺旋占38.03%、β-折叠占29.89%、β-转角占12.6%、无规卷曲占15.84%,这与Azpiazu等[15]的研究结果一致。
不同Cu(Ⅱ)浓度下硝化纤维蛋白原二级结构的变化见图3。
由图3可看出:不同浓度的Cu(Ⅱ)对硝化纤维蛋白原的二级结构均有影响,但高浓度影响更明显;随着Cu(Ⅱ)浓度的增大,α-螺旋比例逐渐下降,β-折叠比例逐渐上升,β-转角和无规卷曲比例仅发生较小的变化;当Cu(Ⅱ)浓度达1.66 mmol·L-1时,α-螺旋比例由最初的32.29%减少到25.15%,β-折叠比例由35.66%升高到44.47%,β-转角比例由13.01%减少到12.63%,无规卷曲比例由15.94%减少到14.19%,α-螺旋和β-折叠变化显著。

图3 不同Cu(Ⅱ)浓度下硝化纤维蛋白原的二级结构变化
2.2 凝聚活性实验结果(图4)
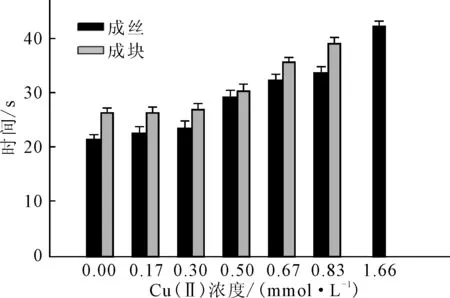
图4 不同Cu(Ⅱ)浓度下硝化纤维蛋白原的凝聚活性
由图4可知:硝化纤维蛋白原的凝聚活性随着Cu(Ⅱ)浓度的增大不断降低;当Cu(Ⅱ)浓度≤0.30 mmol·L-1时,凝聚活性随着浓度的升高变化幅度较小,成丝时间稍微延长,成块时间无明显变化,此时的Cu(Ⅱ)对硝化纤维蛋白原生物学功能影响较小;当Cu(Ⅱ)浓度≥0.50 mmol·L-1时,凝聚活性急剧下降,凝聚时间延长,当Cu(Ⅱ)浓度达到1.66 mmol·L-1时,能看到少许细丝,不能形成凝块,失去了凝聚活性,丧失了生物学功能。对照实验中,Cu(Ⅱ)本身不能与纤维蛋白原作用。
2.3 不同Cu(Ⅱ)浓度的硝化纤维蛋白原的SDS-PAGE电泳图谱(图5)
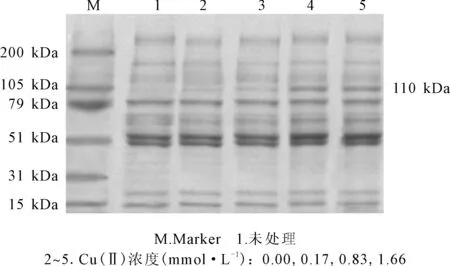
图5 不同Cu(Ⅱ)浓度下硝化纤维蛋白原的SDS-PAGE图谱
由图5可看出:未处理的纤维蛋白原有3条蛋白带,自上而下分别为Aα、Bβ和γ[12];硝化处理后(未添加CuSO4以及添加不同浓度CuSO4),上述三条蛋白带无明显变化,且位置与未处理纤维蛋白原一致,证明ONOO-硝化方法较温和,并未引起蛋白肽链的降解;但随着Cu(Ⅱ)的加入,蛋白质部分肽段发生了聚合,硝化纤维蛋白原新增一条分子量约为110 kDa的电泳条带,且随着Cu(Ⅱ)浓度的增大条带越来越清晰。
2.4 讨论
2.4.1Cu(Ⅱ)对硝化纤维蛋白原二级结构的影响
纤维蛋白原的Aα链和Bβ链位于凝血酶的酶切位点,γ链只参与单体凝聚,与纤维蛋白原单体释放无关。纤维蛋白原Aα链的α羧基端极性较强,是较易受损区域,有研究表明羟基自由基能够诱导脂蛋白和纤维蛋白原单体间酪氨酸的交联[8],且纤维蛋白原中Aα的分子量为55 kDa,因此110 kDa的新增电泳条带很可能是Aα链的酪氨酸发生了二聚。Cu(Ⅱ)的加入对硝化纤维蛋白原二级结构中的α-螺旋和β-折叠产生了较大影响,导致α-螺旋向β-折叠转变,当Cu(Ⅱ)浓度达1.66 mmol·L-1时,二者变化幅度分别为22.11%和24.71%。分子结构中β-折叠比例的增加说明Cu(Ⅱ)的加入促进了纤维蛋白原分子内部折叠骨架的展开,使蛋白质变得更加松散,从而使折叠于蛋白质内部的芳香族氨基酸残基暴露,最终加剧了纤维蛋白原的硝化失活。
2.4.2Cu(Ⅱ)对硝化纤维蛋白原凝聚活性的影响
纤维蛋白原的硝化损伤程度与凝聚时间呈负相关。凝聚实验发现,Cu(Ⅱ)的添加对纤维蛋白原的硝化损伤表现了促进作用,且凝聚活性的降低与Cu(Ⅱ)浓度呈负相关。Cu(Ⅱ)可以在碱性条件下与ONOO-反应生成Cu(Ⅲ)和·NO2[16],因此,在Cu(Ⅱ)存在下,ONOO-可能分解产生多种中间体损伤纤维蛋白原,但该过程较复杂,有待进一步研究。
3 结论
Cu(Ⅱ)的存在影响了硝化过程中纤维蛋白原分子二级结构的变化,导致α-螺旋的减少和β-折叠的增加,α-螺旋向β-折叠的转变促进了纤维蛋白原分子骨架的展开,从而加剧了ONOO-对纤维蛋白原的硝化损伤。同时二级结构的变化影响了纤维蛋白原的凝聚活性,但只是抑制了凝聚过程中单体的凝聚,并未影响纤维蛋白单体的释放。该结果对于了解Cu(Ⅱ)在纤维蛋白原硝化过程中的作用、揭示ONOO-的损伤机理以及有关疾病的预防和治疗具有重要意义。
参考文献:
[1]DUGA S,ASSELTA R,SANTAGOSTINO E,et al.Missense mutations in the humanβfibrinogen gene cause congenital a fibrinogenemia by impairing fibrinogen secretion[J].Blood,2000,95(4):1336-1341.
[2]黄其龙,林斌.纤维蛋白原对神经系统作用研究进展[J].中华神经外科疾病研究杂志,2012,11(1):88-90.
[3]李华.血浆纤维蛋白原与急性冠脉综合症的相关性研究[J].医学信息(西安上半月),2006,19(5):867-868.
[4]杨波,管昌益.纤维蛋白原与颈动脉粥样硬化关系的最新研究进展[J].中国医药指南,2013,11(5):71-73.
[5]LIPINSKI B.Pathophysiology of oxidative stress in diabetes mellitus[J].Journal of Diabetes and its Complications,2001,15(4):203-210.
[6]SHACTER E,WILLIAMS J A,LEVINE R L.Oxidative modification of fibrinogen inhibits thrombin-catalyzed clot formation[J].Free Radical Biology & Medicin,1995,18(4):15-21.
[7]STIEF T W,KURZ J,DOSS M O,et al.Singlet oxygen inactivates fibrinogen,factor Ⅴ,factor Ⅷ,factor Ⅹ,and platelet aggregation of human blood[J].Thrombosis Research,2000,97(6):473-480.
[8]TAKAHASHI I,INAGAKI N,NAKADA H,et al.Superoxide anion production by neutrophils in myelodysplastic syndromes (preleukemia)[J].Acta Medica Okayama,1988,42(1):15-19.
[9]LANCASTER J R.Simulation of the diffusion and reaction of endogenously produced nitric oxide[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(17):8137-8141.
[10]PELUFFO G,RADI R.Biochemistry of protein tyrosine nitration in cardiovascular pathology[J].Cardiovascular Research,2007,75(2):291-302.
[11]DING Y,LUO Y J,FU J.Effects of Mn(Ⅱ) on peroxynitrite nitrifying fibrinogen[J].Bio-Medical Materials and Engineering,2014,24(1):901-907.
[12]丁杨,罗云敬,史建龙,等.钴(Ⅱ)对纤维蛋白原硝化损伤及活性的影响研究[J].化学与生物工程,2013,30(3):17-20.
[13]UPPU R M,PRYOR W A.Synthesis of peroxynitrite in a two-phase system using isoamyl nitrite and hydrogen peroxide[J].Analytical Biochemistry,1996,236(22):242-249.
[14]REVERDIAU-MOALIC P,DELAHOUSSE B,BODY G,et al.Evolution of blood coagulation activators and inhibitors in the healthy human fetus[J].Blood,1996,88(3):900-906.
[15]AZPIAZU I,CHAPMAN D.Spectroscopic studies of fibrinogen and its plasmin-derived fragments[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1992,1119(3):268-274.
[16]KOHNEN S,HALUSIAK E,MOUITHYS-MICKALAD A,et al.Catalytic activation of copper(Ⅱ) salts on the reaction of peroxynitrite with propofol in alkaline medium[J].Nitric Oxide,2005,12(4):252-260.
