人参皂苷生物合成及调控功能基因研究进展(1)
2014-03-24薛蛟王英平肖盛元
薛蛟,王英平,肖盛元,※
(1.北京理工大学生命学院,北京100081;2.中国农业科学院特产研究所,长春130112)
人参是一种重要的经济作物,具有重要的经济价值和药用价值[1]。2013年,吉林省人参产业产值达330亿元人民币。与此同时,由于参地轮作周期较长,世界范围内可用参地面积越来越少。以吉林省集安市为例,1988年,全市人参种植面积1330万m2,2005年缩减到480万m2,2012年为470万m2。相应地,近5年,人参价格上涨了近10倍。
人参皂苷含量和组成是人参品质的重要指标。抗癌活性成分人参皂苷Rg3[2]已经于2000年批准为一类新药;人参皂苷Rg1和Re被命名为“血管生长因子”[3,4]。随着老龄化人口增加和疾病谱的改变(如肿瘤、肥胖和心血管疾病人口增加),人参的需求量将会进一步提高,人参及人参皂苷的需求量将会进一步增加,供需矛盾将会进一步加剧。培育人参皂苷高含量的人参新品种或者建立皂苷产量高的人参培养物培养技术是解决这种供需矛盾的关键基础。本文总结了近年来在人参生物合成及其代谢调控方面的研究进展,以期为进一步开展与人参皂苷合成和积累相关的系统生物学研究;为阐明人参皂苷合成和积累的分子机理及其调控机制提供参考;为通过基因工程手段建立高产人参皂苷细胞株和发酵技术提供理论依据并积累有关的基础资料[5]。
1 人参皂苷生物合成相关基因研究进展
阐明人参皂苷生物合成过程以及参与该过程的基因是人参系统生物学研究的重要内容。通过测定人参不同组织的EST序列(Expressed Sequence Tag)可以获得人参转录组数据,从中可以筛选某一功能超基因家族基因的mRNA[6],通过构建这些基因的表达载体或RNAi技术可以进一步研究这些基因的功能。NCBI的EST数据库收录了22 884条人参属植物的EST(其中,人参17 773条、西洋参5018条、三七93条)。人参皂苷生物合成过程及参与这些过程的基因见图1。
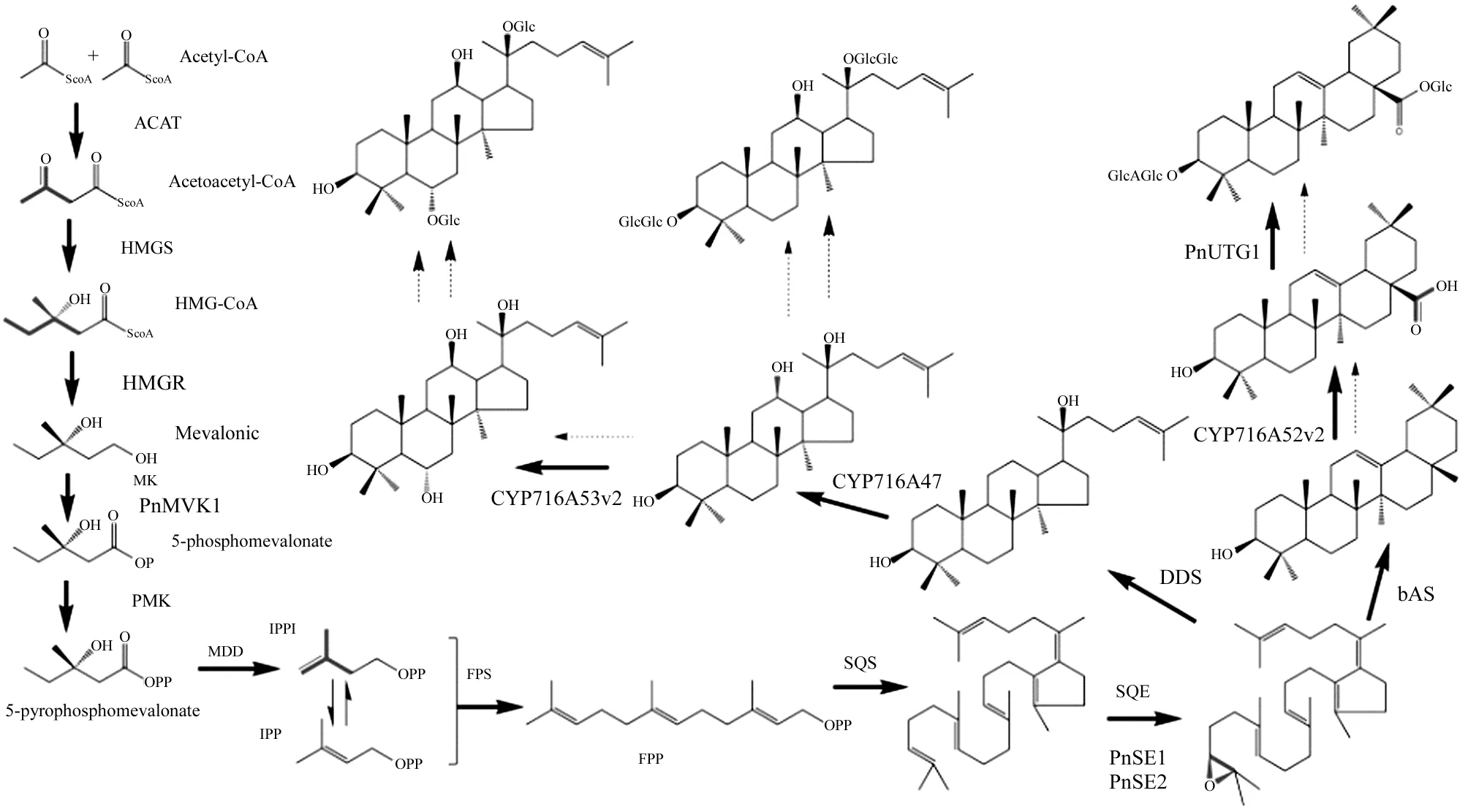
HMGR.3-羟基-3-甲基戊二酸单酰辅酶A 还原酶[7,8];PnMVK1.甲羟戊酸激酶[9];PnSE1、PnSE2.鲨烯环氧酶[10~14];DDS.达玛烯二醇合成酶[15,16];CYP716A47.原人参二醇合成酶[6];CYP716A53v2.原人参三醇合成酶[17];β-AS.β-香树素合成酶[18,19];CYP716A52v2.β-香树素C28位羧基化酶[20];PnUGT1.β-香树素糖基化酶[21]
MHGR.They are methylhydroxyglutaryl CoA reductase;PnMVK1.mevalonate kinase;PnSE1,PnSE2.oxidosqualene cyclase;DDS.dammarendiol synthetase;CYP716A47.protopanoxadiol synthetase;CYP716A53v2.protopanoxatriol synthetase;β-AS.β-amyrin synthetase;CYP716A52v2.β-amyrin C28 oxidase;PnUGT1.β-amyrin UDP glycosyl transferase.
图1人参皂苷生物合成过程及参与这些过程的基因
Fig.1Ginsenosidebiosyntheticpathwayandthefunctionalgenesinvolvedinthispathway
2 不同组织中人参皂苷生物合成相关基因转录水平研究
人参属植物不同组织部位皂苷含量差异较大。其中,人参茎中皂苷含量最低,约为人参根中皂苷含量的1/12;叶中含量最高,约为根中皂苷含量的2倍。通过测定人参皂苷生物合成相关基因在不同组织中的转录水平,可以分析人参皂苷生物合成部位和分布、积累的调控机制,人参皂苷生物合成相关基因表达水平是影响人参皂苷生物合成的关键因素。人参、三七和西洋参中参与三萜生物合成的基因在根、茎、叶中表达水平与这些组织中皂苷含量不显示依赖关系,原因可能有2个方面。第一,这些基因的转录水平和翻译水平可能差异较大。基因转录水平高的组织中,相应的蛋白质翻译和活化水平不一定高,而蛋白质才是生理功能的直接执行者。研究表明,生物组织中mRNA的转录水平与相应蛋白质丰度的相关性不好[22,23]。Nam,M.H等[24]采用2-DE MALDI TOF/LC ESI MS/MS(Two Dimensional Electrophoresis Matrix Assistant Leaser Dissociation Ionization Time of Flight Coupled Liquid Chromatography Tandem Electrospray Mass Spectrometry)方法从人参叶中鉴定了147个受光照调节的蛋白质,其中就有30个蛋白质的相关基因转录水平很低,采用EST测序方法未检测到mRNA。第二,可能是植物组织内存在皂苷重新分布和积累的调控机制。人参皂苷具有表面活性,可与膜结构中的甾醇类物质结合形成沉淀导致生物膜破坏[25],从而产生一定的自毒作用[26,27],这可能是未分化的人参组织中皂苷含量较低的重要原因之一。人参皂苷在组织中积累达到一定含量必须克服这种自毒作用。Yokota S.等[28]采用胶体金标记人参皂苷Rb1的单克隆抗体,然后用电子显微镜分析观察人参组织中金颗粒的分布,结果表明,人参根和茎中人参皂苷Rb1主要与蛋白质颗粒结合并存在于细胞质和液泡中,人参叶细胞的液泡和线粒体中皂苷含量很低,主要以游离态的形式富集于叶肉细胞的叶绿体和过氧化物酶体中。与蛋白质结合和膜结构包裹(液泡、叶绿体和过氧化物酶体等)等机制降低了人参皂苷的毒性作用,这可能是人参皂苷在组织中积累的调控机制之一(表1)。
表1人参皂苷合成相关基因在不同组织中的相对表达水平
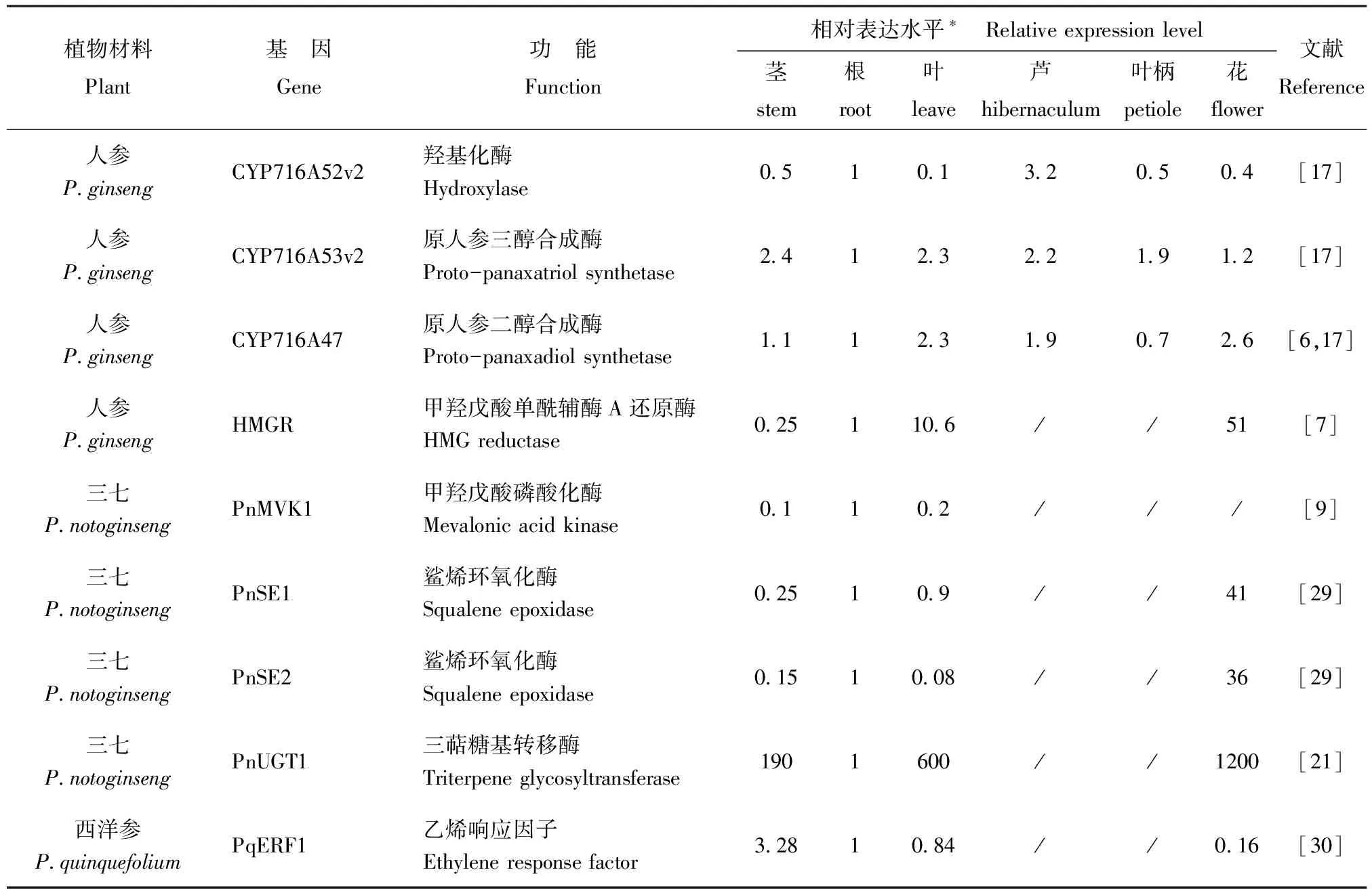
Table 1Transcriptional level of ginsenoside biosynthetic genes in different organs
注:*.数据系根据相应的文献中柱形图估算而得,以根中的表达水平为基准(=1),其余组织中的转录水平为比值;/.没有此项数据。
Note:*.The data was derived from the graphs in the literature.The relative transcription levels in different was calculated with the transcription level in the root as reference(=1);/.means the transcription of this gene was not measured.
3 人参皂苷表达调控研究(表2)
毫无疑问,直接参与人参皂苷生物合成的酶类对人参皂苷生物合成至关重要,Han J.Y.等[13]采用RNA干扰方法使人参发根中达玛烷合成酶沉默,人参皂苷含量降低至约原来的1/10。由于参与人参皂苷生物合成过程的功能基因研究还处于初步阶段,通过导入人参皂苷相关合成基因提高皂苷含量的研究还没有大量开展,Lee M.H.等构建了鲨烯合成酶高表达的人参发根,但人参皂苷含量没有本质的提高,与外源化学调节剂茉莉酸甲酯的效果相当。另外,添加化学调节剂或者皂苷生物合成中间产物也可以在一定程度上提高人参培养物的皂苷含量。
表2人参皂苷生物合成和积累调控研究

Table 2Studies on ginsenoside biosynthetic regulation
续表2

植物材料Plant处理方法Treatment皂苷含量变化Variationofginsenosidecontent备 注Notes文 献Reference人参悬浮细胞CellsuspensionofP.ginseng茉莉酸甲酯处理Methyljasmonatetreatment增加150%Increased150%[38]三七悬浮细胞CellsuspensionofP.notoginseng2-羟乙基茉莉酸酯处理2-hydroxylethyljasmonatetreatment增加60%Increased60%Rg1、Re、Rb1和Rd分别提高30%、30%、70%和110%ginsenosideRg1,Re,Rb1andRdincreased30%、30%、70%and110%respectively[39]人参发根HairyrootofP.ginseng细菌寡多糖处理Oligosaccharidetreatment增加100%Increased100%[40]人参悬浮细胞CellsuspensionofP.ginseng山梨醇处理Sorbitoltreatment增加45%~50%Increased45%-50%[41]人参悬浮细胞CellsuspensionofP.ginseng甲羟戊酸处理Mevalonicacidtreatment增加38%Increased38%早期添加主要影响人参皂苷Rb1的合成,晚期添加主要影响人参皂苷Rg1的合成MVAaddedinearlylogphasewaspredominantlyincorporatedintoginsenosideRb1,whileMVAaddedinlatelogphasewaspredominantlyincor⁃poratedintoginsenosideRg1.[42]
4 三萜类化合物生物合成相关功能基因研究方法(表3)
三萜类化合物是重要的药用活性成分,其生物合成相关的功能基因研究是调控这些化学成分生物合成和积累的重要理论依据。由表3可以看出,功能基因研究首先需要筛选这一生理功能的候选基因,然后通过转基因表达载体确证这些基因的功能,因此候选基因的筛选是功能基因研究的关键。对于已经完成基因组测序并且已经建立基因共表达相关性数据库的植物,可以根据基因共表达相关关系筛选某一功能基因共表达相关的特定功能基因,然后验证这些基因的功能,如蒺藜苜蓿的C24羟基化和C28氧化的基因研究;也可通过与亲缘关系较近的植物相应基因的同源性分析来筛选相关基因,如西红柿乳糖转移酶基因的筛选;还可通过胁迫引起代谢组表达的变化,结合基因转录水平变化的cDNA芯片分析结果筛选相关功能基因。对于没有完成基因组测序的植物,EST测定结果是获取功能基因序列的有效方法,通过同源性分析可以对这些表达序列进行功能注释,从而可以获得某一功能的基因家族。根据代谢产物的化学结构,结合植物次生代谢产物生物合成途径数据库,可以推测模式生物三萜类化合物生物合成相关功能基因,通过同源性分析可以从转录组测定结果中筛选相关功能基因的序列信息。
表3近年来关于三萜类化合物生物合成相关基因功能的研究

Table 3Researches on biosynthetic genes of triterpenoids
续表3

植物材料Plant基 因Gene功 能Function方 法Method文 献Reference燕 麦ArrhenatherumelatiusCYP51H10合成12,13-epoxy-16-hy⁃droxy-amyrinSynthesisof12,13-epoxy-16-hydroxy-amyrin通过代谢产物的结构特征和变异植株的转录组分析,推测代谢产物的生物合成途径,筛选候选基因。通过克隆和转基因酵母验证基因功能。Candidategenewasselectedfromtranscriptomeofvariant.Itsfunc⁃tionwasvalidatedwithtransgenicyeast.[50,51]葡萄藻BotryocladialeptopodaSSL(鲨烯合成酶类似基因,squaleneepoxidaselikegene)Botryococcene合成Synthesisofbotryococcene根据Botryococcene与鲨烯结构相似的特点,推测存在催化FPP合成Botryococcene的鲨烯合成酶同源基因。通过葡萄藻cDNA文库找到与鲨烯合成酶同源的基因。再通过克隆,酵母表达验证基因功能。Thebiosyntheticpathwayofbotryococcenewasblockedoutfromthatofsqualene.ThecandidategenewasselectedfromthecDNAlibraryofBotryocladialeptopoda.Itsfunctionwasvalidatedwithtransgenicyeast.[52,53]
(待续)
