血液透析、血液透析滤过及连续肾脏替代治疗对尿毒症毒素的清除作用及对动脉粥样硬化程度的影响
2014-03-24杨定平冯爱桥
李 涛 杨定平 冯爱桥
武汉大学人民医院肾内科,湖北武汉430000
血液透析、血液透析滤过及连续肾脏替代治疗对尿毒症毒素的清除作用及对动脉粥样硬化程度的影响
李 涛 杨定平▲冯爱桥
武汉大学人民医院肾内科,湖北武汉430000
目的探讨不同血液净化方式对尿毒症毒素的清除效果及对动脉粥样硬化程度的影响。方法选择2013年1~12月在武汉大学人民医院进行血液净化治疗的尿毒症患者68例,根据透析方法分为单纯透析(HD)组(22例),血液透析+血液透析滤过(HD+HDF)组(28例),血液透析+连续肾脏替代治疗(HD+CRRT)组(18例)。比较3组透析前后同型半胱氨酸(Hcy)、瘦素、晚期糖基化终产物(AGEs)、甲状旁腺激素(iPTH)变化、颈动脉内膜-中层厚度(IMT)及粥样硬化斑块面积。结果单次透析后HD+HDF组和HD+CRRT组Hcy[(21.8±5.3)、(21.6±7.2)μmol/L]、瘦素[(10.8±2.2)、(11.9±3.5)μg/L]、AGEs[(25.8±4.1)、(20.2±2.6)μg/L]、iPTH[(1.7±0.6)、(1.7±0.5)μg/L]均显著下降,差异均有高度统计学意义(P<0.01);单次透析后,HD+HDF组和HD+CRRT组Hcy、瘦素、AGEs以及iPTH均显著低于HD组[(37.3±19.9)μmol/L、(21.4±5.5)、(35.7±8.8)、(2.6±1.1)μg/L],差异均有统计学意义(P<0.05)。治疗1年后,HD组瘦素[(25.7±4.3)μg/L]水平较1年前显著升高,差异有统计学意义(P<0.05),而HD+HDF组和HD+ CRRT组Hcy[(26.3±8.1)、(26.9±7.4)μmol/L]、AGEs[(30.5±6.2)、(28.1±7.3)μg/L]及iPTH[(2.1±0.6)、(2.5±1.0)μg/L)]均显著下降,差异均有统计学意义(P<0.05或P<0.01)。1年后Hcy、AGEs、iPTH、及瘦素三组间比较差异有统计学意义(P<0.05)。治疗1年后,HD组动脉粥样斑块面积显著增加,差异有统计学意义(P<0.05)。Hcy、瘦素、AGEs及iPTH与颈动脉IMT呈正相关(r=0.48、0.80、0.73、0.41,P<0.05或P<0.01),与粥样硬化斑块面积呈正相关(r=0.54、0.66、0.61、0.43,P<0.05或P<0.01)。结论常规HD不能有效清除尿毒症毒素,而HDF或CRRT能够有效清除相关毒素,并延缓颈动脉粥样硬化的过程。尿毒症毒素与动脉粥样硬化具有正相关的关系。
血液净化;尿毒症;动脉粥样硬化
尿毒症(uremia)是对肾功能衰竭症候群描述,尿毒症毒素是肾功能衰竭时潴留在体内并具有某种生化或生物学活性的物质,这些物质正常情况下通过肾脏排出,当肾功能衰竭时,因排出下降而蓄积在体内[1]。目前常见的尿毒症毒素共有三类:小分子水溶性毒素、中大分子类毒素、结合蛋白质的毒素。这些毒素在机体内以及循环中蓄积,可导致相关病理生理改变,包括微炎性反应、免疫功能紊乱、氧化应激、蛋白质合成障碍等,加速患者发生动脉粥样硬化等相关并发症[2]。血液净化是清除尿毒症毒素的重要方法,而心血管疾病是维持性血液透析患者常见的并发症。本研究观察不同净化组合方案对患者动脉粥样硬化的影响,现将结果报道如下:
表1 首次透析前三组血脂、肝肾功能以及炎症指标情况±s)

表1 首次透析前三组血脂、肝肾功能以及炎症指标情况±s)
注:HD:单纯血液透析;HD+HDF:血液透析+血液透析滤过;HD+CRRT:液透析+连续性肾脏替代治疗;BUN:尿素氮;Scr:肌酐;MCP-1:单核细胞趋化蛋白-1;hs-CRP:高敏C反应蛋白
组别例数总胆固醇(mmol/L)甘油三酯(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)脂蛋白(a)(mg/L)BUN(mmol/L)Scr(μmol/L)IL-6(ng/L)MCP-1(ng/L)hs-CRP(mg/L)HD组HD+HDF组HD+CRRT组F值P值22 28 18 5.1±1.1 5.1±0.9 5.0±0.8 0.074>0.05 1.8±0.6 2.0±0.8 1.9±0.6 0.519>0.05 0.9±0.2 0.9±0.2 0.8±0.2 1.654>0.05 2.2±0.8 2.1±0.7 2.1±0.8 0.129>0.05 254.1±73.3 233.8±94.2 266.4±77.9 0.891>0.05 31.1±7.2 32.7±9.8 31.2±6.9 0.289>0.05 899.4±121.5 949.2±163.1 935.7±164.4 0.689>0.05 88.2±31.1 89.9±25.4 91.7±32.8 0.071>0.05 282.6±44.8 303.5±74.2 293.1±63.7 0.676>0.05 7.5±1.4 7.6±1.6 7.8±1.9 0.173>0.05
1 资料与方法
1.1 一般资料
选择2013年1~12月在武汉大学人民医院进行血液净化治疗的尿毒症患者68例,其中男36例,女32例,年龄30~78岁,平均(58.8±10.2)岁。入选标准:符合慢性肾功能不全尿毒症期的诊断标准,需要进行维持性血液净化治疗,维持性透析时间≥3个月,病情稳定。排除标准:入组前1个月及透析1年后检查相关指标前发生严重感染、心衰、不稳定性心绞痛、活动性肝炎、手术等,排除患肿瘤的患者。所有患者维持性透析时间3~92个月,平均(23.3±6.6)个月。其中24例患者原发性疾病为慢性肾小球肾炎,16例为高血压病肾损害,12例患者为糖尿病肾病,5例患者为多囊肾,4例患者为慢性间质性肾炎,3例为梗阻性肾病,4例为痛风性肾病。根据净化方式不同分为单纯血液透析(HD)组、血液透析+血液透析滤过(HD+HDF)组、液透析+连续性肾脏替代治疗(HD+CRRT)组。HD组22例,其中男12例,女10例;平均年龄(57.9±9.5)岁;7例患者原发病为慢性肾小球肾炎,5例患者为高血压性肾损害,5例患者为糖尿病肾病,2例患者为多囊肾,1例患者为慢性间质性肾炎,1例患者为痛风性肾病,1例患者为梗阻性肾病。HD+HDF组28例,其中男16例,女12例;平均年龄(59.9±10.5)岁;11例原发病为慢性肾小球肾炎,8例患者为高血压性肾损害,4例患者为糖尿病肾病,2例患者为多囊肾,1例患者为慢性间质性肾炎,1例患者为痛风性肾病,1例患者为梗阻性肾病。HD+CRRT组18例,其中男8例,女10例;平均年龄(60.1±11.0)岁;6例患者原发病为慢性肾小球肾炎,3例患者为高血压性肾损害,3例患者为糖尿病肾病,1例患者为多囊肾,2例患者为慢性间质性肾炎,2例患者为痛风性肾病,1例患者为梗阻性肾病。三组性别、平均年龄、原发病分布情况比较,差异无统计学意义(P>0.05);首次透析前三组血脂、肝肾功能、炎症指标比较,差异无统计学意义(P>0.05)(见表1),具有可比性。本研究经医院伦理委员会通过,患者知情同意并签署知情同意书。
1.2 方法
1.2.1 治疗方法HD组:常规血液透析治疗,每周3次,4 h/次,滤过膜为血仿膜,表面积1.4m2。HD+HDF组:常规透析治疗每周2次,在此基础上增加血液透析滤过1次。HD透析滤过膜以及表面积同上。HDF滤过膜高通量聚砜膜,表面积1.3 m2,滤过系数为40,透析机:费深尤斯。HD+CRRT组:常规透析治疗每周2~3次,在此基础上进行连续性肾脏替代治疗每月2次,日间CRRT法,7~9 h/次,高通量聚砜膜,面积1.3 m2,滤过系数为40,透析机:Prisma。所有透析均采用碳酸氢盐透析,透析液流量为500 mL/min,肝素抗凝,血液流量为220~300mL/min。
1.2.2 评价方法①HD组在首次透析治疗前10 min及首次透析结束后10 min采集静脉血10 mL,HD+ HDF组在首次HDF前10 min以及首次HDF后采集静脉血10 mL,HD+CRRT组在首次CRRT前10 min以及首次CRRT后采集静脉血10mL。所有透析患者在透析1年后再次在透析前10min采集静脉血10mL。每次采集的血液标本中,5 mL送检血常规、血脂、肝肾功能等,5mL在37℃下孵育2 h,4℃离心,分离血清,分装后-70℃储存,待检尿毒症毒素以及炎症指标。炎症指标白介素(IL)-6和单核细胞趋化蛋白-1(MCP-1)采用双抗体夹心-酶联免疫吸附法进行检测,试剂盒由上海恒远生物科技有限公司提供。高敏C反应蛋白(hs-CRP)采用免疫比浊法进行检测。尿毒症毒素指标:瘦素、同型半胱氨酸(Hcy)、甲状旁腺激素(iPTH)以及晚期糖基化终产物(AGEs)采用双抗体夹心-酶联免疫吸附法进行测定。②在首次以及末次采集血液标本同时行颈动脉粥样硬化检测,采用惠普彩色超声多普勒仪,探头脉冲7 MHz,患者仰卧,分别观察颈总动脉,颈内动脉、颈外动脉分叉处,在舒张末期测量内膜-中层厚度(IMT),IMT>1.3 mm为斑块形成。
1.3 统计学方法
采用SPSS12.0对数据进行分析,正态分布计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。尿毒症毒素与动脉粥样硬化的相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 单次透析前后患者血清尿毒症毒素清除情况
单次透析前后,HD组Hcy、瘦素、AGEs以及iPTH变化差异无统计学意义(P>0.05);而HD+HDF组和HD+CRRT组Hcy、瘦素、AGEs及iPTH均显著下降,差异均有高度统计学意义(P<0.01)。组间比较,单次透析前,三组间比较差异均无统计学意义(P>0.05);单次透析后,HD+HDF组和HD+CRRT组Hcy、瘦素、AGEs以及iPTH均显著低于HD组,差异均有统计学意义(P<0.05)。见表2。
2.2 治疗1年后各组血清尿毒症毒素变化
治疗1年后,HD组瘦素水平显著高于首次透析前,差异有高度统计学意义(P<0.01),HD+HDF组和HD+CRRT组的Hcy、AGEs及iPTH水平均显著下降,差异有统计学意义(P<0.05或P<0.01)。治疗1年后,Hcy、AGEs、iPTH及瘦素三组间比较,差异有统计学意义(P<0.05)。见表3。
表2 单次透析前后患者血清尿毒症毒素清除情况(±s)
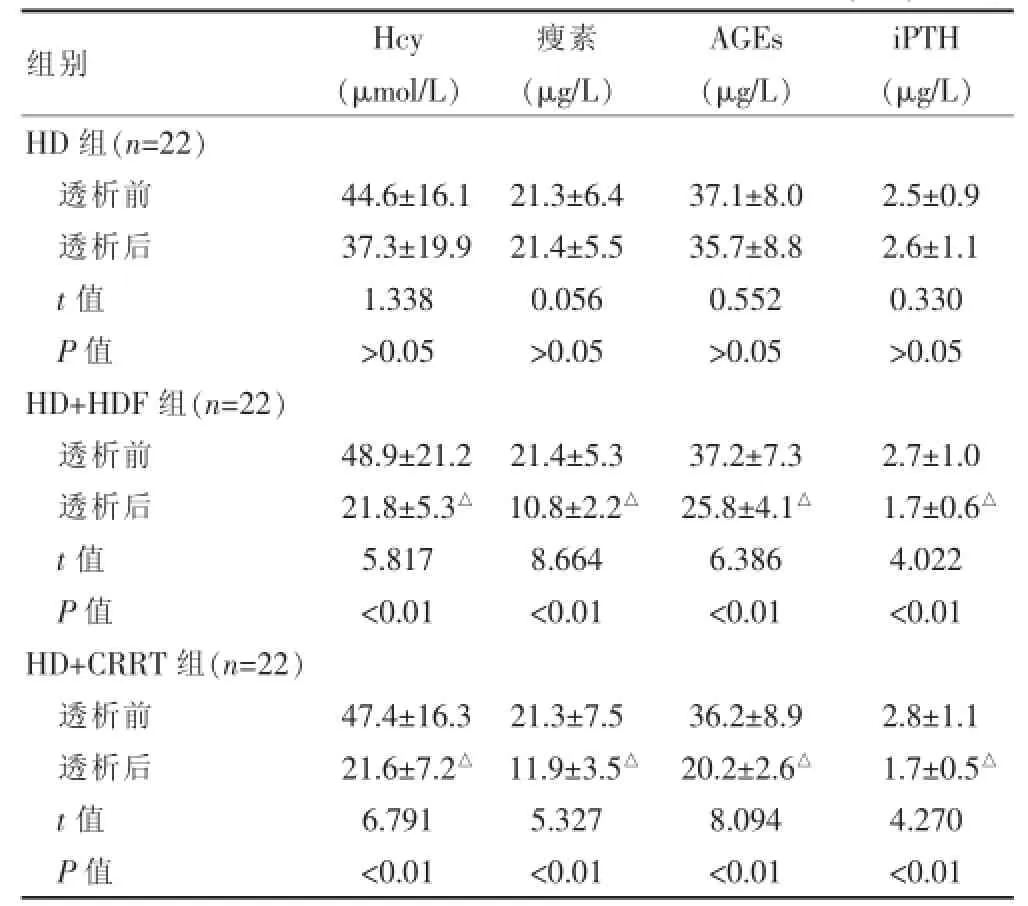
表2 单次透析前后患者血清尿毒症毒素清除情况(±s)
注:透析后与HD组比较,△P<0.05;HD:单纯血液透析;HD+HDF:血液透析+血液透析滤过;HD+CRRT:液透析+连续性肾脏替代治疗;Hcy:同型半胱氨酸;AGEs:晚期糖基化终产物;iPTH:甲状旁腺激素
组别Hcy(μmol/L)瘦素(μg/L)AGEs(μg/L)iPTH(μg/L)HD组(n=22)透析前透析后t值P值44.6±16.1 37.3±19.9 1.338>0.05 21.3±6.4 21.4±5.5 0.056>0.05 37.1±8.0 35.7±8.8 0.552>0.05 2.5±0.9 2.6±1.1 0.330>0.05 HD+HDF组(n=22)透析前透析后t值P值48.9±21.2 21.8±5.3△5.817<0.01 21.4±5.3 10.8±2.2△8.664<0.01 37.2±7.3 25.8±4.1△6.386<0.01 2.7±1.0 1.7±0.6△4.022<0.01 HD+CRRT组(n=22)透析前透析后t值P值47.4±16.3 21.6±7.2△6.791<0.01 21.3±7.5 11.9±3.5△5.327<0.01 36.2±8.9 20.2±2.6△8.094<0.01 2.8±1.1 1.7±0.5△4.270<0.01
表3 治疗1年后各组血清尿毒症毒素变化(s)

表3 治疗1年后各组血清尿毒症毒素变化(s)
注:透析后与HD组比较,△P<0.05;HD:单纯血液透析;HD+HDF:血液透析+血液透析滤过;HD+CRRT:液透析+连续性肾脏替代治疗;Hcy:同型半胱氨酸;AGEs:晚期糖基化终产物;iPTH:甲状旁腺激素
组别Hcy(μmol/L)瘦素(μg/L)AGEs(ng/mL)iPTH(ng/mL)HD组(n=22)首次透析前1年后t值P值44.6±16.1 42.7±21.0 0.336>0.05 21.3±6.4 25.7±4.3 2.677<0.01 37.1±8.0 36.3±7.9 0.333>0.05 2.5±0.9 2.8±1.2 0.938>0.05 HD+HDF组(n=22)首次透析前1年后t值P值48.9±21.2 26.3±8.1△4.609<0.01 21.4±5.3 20.3±4.4△0.749>0.05 37.2±7.3 30.5±6.2△3.281<0.01 2.7±1.0 2.1±0.6△2.143<0.05 HD+CRRT组(n=22)首次透析前1年后t值P值47.4±16.3 26.9±7.4△5.371<0.01 21.3±7.5 20.4±5.4△0.456>0.05 36.2±8.9 28.1±7.3△3.301<0.05 2.8±1.1 2.5±1.0△0.947<0.05
2.3 治疗前后患者颈动脉彩色多普勒检测结果
治疗1年后,HD组动脉粥样斑块面积显著增加,差异有统计学意义(P<0.05),而HD+HDF组和HD+ CRRT组颈动脉IMT和动脉粥样斑块面积变化,差异无统计学意义(P>0.05)。见表4。
2.4 患者血清尿毒症毒素水平与颈动脉IMT以及粥样硬化斑块面积的相关性
血清Hcy与颈动脉IMT及粥样硬化斑块面积呈正相关(r=0.48,P<0.05;r=0.54,P<0.01);瘦素与IMT及粥样硬化斑块面积呈正相关(r=0.80,P<0.01;r=0.66,P<0.01);AGEs与IMT及粥样硬化斑块面积呈正相关(r=0.73,P<0.01;r=0.61,P<0.01);iPTH与IMT及粥样硬化斑块面积呈正相关(r=0.41,P<0.05;r=0.43,P<0.05)。
表4 治疗前后患者颈动脉彩色多普勒检测结果±s)

表4 治疗前后患者颈动脉彩色多普勒检测结果±s)
注:透析后与HD组比较,△P<0.05;HD:单纯血液透析;HD+HDF:血液透析+血液透析滤过;HD+CRRT:液透析+连续性肾脏替代治疗;IMT:内膜-中层厚度
?
3 讨论
心血管疾病是尿毒症患者主要并发症及导致死亡的主要原因之一。患者表现为高血压、心绞痛、充血性心力衰竭、心肌梗死、心律失常以及脑血管意外。随着近年来对尿毒症毒素的不断认识及深入研究,发现尿毒症毒素与尿毒症患者心血管疾的发生、发展存在相关性[3]。在本次研究中,对尿毒症患者血清尿毒症毒素水平与颈动脉粥样硬化的相关性分析,结果显示尿毒症毒素与颈动脉IMT值、粥样硬化斑块面积存在显著正相关的关系,也证实尿毒症毒素参与了动脉粥样硬化发生、发展的过程。
Hcy是蛋氨酸代谢中间产物,含硫的氨基酸,通过转甲基作用为多种具有生理活性物质提供甲基。正常体内Hcy含量很低,大约有70%是经过肾脏清除和代谢。肾功能衰竭的患者肾脏对Hcy的代谢和清除作用发生障碍,因此导致Hcy在血液中潴留,发生高Hcy血症[4]。在本次研究中,尿毒症患者血清Hcy水平均显著升高。研究显示Hcy具有促进炎症因4子表达的作用,在本研究中,首次透析前患者IL-6、MCP-l及hs-CRP水平显著升高,但是三组间差异无统计学意义(P>0.05)。而炎性因子在动脉粥样硬化的发生发展过程中具有重要的作用,这也提示Hcy可能通过促进相关炎性因子的表达而参与动脉粥样硬化过程[5-6]。另外,Hcy还能够激活氧化应激反应,从而促进动脉硬化的发生。Hcy具有损伤血管的作用,是导致动脉粥样硬化、心血管事件独立危险因素。血浆Hcy水平的升高增加血管通路栓塞的风险,降低患者远期生存率。
瘦素是作为肥胖基因的代谢产物调节脂肪、糖以及能量的代谢,能够抑制脂肪细胞合成、增加能量释放、促使摄食下降,从而减轻体重[7-8]。人体内的瘦素主要通过肾脏排出,当肾功能不全时,循环内的瘦素水平升高。而瘦素水平的升高可导致患者发生厌食、恶心、营养不良等。瘦素与导致冠状动脉粥样硬化的危险因素如糖尿病、高血压、血脂代谢异常、肥胖等有密切的关系,并且与冠状动脉粥样硬化有直接关系。其可导致血管内皮细胞功能发生紊乱,诱导炎性反应以及氧化应激反应,导致血管平滑肌细胞发生增殖、迁移、钙化等,促进血管涅槃细胞发生增殖、迁移,促进血小板的迁移、聚集以及血栓形成,其还能促进泡沫细胞的形成。
AGEs是蛋白质、脂质、脂蛋白与糖醛基发生的非酶性糖化氧化反应产物[9-10]。AGEs与单核巨噬细胞上特异受体结合,经分解后主要径肾脏得以清除。当发生肾功能衰竭时,AGEs清除下降,导致其在循环中蓄积。炎性反应在动脉粥样硬化的发生发展过程中发挥重要的作用个,而本研究结果显示AGEs与颈动脉IMT及斑块面积呈正相关(r=0.73,P<0.01;r= 0.61,P<0.01),推测AGEs可能通过刺激炎症因子而参与了动脉粥样硬化的过程。研究显示AGEs能够促使IL-1β以及TNF-α的表达和释放。动物研究显示AGEs在循环中的蓄积可以导致动脉病变局部T淋巴细胞、巨噬细胞的浸润,平滑肌细胞增生和迁移,增强氧化应激反应,促进脂蛋白的氧化以及上调AGEs受体的表达,参与加速动脉粥样斑块形成的过程。
PTH是一种多肽,由84个氨基酸组成,具有调节人体体钙磷代谢的作用,根据是否含有PTH分子氨基末端和羧基末端分为N-PTH和C-PTH[11-12]。而人体大约80%为C-PTH,主要通过肾脏清除。肾功能衰竭时,患者的低钙血症、高磷血症、低1,25-羟维生素D3血症刺激甲状旁腺增生,PTH分泌增多,发生继发性甲状旁腺功能亢进,同时肾脏的清除功能不足,体内PTH蓄积。在本研究中,患者血清iPTH与IMT值及粥样硬化斑块面积呈正相关(r=0.41,P<0.05;r= 0.43,P<0.05),可能与甲状旁腺功能亢进导致异位钙化、血脂紊乱加重等相关。
HD作为最早用于临床的净化技术能有效在短时间内清除小分子毒素。但是其不能有效清除大中分子毒素,并且可能会加重炎性反应、血脂紊乱等不足[13-14]。在本研究中,HD组在单次透析后,血清尿毒症毒素Hcy、AGEs、瘦素、iPTH水平与透析前差异无统计学意义(P>0.05),而iPTH较透析前还有少许增加,这可能是因为透析后过滤出了多于的水分,导致血液浓缩,因此iPTH浓度有所升高。常规HD是采用半透膜的原理,利用膜两侧溶质渗透梯度、浓度梯度以及水压梯度清除蓄积在血液内的毒素以及多余的水分。血仿膜孔径小,超滤系数低,因此主要对小分子毒素和少量中分子毒素具有清除作用。AGEs和PTH属于中分子,Hcy本身是小分子,但是70%~80%都结合白蛋白的形式存在,瘦素分子量较大,因此常规的HD对以上毒素的清除效果不佳。在本研究中,单次HDF以及CRRT后,以上尿毒症毒素水平均有显著下降,与治疗前比较差异有高度统计学意义(P<0.01)。HDF在HD的基础上增加了对流的过程,选用生物相容性好、超滤系数更高、孔径更大的纤维膜,因此能够有效清除中分子以及部分大分子[15]。CRRT是通过对流的方式清除溶质,尤其是对大分子毒素以及炎症介质的清除方法具有明显的优势。透析膜的性质关系到中大分子毒素清除的效果。在本研究中,HDF以及CRRT采用的均为高通量聚砜膜透析,具有较高的扩散性以及通透性,能够将分子量更大的尿毒症毒素从血液中清除,因此,其对Hcy、AGEs、瘦素以及iPTH的清除率高于普通HD方法[16]。在治疗1年后,HD透析患者在透析前Hcy、AGEs较1年前有所下降,但是没有显著差异,瘦素较1年前显著升高。HD+HDF透析患者以上各指标较1年前均显著下降,尤其以Hcy、AGEs和iPTH下降更明显。HD+CRRT透析患者在治疗1年后各尿毒症毒素指标也有所下降,尤其以Hcy以及AGEs下降更明显。以上结果提示,长期普通HD透析并不能有效清除循环中的中、大分子毒素,而同时普通HD使用的透析膜组织相容性较差,可导致炎症介质的释放,激发炎性反应,加强氧化应激反应,促进动脉粥样硬化的发生。HDF以及CRRT为高通量透析方法,通过弥散、对流以及吸附等机制能够清除过多的水分、电解质以及毒素。而研究显示高通量透析具有弱化炎性反应、氧化应激的作用,减轻血管内皮的变化。在本研究中在治疗1年后对患者颈动脉IMT以及动脉粥样硬化斑块面积进行比较,结果显示:HD组改动脉粥样硬化斑块面积显著增加,而HD+HDF组和HD+CRRT组IMT以及动脉粥样硬化斑块面积没有显著变化,说明HD+HDF和HD+CRRT透析方法能够延缓动脉粥样硬化的进程。
综上所述,常规HD不能有效清除尿毒症毒素,而HDF或CRRT能够有效清除相关毒素,并延缓颈动脉粥样硬化的过程。尿毒症毒素与动脉粥样硬化呈正相关。
[1]袁艳辉,戎殳,张翼翔,等.透析中心夜间血液透析对尿毒症患者血磷代谢的影响[J].中国血液净化,2014,13(3):140-142,160.
[2]李红艳,凌凯.CRP及BNP与高龄尿毒症患者心血管疾病发病的相关性[J].中国医药导刊,2013,24(12):2010-2011.
[3]潘金林,吴耀俊,王坚,等.维持性血液透析患者颈动脉粥样硬化的相关因素分析[J].中国医药导报,2012,9(33):65-66,69.
[4]王惠新,高珺,陈茂杰,等.尿毒症血液透析患者血浆tHcy水平和左心室结构、功能测定及分析[J].山东医药,2008,48(44):97-98.
[5]Kopyra P,Seremak-Mrozikiewicz A,Drews K.Usefulness ofPCT,IL 6,CRPmeasurementin theprediction of intraamni-otic infection and newborn status in pregnantwomenwith premature rupture ofmembranes[J].Ginekologia Polska,2010,81(5):336-341.
[6]陈学波,胡玉纹.尿毒症维持性血液透析患者C-反应蛋白及营养状态与感染的关系[J].中华医院感染学杂志,2014,24(5):1181-1183.
[7]张杨,修良昌,于海兵,等.脂肪细胞因子瘦素及其受体与2型糖尿病的相关性研究进展[J].国际遗传学杂志,2014,37(2):89-93.
[8]刘丽秋,傅文,徐晶,等.瘦素对人肾小管上皮细胞转分化和转化生长因子-β1表达的影响[J].中国糖尿病杂志,2014,22(3):268-272.
[9]方敏,李世玲,王俊宏,等.晚期糖基化终产物对心肌成纤维细胞的老化及纤维化的影响[J].南京医科大学学报:自然科学版,2014,58(1):22-26.
[10]张瑛,夏学颖,胡丽莉,等.晚期糖基化终产物对脂肪细胞产生活性氧的诱导作用及其机制[J].广东医学,2014,35(1):39-42.
[11]刘东,高卓,魏学明,等.甲状旁腺切除治疗尿毒症继发性甲状旁腺功能亢进症患者皮肤瘙痒的临床观察[J].中国血液净化,2014,13(3):134-136.
[12]王宇飞,王沛,乔颖进,等.尿毒症患者合并继发性甲状旁腺机能亢进症及全身多发血管钙化[J].国际移植与血液净化杂志,2014,12(2):45-46.
[13]李新华,李尚荣,费沛,等.HP联合HD对尿毒症血清钙磷及甲状旁腺激素代谢的影响[J].中国临床医生,2014,43(3):41-43.
[14]张颖娟,薛琳,张家菊,等.血液透析联合血液灌流治疗对维持性血液透析患者的影响[J].四川医学,2012,33(12):2112-2114.
[15]高永财,王慧,田大成,等.血液透析滤过和血液透析联合血液灌流模式治疗尿毒症难治性高血压的临床研究[J].宁夏医学杂志,2013,35(3):255-256.
[16]范连慧,吴雄飞,赵洪雯,等.CRRT在顽固性频发心衰尿毒症患者肾移植中的应用[J].第三军医大学学报,2004,26(9):805-807.
Clear effect of HD,HDF and CRRT on urem ic toxins and their im pact on extent of atherosclerosis
LITao YANGDingping▲FENG Aiqiao
Nephrology Department,Renmin Hospital ofWuhan University,Hubei Province,Wuhan 430000,China
Ob jective To discuss clear effect of HD,HDF and CRRT on uremic toxins and their impact on the extent ofatherosclerosis.M ethods From January to December 2013,68 caseswith uremia failure treated with blood purification therapy in Renmin Hospital ofWuhan University were selected and divided into HD group,HD+HDF group and HD+ CRRT group according to dialysis.Hcy,leptin,AGEs and iPTH and IMT,atherosclerotic plaque area were compared in three groups.Resu lts After a single dialysis,Hcy[(21.8±5.3),(21.6±7.2)μmol/L],leptin[(10.8±2.2),(11.9±3.5)μg/L], AGEs[(25.8±4.1),(20.2±2.6)μg/L]and iPTH[(1.7±0.6),(1.7±0.5)μg/L]of HD+HDF group and HD+CRRT groupwere significantly decreased,the differenceswere statistically significant(P<0.01);after single dialysis,Hcy,leptin,AGEs and iPTH of HD+HDF group and HD+CRRT group were significantly lower than HD group[(37.3±19.9)μmol/L,(21.4±5.5), (35.7±8.8),(2.6±1.1)μg/L],the differences were statistically significant(P<0.05).After 1 year of treatment,leptin levels[(25.7±4.3)μg/L]of HD group were significantly higher than that in a year ago,the differences was statistically significant(P<0.05),while Hcy[(26.3±8.1),(26.9±7.4)μmol/L],AGEs[(30.5±6.2),(28.1±7.3)μg/L]and iPTH[(2.1± 0.6),(2.5±1.0)μg/L)]ofHD+HDFgroup and HD+CRRTgroup were significantly decreased,the differenceswere statistically significant(P<0.05 or P<0.01).After1 yearof treatment,Hcy,AGEs and leptin among the three groupswere compared, the differences were statistically significant(P<0.05). After 1 year of treatment,atherosclerotic plaque area ofHD group significantly increased,the difference was statistically significant(P<0.05).Hcy,Leptin,AGEs and iPTH was significantly positively related to carotid IMT and atherosclerotic plaque area(r=0.48,0.80,0.73,0.41,P<0.05 or P<0.01;r=0.54,0.66,0.61,0.43,P<0.05 or P<0.01).Conclusion Conventional HD can't effectively remove uremic toxins,while HDF or CRRT can effectively remove the relevant toxins and slow carotid atherosclerosis process. UToxs is positively related to carotid IMT and atherosclerotic plaque area.
Blood Purification;Uremia;Atherosclerosis
R459.5
A
1673-7210(2014)09(c)-0012-05
2014-06-18本文编辑:苏畅)
湖北省自然科学基金项目(编号2013CFC086)。
▲通讯作者
