离子选择电极检测技术的研讨
2014-03-22修宏宇贺新洋冯少波
修宏宇 贺新洋 冯少波
(1.中国计量科学研究院,北京 100029;2.广西壮族自治区计量检测研究院,南宁 530022)
0 引言
离子选择电极检测法是以离子选择电极为基础,近十年来快速发展、新兴活跃的一门电化学检测技术。其最核心的内容,就是离子选择电极。离子选择电极简写为ISEs(Ion Selective Electrodes),是一种以电位分析法测量溶液中某些特定离子活度的指示电极。随着科学技术的发展,国内外已研制成几十种离子选择电极,可以检测数十种阴阳离子。例如:对钠离子有选择性的钠离子玻璃电极;以氟化镧单晶为电极膜的氟离子选择电极;以卤化银、硫化银或它们的混合物等难溶盐沉淀作为电极膜的各种卤素离子、硫离子选择电极等。本文简单讨论离子选择电极检测技术中主要影响因素以及相应解决方案。
1 离子选择电极检测技术的基本理论
离子选择电极检测技术的理论基础是电化学中的能斯特公式。能斯特公式反映了一个化学反应在电池中进行时,电池电动势与参与反应的物质的性质、活度(浓度)、温度等的关系[1]。电池中电极反应类型有很多种,其中最常见的有三种:金属与其阳离子、非金属与其离子、以及金属与其金属离子的难溶盐溶液进行的电极反应。下面以金属与其阳离子的反应为例,说明离子选择电极测量法的基本原理。
若金属与其阳离子的电极反应为Mn++ ne = M,其能斯特公式为:
生成物金属M是固体,则aM=1,所以lnaM=0,能斯特公式变形为:

-lgaMn+=(E-E0)/k
当电极反应一定时,标准电极电势E0也就确定,那么只要测出温度T下的电极电势E,就可以知道溶液中金属离子的活度aMn+了。可见,离子计测量的是离子活度,而非浓度。
实际溶液中,活度aMn+与浓度cMn+的关系是aMn+=gMn+·cMn+,二者差别在于活度系数gMn+。能斯特公式可继续变形为:
若假设溶液为理想溶液(例如溶液足够稀时),离子活度系数gMn+趋近于1,则lggMn+=0,能斯特公式就变为:
-lgcMn+=(E-E0)/k
这时,可认为测量的离子活度近似等于其离子浓度,这也就是离子计的基本工作原理。值得注意的是:这个公式是在理想状态下推导出的,在实际测量时,由有干扰离子的影响,计算公式会比这个公式复杂(详见本文2.1)。
2 离子选择电极测量的影响因素
离子选择电极测量时有三个主要影响因素,即:干扰离子、离子强度和电势漂移。
2.1 干扰离子的影响
所有离子选择电极对其它离子(也称干扰离子)都会有一定程度上的敏感性。如果只有痕量的干扰离子,在大多数应用中离子干扰是可以忽略的。离子选择电极在同一溶液中区分不同离子的能力,称为选择系数,用KA,Bpot表示[2-3]。其中,A是原离子(Primary ion),即待测离子;B是干扰离子(Interfering ion)。不同电极的离子选择系数是不固定的,依赖于相比较的离子种类、溶液的离子强度和溶液温度等。KA,Bpot实际上体现了离子选择电极抗干扰的能力,选择系数越小,抗干扰能力越强。一般而言,离子选择电极的生产厂家应该提供离子选择电极的离子选择系数,以及选择系数的测定条件,用来帮助有能力的用户评估在自己的应用中离子选择电极的局限性。同时,IUPAC也建议,用户为提高测量准确性,还可以自己测量使用条件下离子选择电极的离子选择系数。
下面举例来说明KA,Bpot[4]的含义。一个常见干扰是Cl-对NO3-电极的干扰,Cl-对NO3-电极的选择系数是0.003。这意味着:如果溶液中有相同浓度的Cl-和NO3-,那么Cl-将会产生0.3%左右NO3-的信号。但是,在天然水中,Cl-/NO3-的比值为50:1,甚至更高,因此,有可能产生15%(20%的NO3-信号的增加。若考虑干扰离子,能斯特公式修正为尼科尔斯基-艾森曼(Nikolsky-Eisenman)公式[3]:
可以看出尼科尔斯基-艾森曼公式比能斯特公式多了后面一项。这一项就是离子选择系数的修正。如果后面一项在标准溶液和待测样品中相同,就可以消去,从而在很大程度上去掉了干扰离子的影响。因此,在实际测量时,如果干扰离子十分稳定且浓度不高(测量干扰离子的浓度不会引起太大误差),可以先测量干扰离子的浓度,再在标准溶液中加入与待测样品中相同浓度的干扰离子,从而最大程度降低由于干扰离子而产生的误差。
2.2 离子强度的影响

当待测样品的离子强度较高时,有五种方法可减少因离子强度而产生的误差:1)通过加入离子强度调节剂(Ion Strength Adjustment Buffer,ISAB),将校准的标准溶液与样品的离子强度调至相同水平;2)将待测样品稀释至足够水平,从而忽略离子强度的影响。但稀释时应注意防止过度,要确保待测离子的范围在电极的线性范围内;3)若待测溶液的基体虽较为复杂但成分已知,可通过人为添加使标准溶液与待测溶液的基体尽量类似;4)在已知溶液离子强度时,可利用公式计算出活度系数,再采用活度系数计算待测溶液的离子浓度。但这个方法在绝大多数测量中是无法实现的;5)运用标准(或样品)添加法,在加入少量的标准溶液(或待测样品)前和后,分别测量电势,由于后加入的标准溶液(或样品)很少,可以认为溶液的离子强度未发生显著变化,从而计算出离子浓度(详见本文4)。
2.3 电势漂移的影响
电势漂移是离子选择电极电势单方向的、随机的、不稳定的变化,一般在几个mV范围内。电势漂移是离子选择电极的特性,不同于液接界电势。液接界电势在同一溶液、同一温度下是基本稳定的。如果电极电势继续发生变化,则是由于电极本身变化造成的,即电极电势的漂移。一般电极的电势漂移约为3mV/8h,对于一价离子约为0.05个单位,二价离子约为0.1个单位。可见,对于精密测量或长期在线测量,离子选择电极的电势飘移是不能忽略的。但是,电势漂移无法消除,只能通过校准程序最小化。
3 离子选择电极的校准
离子选择电极的校准是将电极浸入一系列已知浓度的标准溶液中,绘制一条mV电势与活度对数 (或浓度对数)的曲线,从而找出mV电势与活度(浓度)的关系。图1是一条典型的、完整的离子选择电极的校准曲线。通常,在离子选择电极的线性范围内,校准曲线应是一条电势对活度对数的直线。但是,如前所述,由于很难得到溶液活度,通常校准时是作电势对浓度对数的关系曲线。校准曲线的斜率表示每十进制单位浓度变化,而引起电极电势的变化。校准曲线有三个关注点:线性范围(一般在10-1~10-7)、总测量范围和检测限。总测量范围包括线性及非线性段,在非线性段测量时要尽量多用标准溶液。线性段的实际斜率s可以通过实测数据并用公式s=ΔE/Δlogai计算得到。式中,s为校准曲线实测斜率;ΔE为电势变化;Δlogai为活度对数的变化。
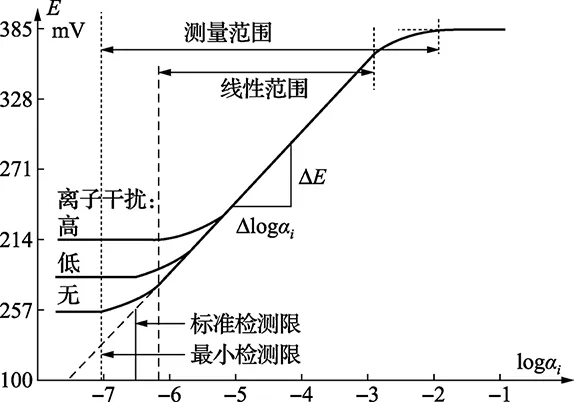
图1 一条典型的、完整的离子选择电极的校准曲线
校准时,首先准备标准溶液。可通过单一的高浓标准溶液,采用稀释法配制。如果已知被测离子的大致浓度范围,也可以直接在其附近范围选择标准溶液的浓度。若已知是在电极的线性范围内测量,可两点校准。由于校准曲线的温度依赖性,校准溶液与被测样品的温度应尽量一致。标准溶液的校准顺序先按1、2、3、4、5,然后,再按5、4、3、2、1测量一次,取两次平均值建立校准曲线,从而最小化电势漂移。清洗电极时应先用去离子水冲洗干净,擦干后再测量。为了得到最准确的结果,每次测量前均应进行校准。但是校准需要花费人力、财力,用户可评价校准所耗时间、财力与所得结果准确度之间的得失,确定校准频次。校准时,我们还需要确定“是否添加ISAB”,以防止或降低离子强度的影响(详见本文2.2)。ISAB的添加量大多要依据具体的测量条件和厂家建议,但是向标准溶液和待测溶液中添加的ISAB,应该是相同的。最后一个注意点就是建立校准曲线的横坐标是-lgci还是-lgai。同一电势下,浓度或活度不同,校准曲线不同。读取数据有三种读数方式:搅拌溶液读数、静止溶液读数、以及搅拌溶液待溶液静止后读数。最常见的是第三种情况,这样即可防止磁子搅拌升温,又可以一定程度降低等待时间。但是,无论采用哪种读数方式,都应确保测量标准溶液和未知样品时,读数方法一致,以确保电极响应尽可能一致。
4 离子选择电极测量方法的选择
校准曲线建立完,可以根据具体情况选择测量方法。测量方法大约有4种:直接电势法、标准添加法、样品添加法和标准沉淀法。最常用的是前两种方法。
直接电势法是最为简单的一种测量方法:直接测量电势,然后,从校准曲线上查找出对应的离子活度(或浓度)。这种方法快速、简单,可批量测量,但是准确度不高。
标准添加法:当待测样品量较大时,添加少量标准溶液(确保添加溶液不会改变被测样品),添加前后分别测量电势,然后,利用前后电势差和添加标准计算未知样品的浓度或活度。添加标准溶液前的能斯特公式为
-lgcx=(E-E0)/k+A基体
添加标准溶液后为
-lg(cx+cs)=(E′-E0)/k+A基体
其中A基体是基体对测量的影响。由于添加标准溶液的前提是对基体的改变可以忽略,因此,可以认为A基体是相同的,两式相减,将基体影响消去,得到
cx=cs/(10(E-E′)/k-1)
可以看出,已知加入标准溶液的浓度,再测量出标准溶液加入前后的电势E和E′,k是通过校准曲线测出的电极实际斜率,就可以用上式算出待测溶液离子的浓度了。标准添加法的优点是减少了样品基体影响,准确度较高。但是测量过程较为复杂。对单个或数个基体组成并不一致的样品,一般使用标准添加法。
5 结论
影响离子选择电极测量准确性的因素有很多,电计电压测量[5]、电极电势漂移、温度测量、响应斜率、样品中干扰离子的存在、离子强度大小以及测量时所选择方法自身的准确性、精密度等都会对测量结果产生影响。但是,离子选择电极检测技术由于其十分明显的优点,近年来仍然得以快速发展。离子计是少数可同时测量正、负离子的仪器之一,便宜简单,测量范围大,温度范围广,测量快速便捷,并可在线、持续测量,不受样品颜色和浊度的影响。另外,离子选择电极直接测量的是离子活度,而非浓度,这在生物制药领域十分重要,更是研究化学平衡和物理化学基础理论的有力工具。离子选择电极检测技术在我国正处于发展初期,研究重点一般多在二次仪表和检测方法,对传感器及标准物质的研究还没有得到足够认识,期待更多生产厂家、标准物质研究者及计量工作者投入到离子选择电极检测技术的研究中。
[1]范康年.物理化学(第二版)[M].北京:高等教育出版社,2005
[2]IUPAC Technical Report:Selectivity coefficients for ion-selective electrodes:recommended methods for reportingKA,Bpot[R]
[3]IUPAC Recommendation 1994:Recommendations for nomenclature of Ion-selective electrodes[S]
[4]Chris C Rundle BSc,PhD.,A beginners guide to Ion-selective electrode measurements [EB/OL],http://www.nico2000.net/Book/Guide1.html
[5]JJG 757—2007离子计检定规程[S].北京:中国计量出版社,2007
