鼻腔-鼻窦恶性肿瘤组织bFGF与TSP-1表达及意义
2014-03-22,,,
,,,
(1 潍坊医学院,山东 潍坊 261000; 2 青岛市市立医院耳鼻喉科)
新生血管形成对于恶性肿瘤的生长和转移至关重要[1]。目前已发现许多参与调节血管生成的基因和蛋白,包括血管生成的促进因子和抑制因子。其中碱性成纤维细胞生长因子(bFGF)是体内最为有效的促进血管生成因子之一,可趋化血管内膜的各类细胞[2],而血小板反应蛋白-1 (TSP-1)是重要的抑制血管生成的因子之一。本研究采用免疫组化Supervision法,对鼻腔-鼻窦恶性肿瘤组织bFGF和TSP-1表达进行检测,以探讨 bFGF和TSP-1水平与鼻腔-鼻窦恶性肿瘤生成的关系及其临床意义。
1 材料与方法
1.1 材料来源
收集青岛市市立医院病理科2009 年1月—2012 年10 月保存的手术切除的鼻腔及鼻窦组织腊块,所有病人手术前均未经任何治疗,术后均经病理证实明确诊断。其中鼻腔-鼻窦恶性肿瘤54例,男36例,女18例;中位年龄45.10岁;鳞癌31例,淋巴瘤15例,腺癌8例。鼻腔良性肿瘤 43例,男29例,女14例;中位年龄42.85岁;鼻内翻乳头状瘤27例,血管瘤16例。鼻息肉 30例,男18例,女12例;中位年龄40.25岁。
1.2 研究方法
蜡块常规4 μm厚切片,脱蜡、水化。高温高压抗原修复,以体积分数0.03的H2O2阻断内源性过氧化酶,正常血清孵育20 min后,加相应bFGF兔抗人多克隆抗体(北京中杉金桥生物技术有限公司,工作浓度为1∶400)和TSP-1兔抗人单克隆抗体(北京博奥森有限公司,工作浓度为1∶200)与特异性抗原结合,将加有一抗的切片置于湿盒中,然后将湿盒置于4 ℃冰箱内过夜。加二抗系统室温下孵育。PBS冲洗,DAB显色,苏木精复染,脱水、封片。用PBS代替一抗作为阴性对照,用已知bFGF和TSP-1阳性的结肠癌组织作为阳性对照。
1.3 免疫组化结果判断标准
bFGF阳性物质表达于细胞质,TSP-1阳性物质表达于细胞质或细胞膜。每张切片选取5个高倍视野,每个视野计数100个细胞,观察各种组织细胞免疫组织化学染色的情况并进行计分。计分方法如下。①根据细胞染色强弱计分:无着色为0分,浅黄或浅褐色为1分,棕黄或褐色为2分,深褐色为3分。②根据阳性细胞百分比计分:1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。两者计分乘积为IHS计分。IHS计分<3分为阴性,≥3分为阳性。
1.4 统计学处理
采用SPSS 19.0软件进行统计分析,统计处理采用行×列表卡方检验及四格表精确概率法,P<0.05为差异有显著性。
2 结 果
bFGF蛋白阳性物质表达于细胞质,鼻腔-鼻窦恶性肿瘤、鼻腔-鼻窦良性肿瘤及鼻息肉组织bFGF蛋白阳性率分别为83.33%、58.14%、20.00%,组间比较差异有显著意义(χ2=7.56~32.43,P<0.05)。bFGF蛋白阳性表达与恶性肿瘤病人的性别、年龄及病理类型无关(P>0.05)。见表1。
TSP-1蛋白阳性物质表达于细胞质或胞膜,鼻腔-鼻窦恶性肿瘤、鼻腔-鼻窦良性肿瘤及鼻息肉组织中TSP-1蛋白的阳性率分别为25.93%、62.79%和86.67%,各组间差异具有显著意义(χ2=5.06~25.53,P<0.05)。TSP-1蛋白阳性表达与恶性肿瘤病人性别、年龄及病理类型无关(P>0.05)。见表1。
表1bFGF和TSP-1蛋白在鼻腔-鼻窦组织中的表达与临床病理特征的关系
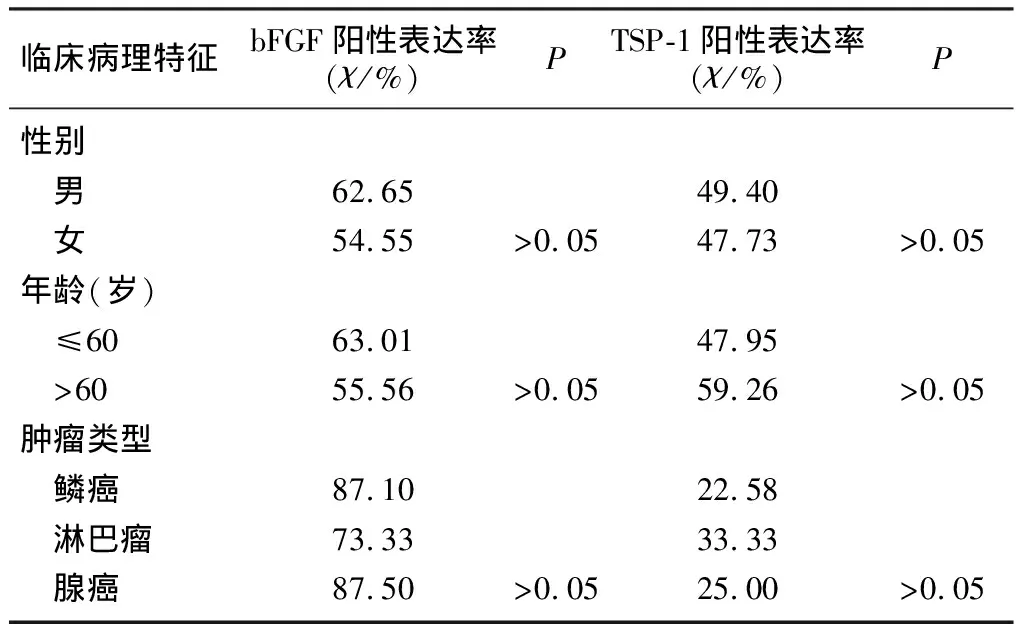
bFGF(χ/%)PTSP-1(χ/%)P 62.6549.40 54.55>0.0547.73>0.05() ≤6063.0147.95 >6055.56>0.0559.26>0.05 87.1022.58 73.3333.33 87.50>0.0525.00>0.05
3 讨 论
新生血管的生成对肿瘤的发生发展具有重要的作用,肿瘤生长所需要的氧气和营养可持续不断的由新生肿瘤血管而获得,代谢产物同样经过新生肿瘤血管而带走[3],这就为肿瘤的血行及淋巴道转移提供了途径。但肿瘤的血管新生是一个复杂的过程,是多种促进血管生成因子及抑制因子共同调控的结果。本文主要研究血管生成促进因子bFGF及抑制因子TSP-1表达与鼻腔-鼻窦肿瘤生成的关系。bFGF通过促进内皮细胞分裂和趋化,刺激内皮细胞胶原酶和纤维蛋白酶的活化,并降解其基底膜,诱导内皮细胞形成血管芽并向肿瘤组织中生长,促进肿瘤血管管腔的生成而导致肿瘤的发生及发展[4];而TSP-1则通过诱导内皮细胞的凋亡,抑制内皮细胞增殖、迁移及管道的形成间接抑制肿瘤的生成,且TSP-1可干扰bFGF与内皮细胞受体的结合而抑制bFGF的促进肿瘤生成的作用[5]。
本研究结果显示,bFGF在鼻腔-鼻窦恶性肿瘤中的表达阳性率明显高于鼻腔-鼻窦良性肿瘤及鼻息肉组织,由此可以看出 bFGF可能具有促进肿瘤发生的作用。同样,DEMIRKESEN等[6]研究显示,bFGF在早期胃癌组织中的表达明显高于慢性浅表胃炎,说明bFGF具有促进胃癌发生的作用。VESELY等[7]通过酶联免疫吸附试验(ELISA)研究显示,甲状腺肿瘤组织中bFGF的表达明显高于甲状旁腺肿的病人,在未分化癌中bFGF的表达又较乳头状癌的表达明显增高,提示bFGF与肿瘤的发生具有相关性,且恶性程度越高,bFGF表达越高。
研究结果已显示,TSP-1在肿瘤生成中发挥着复杂而又互不相同的作用,对肿瘤的作用有争议。KASPER等[8]研究显示,低分化胰腺癌中TSP-1的阳性表达率明显高于高分化胰腺癌,表明TSP-1与肿瘤的恶性程度有关。而杨森等[9]则研究显示,TSP-1可抑制黏液表皮样癌的淋巴结转移及远处转移,并可抑制肿瘤的恶性转化。本研究结果显示,TSP-1在鼻腔-鼻窦恶性肿瘤中的阳性表达率明显低于鼻腔-鼻窦良性肿瘤及鼻息肉组织,说明TSP-1随着肿瘤的恶性程度的增高而阳性表达率降低,提示TSP-1具有抑制肿瘤生成的作用。研究显示,乳癌、直肠癌中TSP-1 的阳性表达率与肿瘤组织恶性程度呈显著负相关[10],本文结果与此一致。TSP-1在肿瘤中不同的作用是否可能与其类型及TSP-1在肿瘤组织中的浓度有关,需进一步研究。
总之,本研究结果显示,bFGF可能对鼻腔-鼻窦恶性肿瘤的生成具有促进作用,而TSP-1可能具有抑制其生成的作用。
[参考文献]
[1]CARMELIET P, JAIN R K. Angiogenesis in cancer and other diseases[J]. Nature, 2000,407: 249-257.
[2]刘冰,王豪夫,刘兵,等. 大鼠缺血后肢局部应用bFGF对血管新生的影响[J]. 齐鲁医学杂志, 2009,24(3):271-274.
[3]李军,王言奎,刘莉莉,等. 卵巢癌组织中PTTG蛋白表达及其与bFGF和微血管密度的关系[J]. 齐鲁医学杂志, 2005,20(4):318-320
[4]王小军,杨文平,蔡曦光,等. bFGF、MMPs 和 TIMPs在肿瘤临床研究中的进展[J]. 中国现代医药杂志, 2012,2,14(2):126-128.
[5]叶璐,冯亦军,马奔,等. VEGF-C和TSP-1在卵巢上皮癌中的表达及意义[J]. 中华临床医师杂志, 2008,10,2(10):1142-1147.
[6]DEMIRKESEN A C, EVRENDILEK F, BERBEROGLU S, et al. Coastalflood risk analysis using landsat 27 ETM+imagery and SRTMDEM: a case study of Izmir, Turkey[J]. Environ Monit Assess, 2007,131:293-300.
[7]VESEL Y D, ASTL J, MATUCHA P, et al. Serum levels of angiogenic growthfactors in patients with thyroid gland tumors and parathyroid adenoma[J]. Neuro Endocrinol Lett, 2003,24(6):417-419.
[8]KASPER H U, EBERT M, MALFERTHEINER P, et al. Expression of thrombospondin 21 in pancreatic carcinoma: correlation with microvessel density[J]. Virchows Arch, 2001,438(2):116-120.
[9]杨森,唐休发,郭莉娟,等. 黏液表皮样癌中TSP-1表达与肿瘤血管生成及其生物学行为的关系研究[J]. 四川大学学报:医学版, 2008,39(5):763-765.
[10]MIYANAGA K, KATO Y, NAKAMURA T, et al. Expression and roleof thrombospondins 21 in colorectal cancer[J]. Anticancer Res, 2002,22(6C):3941-3948.
