PDX-1腺病毒载体构建及其在脂肪间充质干细胞中的表达
2014-03-22王晓囡鲁帅尧孙茂盛李鸿钧
王晓囡, 周 艳, 严 敏, 鲁帅尧, 李 松, 孙茂盛, 李鸿钧
(中国医学科学院 北京协和医学院 医学生物学研究所;云南省重大传染病疫苗工程技术研究中心;云南省重大传染病疫苗研发实验室, 昆明 650118)
胰岛β细胞分化发育过程中,转录因子与信号通路的调控机制非常复杂,多种转录因子的时序表达,决定着胰腺的分化与发育进程[1]。胰芽形成之初,反式作用因子胰腺十二指肠同源框蛋白1(Pancreatic duodenal homeobox 1, PDX-1)能够启动前体细胞向胰腺细胞包括所有外分泌与内分泌细胞分化[2, 3],而进一步向内分泌细胞分化则需要神经元素3(Neurogenin 3, NGN3)、成对盒基因4 (paired box gene 4, PAX4)、NK6转录因子相关1 (NK6 transcription factor related, locus 1, NKX6. 1)等多种转录因子协同作用[4]。近年研究证明,PDX-1基因的活化及相关信号通路的启动能够使间充质干细胞向胰腺β细胞方向分化,说明PDX-1基因在胰腺分化调控过程中起着“总开关”的作用[5, 6]。脂肪间充质干细胞(adipose mesenchymal stem cells, s)在体内含量丰富,易于获得,且可自体移植,在血糖平衡及激素产生方面也具有重要作用[7],成为干细胞治疗糖尿病的较为理想的干细胞资源。因此,构建PDX-1腺病毒表达载体,以PDX-1腺病毒感染脂肪间充质干细胞,对其进行重编程,以探索PDX-1在脂肪间充质干细胞中的表达情况,为进一步研究ASCs向胰岛β细胞分化过程中的作用与机制奠定基础。
1 材料和方法
1.1 材料与试剂
SalⅠ、NotⅠ、PacⅠ等多种限制性内切酶,T4 DNA ligase,PrimeSTAR HS DNA Polymerase,Lipofectamine 2000脂质体均购自大连宝生物公司。质粒提取试剂盒及胶回收试剂盒购自OMEGA公司。兔抗大鼠PDX-1IgG购自Cell signal公司。 Adenoviral vector system购自美国Strategen公司。引物由上海丰科生物有限公司合成。L-DMEM培养基购自Hyclone。吲哚美辛(indomethacin)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX)、油红O(Oil Red-O)、β-甘油磷酸钠(β-Glycero-phosphate disodium salt hydrate)、L-抗坏血酸-2-磷酸三钠盐(L-Ascorbic acid-2-phosphate)购自Sigma-Aldrich公司;细胞碱性磷酸酶(ALP)检测试剂盒购自GENMED Scientifics 公司。RIPA蛋白裂解液购自碧云天公司。
1.2 方法
1.2.1PDX-1基因的PCR扩增
以南京金斯瑞公司构建的pUC57-PDX-1(PDX1 NM_022852.3)质粒为模板,分别以P1,P2为引物,见表1,PCR扩增PDX-1基因,PCR反应体系为50 μL,2×PrimeSTAR GC buffer 25 μL,dNTP Mixture(2.5 mmol/L) 4 μL,P1(10 μmol/L) 1 μL,P2(10 μmol/L) 1 μL,pUC57-PDX-1质粒1 μL,PrimeSTAR HS DNA Polymerase(2.5 U/μL) 0.5 μL,dH2O补足50 μL。反应条件为98℃ 10 s;56℃ 5 s;72℃ 1 min,35 cycle。扩增产物在质量分数为1%琼脂糖凝胶中电泳。

表1 PCR所用引物
1.2.2 穿梭质粒pShuttle-CMV-PDX-1的构建
PDX-1的PCR产物经过胶回收纯化后与pShuttle-CMV质粒同时用SalⅠ和NotⅠ双酶切,分别胶回收852 bp PDX-1基因片段与7500 bp载体片段,T4DNA连接酶连接两个目的片段,连接产物转化DH5α感受态,筛选并扩增pShuttle-CMV-PDX-1质粒的DH5α,抽提质粒pShuttle-CMV-PDX-1。
1.2.3 pAdEasy-CMV-PDX-1腺病毒载体的构建
1)PmeⅠ酶切线性化pShuttle-CMV-PDX-1,胶回收纯化,并做CIAP去磷酸化处理。2)去磷酸化产物用PCR纯化试剂盒进行纯化。3)将线性化质粒pShuttle-CMV-PDX-1和pAdEasy-1质粒共同加入电转化BJ5183感受态细胞,冰浴30 min。4)将冰浴后的全部质粒菌体混合物转移至间距为2 mm的BioRad电转杯中,电压2.5 kV,电阻200 Ω,电容25 μF电转。5)电转结束后,加入800 μL LB培养基重悬菌体,37℃水浴45 min。6)将菌液涂布到含卡那霉素的LB琼脂板上,37℃倒置培养过夜。7)筛选带有pAdEasy-CMV-PDX-1病毒质粒的BJ5183,提取pAdEasy-CMV-PDX-1质粒。8)pAdEasy-CMV-PDX-1转化XL-10感受态细胞,大量提取pAdEasy-CMV-PDX-1,对产物进行酶切及测序鉴定。
1.2.4 重组腺病毒Ad-PDX-1的包装、扩增和滴度测定
HEK293细胞在含有体积分数为10% FBS,100 U/mL 青霉素,100 U/mL 链霉素的H-DMEM培养液中于37℃、5% CO2细胞培养箱中培养。待单层贴壁细胞贴壁率接近80%时,PacⅠ酶切线性化pAdEasy-CMV-PDX-1质粒,用Lipof-ectamine2000脂质体转染HEK293细胞。7~10 d后,大部分细胞病变并脱落时收毒,反复冻融3次,8000 r/min, 离心10 min,收集上清,再用收集的病毒液感染HEK293细胞大量扩增病毒。用Reed-Muench法测定重组腺病毒的感染性滴度。
1.2.5 重组腺病毒Ad-PDX-1的形态学观察
取5 μL 扩增所得的重组腺病毒滴至腊盘上,将铜网盖在病毒液上进行吸附,铜网用重金属盐(磷钨酸)进行负染,吸走多余染料,等样品干燥后将铜网置于透射电镜下观察。
1500 r/min离心10 min收集感染重组腺病毒24 h、48 h和72 h的HEK293 细胞,置于2.5%戊二醛(0.2 mol/L 二甲胂酸钠缓冲液配制)中固定2 h;经二甲胂酸钠缓冲液漂洗3~5次;再将样品置于1%四氧化锇(锇酸)溶液(0.2 mol/L 二甲胂酸钠缓冲液配制)固定2 h;用二甲胂酸钠缓冲液漂洗3~5次,置于缓冲液中过夜;将样品依次放入30%、50%、70%、90%及100%丙酮中进行脱水处理,每次10 min;配制环氧树脂618,按比例与丙酮混合配制;然后将样品依次放入环氧树脂与丙酮1∶2、1∶1 溶液及纯环氧树脂中进行浸透处理,每次2 h;将处理后的样品放入模具,加入环氧树脂,置于温箱,40℃处理12~20 h,再经60℃处理48~60 h进行包埋;取出包埋块,进行修块、切片处理;将超薄切片进行染色处理:2%醋酸铀染色30 min,蒸馏水冲洗;枸橼酸铅染色液染色30 min,蒸馏水冲洗;完成后静置待切片干燥;最后经透射电子显微镜观察。
1.2.6 脂肪间充质干细胞的分离培养[8]
手术剪和镊子用0.1%新洁尔灭浸泡消毒,大鼠断颈处死后,在75%酒精中浸泡3 min, 无菌条件下取大鼠蹊部脂肪组织,在加有双抗的PBS中洗3次以去除残余的血迹,分离可见的血管和纤维成分,将组织剪碎后,加入与脂肪组织等体积的0.1%的Ⅰ型胶原酶,37℃消化40~60 min, 加入与Ⅰ型胶原酶等体积的含10%胎牛血清的L-DMEM培养基终止消化,过滤,1600 r/min离心8 min,弃上清,加入适量L-DMEM培养基(含15% 胎牛血清,100 U/mL 青霉素,100 U/mL 链霉素),以1×106接种于T-25培养瓶中,置37℃,5% CO2细胞培养箱中培养,4 d后换液。
待单层贴壁细胞贴壁率接近90%时,体积分数为0.25%胰蛋白酶-4%EDTA消化细胞,按1∶2的比例传代培养。每3~4 d传代1次。
1.2.7 rASCs多向分化潜能鉴定[9]
1)成脂诱导。rASCs贴壁率接近90%时,按照图1所示流程,诱导21 d后,弃去培养液,细胞经PBS洗涤后,4%多聚甲醛室温固定20 min,PBS 洗涤细胞2 次,3%油红O工作液避光染色30 min,PBS 洗涤,于光学显微镜下直接观察。

图1 rASCs成脂诱导流程
2)成骨诱导。rASCs贴壁率接近70%后,加入成骨诱导培养液(含有10% 胎牛血清+100 U/mL青霉素+100 U/mL链霉素+10 nmol/L地塞米松+10 mmol/Lβ-磷酸甘油钠+150 μmol/L L-抗坏血酸的DMEM/F12)。以后每4 d按以上配方换1次溶液。成骨诱导至第21 d后,使用ALP检测试剂盒对诱导细胞进行碱性磷酸酶活性鉴定。
1.2.8 Ad-PDX-1感染rASCs及PDX-1在细胞中的表达
按 2.0×106/孔的接种密度将rASCs接种于六孔培养板,当细胞汇合达到80%时,按照MOI=5.0加入相应量的Ad-PDX-1病毒液,同时设立无腺病毒感染的ASCs对照组。48 h后,分别以P1,P2为引物,RT-PCR方法检测目的基因PDX-1在rASCs中的转录情况,先用RNA快速提取试剂盒提取实验组及对照组细胞总RNA,反转录合成cDNA, 再以cDNA为模板做PCR,反应体系及条件如1.2.1中所述。同时,以免疫荧光法及Western blotting检测PDX-1目的蛋白在rASCs中的表达情况。另外,检测病毒感染rASCs 21 d时的表达情况,以验证病毒在细胞中的持续表达能力。
1)免疫荧光检测。分别将实验组及对照组细胞爬片,先用PBS洗2次,再用-20℃预冷的纯甲醇于4℃固定10 min, PBS洗3次,2% BSA 37℃封闭30 min,加入兔抗大鼠PDX-1一抗,4℃孵育过夜,PBS洗3次,FITC标记的羊抗兔二抗37℃孵育1 h,PBS洗3次,取出细胞爬片,滴加甘油封片,荧光显微镜下于激发波长488 nm,放大倍数200倍下观察结果。
2)Western Blotting检测。用RIPA裂解实验组及对照组细胞获得细胞蛋白液,取50 μL蛋白液与10 μL 5×上样缓冲液混合,100℃变性10 min,12% SDS-PAGE胶电泳分离,电转移至0.22 μm孔径的硝酸纤维素膜,在体积分数为5%脱脂奶粉/TBST的封闭液中,室温封闭1 h,TBST漂洗3次,加入兔抗大鼠PDX-1一抗,4℃振荡过夜。TBST漂洗3次,每次15 min, 加入HRP标记的羊抗兔二抗,室温振荡1 h后TBST漂洗3次,化学显色。β-actin做内参。
2 结果
2.1 PCR获取大鼠PDX-1基因
以pUC57-PDX-1质粒为模板,以P1,P2为引物,PCR特异性扩增大鼠PDX-1基因,PCR产物经1%琼脂糖凝胶电泳,电泳结果显示大小约为852 bp的特异性条带,该条带为PDX-1基因的特异扩增产物(见图2)。
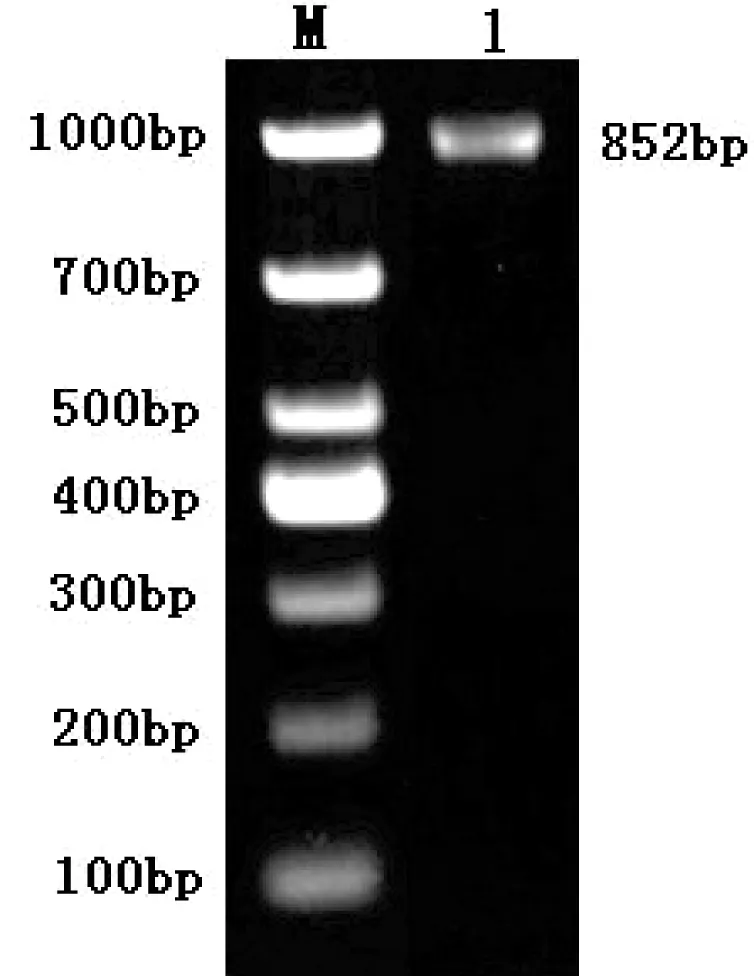
M—DL1000 DNA Maker; 1—大鼠PDX-1基因。
2.2 酶切鉴定重组腺病毒质粒
SalⅠ与NotⅠ双酶切pShuttle-CMV-PDX-1,阳性克隆产物为2条带,大小分别为7500 bp、852 bp,见图3A。pAdEasy-CMV-PDX-1用PacⅠ酶切,阳性克隆产物为2条带,且小片段长度为3.0 kb或4.5 kb,本实验筛选出的是4.5 kb的阳性克隆,见图3B。所有酶切结果均与理论预期一致,表明PDX-1序列已成功插入pAdEasy-1载体中,且连接正确。

M—DL10000 DNA Maker;A—SalⅠ和NotⅠ双酶切pShuttle-CMV-PDX-1结果;B—PacⅠ酶切pAdEasy-CMV-PDX-1结果。
图3构建的相关载体酶切鉴定结果
Fig 3 The results of enzyme cutting related vectors
2.3 腺病毒Ad-PDX-1的形态学观察及滴度测定
PacⅠ酶切线性化pAdEasy-CMV-PDX-1质粒,用Lipofectamine2000脂质体转染HEK293细胞,7~10 d后,细胞聚集、细胞间隙增大、变圆、呈葡萄状,见图4。待大部分细胞病变后,反复冻融3次,收集病毒液。透射电镜观察复染的病毒颗粒,形态正常,直径约为70~90 nm, 符合典型的腺病毒的20面体对称结构,见图5。重组腺病毒感染HEK293细胞24 h, 48 h及72 h后,细胞超薄切片结果表明,病毒感染后细胞形态开始变圆、皱缩、呈现不规则形,细胞核较小,在细胞中分布有较多的腺病毒颗粒,并且随着感染时间的增加,胞质中的腺病毒颗粒也变多,见图6。在重复扩增,收集病毒后,用Reed-Munench法测定重组腺病毒Ad-PDX-1的感染性滴度为107CCID50/mL, 见图7。

A、B、C分别为转染7 d、9 d、10 d时的细胞形态。

图5 透射电镜观察重组腺病毒负染结果

A、B、C分别为腺病毒感染HEK293细胞24 h、48 h、72 h后细胞超薄切片结果。
图6重组腺病毒感染HEK293细胞后超微结构观察
Fig 6 Ultrastructural characteristics of HEK293 cells which were transfected by recombinant adenovirus after 24 hours
2.4 多向分化潜能鉴定结果
经成脂诱导后的rASCs,形态由长梭形逐渐变圆,呈短圆梭形、椭圆形。诱导8 d后,在光镜下可以看见折光性强的空泡提示脂滴开始形成,见图8A。诱导21 d后的细胞经油红O 染色,可见胞浆内有大量被染成红色的脂滴,见图8B,对照细胞始终未见被染色脂滴,见图8C,说明rASCs在体外具有向脂肪细胞分化的潜能。

图7 病毒滴度测定结果
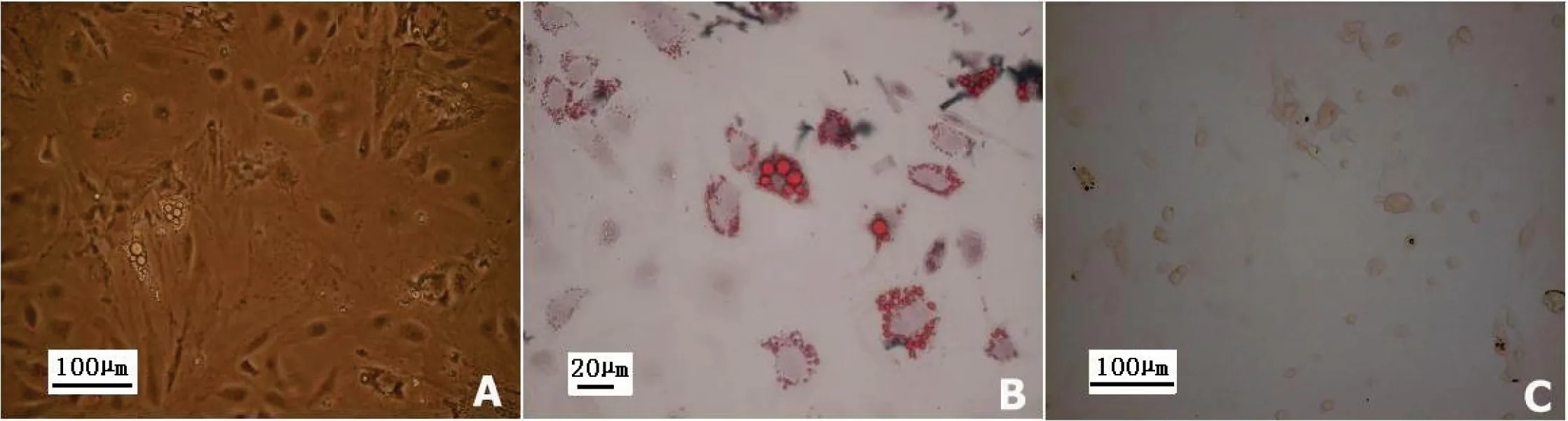
图8 rASCs的成脂诱导分化
经成骨诱导后的rASCs,细胞出现聚集生长的倾向,呈多层网状生长,见图9A。诱导21 d后,对细胞进行碱性磷酸酶(ALP)染色,ALP是成骨细胞分化的代表性酶,ALP 作为成骨细胞表型特征之一,在体外钙化中起关键性作用,随其升高的同时出现大量钙盐的沉积,ALP 活性越高,说明细胞向成骨细胞分化越明显,实验中诱导后细胞可以看见胞浆被染成蓝黑色,见图9B,对照组细胞中则无明显着色,见图9C。说明rASCs在体外具有向成骨细胞分化的潜能。

图9 rASCs的成骨诱导分化
2.5 Ad-PDX-1感染rASCs后,PDX-1的表达情况
感染Ad-PDX-1的rASCs在48 h后可检测到PDX-1基因的转录,而对照组则无PDX-1基因的转录(图10)。免疫荧光法和Western blotting法均检测到实验组rASCs中转录因子PDX-1的高表达,而在对照组中则检测不到其表达(图11和图12)。且病毒感染rASCs 21 d后,仍能检测到PDX-1的转录与表达。

M—DL1000 DNA Maker; 1、3、5—分别为内参β-Actin 的转录情况; 2、4—分别为Ad-PDX-1感染rASCs 48 h、21 d后,PDX-1转录情况; 6—rASCs对照组PDX-1转录情况。
图10 PDX-1在实验组及对照组中的转录情况
Fig 10 The transcription of PDX-1 in the experimental group and the control group

A1A2—Ad-PDX-1感染rASCs 48 h后,PDX-1表达情况(200×) ;B1B2—rASCs对照组PDX-1表达情况(200×)。
图11免疫荧光法检测PDX-1的表达情况
Fig 11 The expression of PDX-1 protein detected by immunofluorescence

1—rASCs对照组; 2—Ad-PDX-1感染rASCs 21 d; 3—Ad-PDX-1感染rASCs 48 h。
图12 Wsetern blotting法检测PDX-1的表达情况
Fig 12 The expression of PDX-1 protein detected by Wsetern blotting
3 讨论
脂肪间充质干细胞因含量丰富,易于分离,因而受到广泛关注[10]。本研究通过I型胶原酶消化法,连续传数代后,可成功从脂肪中获取高纯度的rASCs。rASCs的基本特征为:贴壁生长,细胞呈纤维状,旋涡排列。细胞多向分化潜能鉴定表明,rASCs可以分化为脂肪细胞和成骨细胞,这一结果证实了其具有较强的可塑性和多向分化潜能,符合间充质干细胞的基本特征。
近年研究发现ASCs不仅具有多向分化潜能,在血糖平衡及激素产生方面也具有重要作用[7],在治疗糖尿病方面的研究也越来越多。腺病毒因其基因组重排频率低,安全性较好,插入大片段外源性基因的潜力大,有较大的宿主范围,外源基因表达水平较高等优点[11]倍受研究者喜爱。本研究选用的腺病毒载体为人腺病毒5型,即复制缺陷型腺病毒。首先我们将PDX-1基因片段插入到pShuttle-CMV载体中,通过同源重组的方法,获得了pAdEasy-PDX-1重组腺病毒质粒。酶切鉴定与测序结果显示目的基因片段PDX-1成功克隆至载体的多克隆位点。脂质体法转染HEK293细胞,转染7 d细胞开始变圆,聚集,呈葡萄状,即出现典型的细胞病变效应。病毒复染后电镜观察,可见直径约为70~90 nm, 呈20面体对称结构的病毒颗粒,符合典型的腺病毒特征。病毒感染HEK293细胞后,分时间段收集细胞,细胞超薄切片表明包装获得的腺病毒颗粒在HEK293细胞中成功扩增。连续传代3到4次,获得大量具有稳定感染性的重组腺病毒Ad-PDX-1,传至第3代,病毒滴度达107CCID50/mL,已满足本实验需要。
酶切鉴定结果及测序结果均表明,该重组腺病毒载体含有PDX-1基因片段,且插入顺序完全正确。为进一步研究重组腺病毒Ad-PDX-1对rASCs的感染效率及目的基因在rASCs内的表达情况,用Ad-PDX-1感染rASC 48 h后,通过RT-PCR、免疫荧光、Western blotting等证实,Ad-PDX-1对rASCs具有很高的感染能力,当细胞的病毒感染复数(MOI)为5.0时,有90%以上的细胞被感染,说明Ad-PDX-1对rASCs具有较强的感染能力。免疫荧光结果证实,PDX-1目的产物能特异定位于细胞核内,说明所构建的腺病毒Ad-PDX-1表达的目的基因PDX-1具有核定位等转录因子共有的基本生物活性。RT-PCR及Western blotting结果表明,Ad-PDX-1感染rASCs 21 d后仍能检测到PDX-1的转录及表达,为后续将大鼠脂肪间充质干细胞向胰岛β细胞诱导分化奠定了基础,为糖尿病的干细胞治疗提供依据。
参考文献:
[1]唐小龙, 江振友, 庞雪云, 等.NGN3与PAX4双基因表达腺病毒载体的构建与表达[J].暨南大学学报: 医学报, 2010, 31(4), 346-351.
[2]Serafimidis I, Rakatzi I, Episkopou V, et al.Novel effectors of directed and Ngn3-mediated differentiation of mouse embryonic stem cells into endocrine pancreas progenitors[J]. Stem Cells, 2008, 26: 3-16.
[3]Hald J, Sprinkel A E, Ray M, et al. Generation and characterization of Ptf1a antiserum and localization of Ptf1a in relation to Nkx6. 1 and PDX-1 during the earliest stages of mouse pancreas development. [J]. Histochem Cytochem, 2008, 56: 587-595.
[4]Serafimidis I, Rakatzi I, Episkopou V, et al. Novel effectors of directed and Ngn3-mediated differentiation of mouse embryonic stem cells into endocrine pancreas progenitors[J]. Stem Cells, 2008, 26: 3-16.
[5]Johansson A, Dursun U, Jordan N.Temporal control of neurogenin3 activity in pancreas progenitors reveals competence windows for the generation of different endocrine cell types[ J]. Dev Cell, 2007, 12(3): 457-465.
[6]Mellitzer G, Bonne S, Luco R F.IA1 is NGN3-dependent and essential for differentiation of the endocrine pancreas[J]. EMBO J, 2006, 25(6): 1344-1352.
[7]Yanai G, Hayashi T, Zhi Q.Electrofusion of mesenchymal stem cells and islet cells for diabetes therapy: a rat model[J].Plos One, 2013, 5(8):1-10.
[8]Zhou Y, Sun M, Li H, et al.Recovery of behavioral symptoms in hemi-parkinsonian rhesus monkeys through combined gene and stem cell therapy[J].Cytotherapy, 2013, 15(4):467-480.
[9]Yan M, Sun M, Zhou Y, et al.Conversion of human umbilical cord mesenchymal stem cells in Wharton’s jelly to dopamine neurons mediated by the Lmx1a and neurturin in vitro: potential therapeutic application for Parkinson’s disease in a rhesus monkey model[J]. 2013, 28, 8(5):e64000.
[10]Zuk P A, Zhu M, Ashjian P, et al.Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002, 12: 4279-4295.
[11]范凌云, 谢庆军.腺病毒载体的研究进展[J].中国生物制品学杂志,2008, 2(21):153-157.
