人乙醛脱氢酶2的原核表达及其活性的鉴定
2014-03-22黄娟王荷花张小骥潘博宇陈孝平吴元欣
黄娟 王荷花 张小骥 潘博宇 陈孝平 吴元欣
(武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,武汉 430073)
人乙醛脱氢酶2的原核表达及其活性的鉴定
黄娟 王荷花 张小骥 潘博宇 陈孝平 吴元欣
(武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,武汉 430073)
商品化的乙醛脱氢酶主要从动物细胞、肝细胞线粒体中提取,其来源受到很大的限制,而且价格昂贵。为了解决乙醛脱氢酶原料有限的问题,利用微生物发酵法获取乙醛脱氢酶。 将人乙醛脱氢酶2基因(aldh2)克隆至原核表达载体pET32a中,构建重组载体pET32a-ALDH2。将构建的重组载体转化大肠杆菌E.coli BL21(DE3),用异丙基硫代-β-D-半乳糖苷(IPTG)进行诱导,SDS-PAGE电泳结果显示目的蛋白得到大量表达;且对诱导表达条件进行优化。结果显示,在37℃,1.0 mmol/L IPTG诱导表达6 h为最优表达条件。由于目的蛋白几乎都是以包涵体形式表达,为了得到有活性的乙醛脱氢酶,对包涵体变性、复性和纯化进行了研究。试验数据显示,酶的最终得率为14.49 U/L。并通过用Bradford法,测定复性蛋白的浓度约为77 μg/mL,进行活性检测表明,该复性蛋白具有乙醛脱氢酶活性,酶活性约为1.449 U/mL。通过构建重组载体pET32a-ALDH2和优化表达条件,aldh2在原核表达宿主E.coli BL21(DE3)得到大量表达;此外,利用透析复性法得到的复性蛋白酶活性有所提高。
乙醛脱氢酶2 克隆 条件优化 酶活鉴定
人体内的乙醛脱氢酶主要有乙醛脱氢酶1(aldh1)和乙醛脱氢酶2(aldh2)两种,乙醛的氧化主要是依靠二者来完成,而aldh2对乙醛的活性要高出aldh1的50倍[1]。aldh2是乙醛脱氢酶的一
种,是人体酒精代谢的关键[2]。它在人体的主要作用是将人体内的酒精代谢后产生的乙醛脱氢氧化为无毒的乙酸,乙酸再进入TCA循环代谢为二氧化碳和水。在整个代谢过程中,乙醛脱氢酶是限速酶[3]。有研究报道,乙醛对人体有致癌作用,它与人类肿瘤的发生也有关系[4]。饮酒是食道癌的危险因素之一[5-7]。当人过量饮酒时,酒精的代谢产物乙醛不能及时被氧化,就会在体内积累,容易诱发肝癌[8]。由于aldh2在代谢乙醛中催化效率最高,所以aldh2在乙醛脱氢酶的研究中受到人们更广泛的关注。
目前,商品化的乙醛脱氢酶主要是从动物肝脏、肝细胞线粒体中提取,资源很有限且价格昂贵,大规模生产困难。获得乙醛脱氢酶比较传统的方法主要是从微生物体内提取,Zarnt教授[9]利用四氢呋喃甲醇培养基培养Ralstonia eutropha,并分离纯化出了乙醛脱氢酶。香港中文大学的Wing-Ping Fong和Ka-Fai Choy教授[10]提出了一种以草鱼的内脏为原材料,从其线粒体内分离提取aldh2的方法。该方法对原料进行匀浆混合预处理后依次通过高速离心分离,超滤浓缩并使用柱层析后得到比活为4.46 U/mg的aldh2。为了解决乙醛脱氢酶资源有限的问题,许多科研工作者都试图从微生物的发酵来获取大量的乙醛脱氢酶。黄坤等[11]利用毕氏酵母分泌表达aldh2时,在优化的诱导条件下可制备大量aldh2,但由于酵母的生长周期比较长,所以得到的目的蛋白的活性最高只能达到0.115 U/mL。赵锦等[12]也曾尝试过在酵母中表达乙醛脱氢酶,经分离纯化后的乙醛脱氢酶液的酶活为0.994 U/mL。由于受酵母本底表达的影响,导致乙醛脱氢酶的表达量很少,而且表达出来的酶活性较低。
本研究通过更换表达载体和宿主菌来提高乙醛脱氢酶的表达量,即用原核表达载体pET32a在原核表达宿主E.coli BL21(DE3)中表达乙醛脱氢酶,并对表达条件进行优化。由于目标蛋白是以包涵体的形式表达,为了得到有活性的蛋白,所以对包涵体变性、复性和纯化,并对复性蛋白的活性进行研究。
1 材料与方法
1.1 材料
1.1.1 试剂 高保真酶Pyrobest DNA Polymerase,限制性内切酶Nde I、Pst I、Xho l、Sma I、EcoR V、EcoR I、T4 DNA Ligase、1 kb和500 bp DNA Marker购自TaKaRa公司;质粒小提试剂盒购自天根生物公司;琼脂糖凝胶、低溶点琼脂糖凝胶、IPTG、TEMED购自Sigma公司;蛋白分子量标准、丙烯胺购自北京普利莱公司;巯基乙醇、β-NAD、BSA购自Amresco公司;Ni-NTA Agarose购自Invitrogen公司。
1.1.2 菌株、质粒和培养基 用于分子克隆的宿主E.coli DH5α,用于表达的宿主E.coli BL21(DE3)由本实验室保存。原核克隆载体pBluescriptSKII和原核表达载体pET32a本实验室保存。带有aldh2基因的克隆载体pUC57-6His-ALDH2由本实验室构建保存。LB培养基(胰蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L;固体培养基添加1.5%琼脂粉)用于大肠杆菌的培养。
1.2 方法
1.2.1 原核表达载体的构建
1.2.1.1 重组载体pBluescriptSKII-aldh2的构建 以pUC57-6His-aldh2为 模 板,P1(5'-AAACATATGTCAGCCGCCGCCACCCAG-3'),P2(5'-AAACTCGAGTGAGTTCTTCTGAGGCACTTT-3')为引物,PCR扩增aldh2片段,再用低熔点胶回收目的片段[13]。将碱裂解法[14]提取的质粒pBluescriptSKII用限制性内切酶EcoR V作单酶切后,低熔点胶回收。回收后的目的片段和载体用T4连接酶16℃过夜连接,连接产物转化E.coli DH5α感受态细胞,蓝白斑筛选重组子[15]。对阳性重组子进行蓝白斑初选后,为了进一步确认阳性结果,对其中一个菌做酶切鉴定。
1.2.1.2 表达载体pET32a-aldh2的构建 将质粒pBluescriptSKII-aldh2和表达载体pET32a分别用限制性内切酶Nde 1和Xho I双酶切,将切下的1 500 bp目的片段和载体pET32a片段用低熔点胶回收后,再用T4连接酶16℃过夜连接,连接产物转化E.coli DH5α感受态细胞,转化的菌种涂于含氨苄青霉素的平板,过夜培养后,挑取单菌落用PCR菌落法[16]筛选重组子,再进行酶切鉴定及DNA测序验证。
1.2.2 原核表达载体pET32a-aldh2的诱导表达 将阳性克隆接种于LB液体培养基(含50 μg/mL的AMP),37℃过夜培养,用碱裂解法提取质粒。重组
质粒pET32a-aldh2转化100 μL BL21(DE3)感受态细胞,构建工程菌。
取1 mL过夜培养的工程菌至100 mL LB液体培养基中,37℃ 200 r/min振荡培养,待OD600nm=0.5时,分别加入终浓度为0.1、0.5和1.0 mmol/L IPTG,30℃和37℃诱导表达6 h。将菌液离心,弃上清,用PBS缓冲液重悬菌体,在沸水中煮10 min。用SDS聚丙烯酰胺凝胶电泳检测aldh2是否表达。
1.2.3 乙醛脱氢酶活性的研究
1.2.3.1 收集包涵体 取2 mL过夜培养的工程菌接种于200 mL LB液体培养基中,37℃ 200 r/min振荡培养,待OD600nm=0.5时,加入IPTG的终浓度为1 mmol/L,37℃诱导表达6 h,收集诱导表达的菌体,离心弃上清,用PBS缓冲液洗涤菌体3次后,20 mL PBS缓冲液重悬细菌,在超声波破碎仪下破碎25 min(功率300 W,工作2 s,间歇4 s),然后于4℃ 1 200 r/min下离心30 min弃上清,包涵体洗涤缓冲液洗涤两次后再用蒸馏水洗涤两次,离心,收集包涵体。
1.2.3.2 包涵体的变性、复性和纯化 将收集的包涵体溶于4 mL包涵体溶解缓冲液(8 mol/L脲,50 mmol/L Tris,1 mmol/L EDTA,100 mmol/L NaCl,pH8.0)中,室温振荡1 h,离心15 min收集上清。对于变性蛋白的复性,采取了透析复性法:上清放入预先处理好的透析袋中,依次将透析袋放入6、4、3、2以及1 mol/L尿素复性缓冲液中,分别在4℃下透析3 h。最后在PBS缓冲液中过夜透析,收集复性蛋白。由于表达载体pET32a带有6His融合标签,所以本试验用Ni-NTA树脂纯化重组蛋白。将透析复性的蛋白经过预先处理的镍柱,在4℃下结合1 h,再用不同浓度的咪唑洗脱液洗脱柱子,收集洗脱液(含目的蛋白)做电泳检测。
1.2.3.3 重组蛋白的酶活检测 采用考马斯亮蓝法(Bradford法)测定粗酶液中蛋白的含量。由于NAD+、NADH分别在260 nm、340 nm处有最大的吸收峰,故酶、辅酶NAD+和底物在一定条件下反应,通过测定一定时间340 nm吸光度的变化值,可以计算出NAD+转化为NADH的量,根据酶活的定义计算得到该酶的酶活。酶活性测定方法见文献[17],测定体系是对Okibe反应体系[18]的改进,按表1设计酶活测定体系。

表1 酶活测定反应体系
最后加入酶液后,立即混匀,迅速倒入比色皿中,在340 nm处测定光吸收变化值(每分钟测定一个吸光值)。酶活的定义:最适条件下,每分钟转化1 μmol底物为1个活力(U),可得到反应体系里ALDH2的酶活计算公式为:
2 结果
2.1 乙醛脱氢酶2(aldh2)基因的克隆
以pUC57-6His-aldh2为模板,上述设计的P1、P2为引物,扩增aldh2片段,以1.0%琼脂糖凝胶电泳检测,发现1 500 bp处有明显的条带(图1),与预期的aldh2基因大小一致。
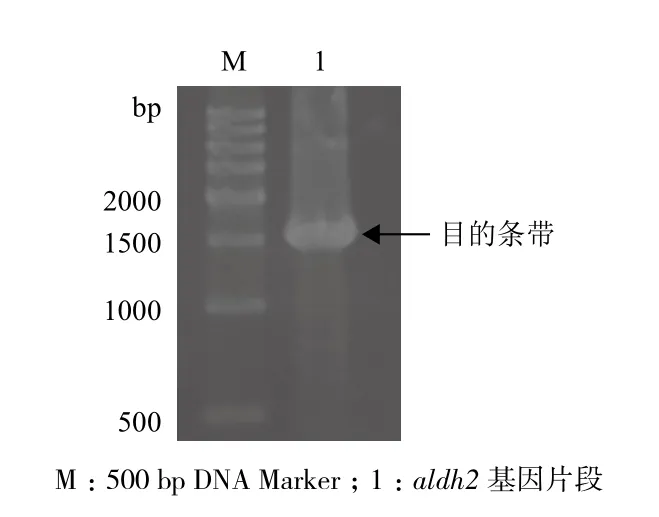
图1 aldh2基因扩增产物
2.2 pBluescriptSKII-aldh2重组子的筛选及酶切鉴定
将扩增的aldh2片段和经EcoR V酶切的pBluescriptSKII用低熔点胶回收后,16℃过夜连接,
再将连接产物转化DH5α感受态细胞后涂布于有IPTG和X-gal的筛选平板上,过夜培养。挑取白斑分别做两组酶切,即Sma I单酶切,Nde I和Xho I双酶切,鉴定为阳性克隆(图2)。

图2 重组载体pBluescriptSKII-aldh2构建(A)及酶切鉴定图(B)
2.3 pET32a-aldh2重组子的筛选及酶切鉴定
将用菌落PCR鉴定的阳性重组子pET32a-aldh2分别做两组酶切,即Pst I单酶切,Nde I和Xho I双酶切,试验结果与预期一致,鉴定为阳性克隆(图3)。将重组子测序,以T7 Promoter Primer为引物。对测序结果进行分析,测得序列与NCBI上公布的aldh2基因序列一致。测序结果表明,aldh2基因已成功构建到pET32a载体上。

图3 重组载体pET32a-aldh2构建(A)及酶切鉴定图(B)
2.4 重组蛋白的诱导表达及纯化
2.4.1 重组蛋白诱导表达条件的优化 分别从温度和IPTG浓度两个因素来优化表达条件。离心收集菌体,SDS-PAGE检测分析全菌蛋白的表达,如图4所示,几组不同的诱导条件,全菌蛋白中均含有大约为55 kD诱导蛋白,与预期的乙醛脱氢酶的分子量一致。随着IPTG浓度的增加,乙醛脱氢酶的表达量明显增多,且37℃表达组明显优于30℃表达组。而且试验还从诱导时间进行优化,在37℃,IPTG浓度为1.0 mmol/L,分别对诱导表达2、4、6和8 h的蛋白进行电泳检测分析(图5),随着诱导时间的增加,蛋白的表达量也随之增加。
2.4.2 重组蛋白的纯化 由于目的蛋白是以包涵体的形式表达,所以要得到具有生物活性的乙醛脱氢酶,需要对包涵体进行变性,复性和纯化才能检测其活性。将收集的包涵体溶于适量包涵体溶解缓冲液后,离心收集上清液,即得到变性的重组蛋白。变性的重组蛋白采用透析复性法复性后,收集复性蛋白。再将复性蛋白经过预先处理的镍柱,4℃下结合1 h,分别用10、20、40、60、80、100和200 mmol/L 咪唑洗脱液洗柱,并收集洗脱液。如图6所
示,当咪唑的浓度为60 mmol/L时,目的蛋白开始被洗脱,且随着咪唑浓度的增加蛋白被大量洗脱。将图中6-9号的洗脱液合并,得到粗酶液。为除去粗酶液中的盐离子,将其在60 mmol/L咪唑缓冲液中4℃过夜透析。
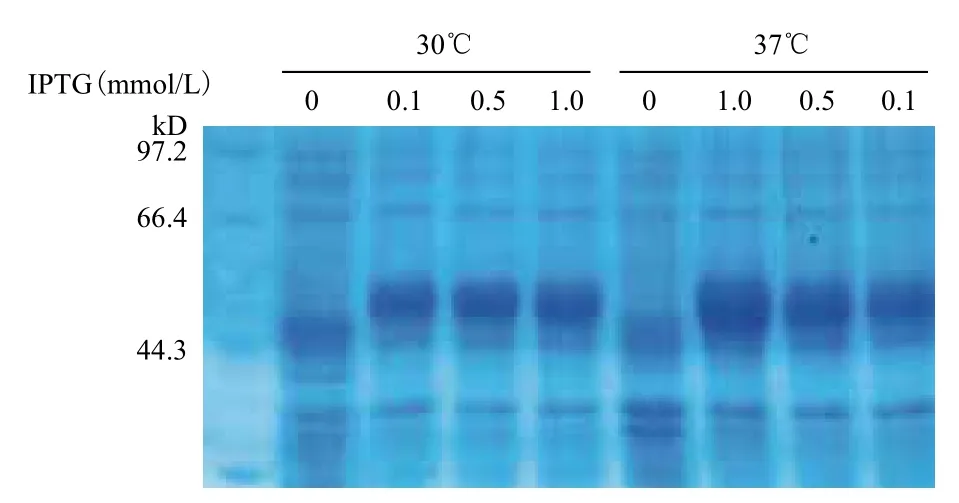
图4 不同诱导表达条件的电泳图

图5 不同诱导时间下的蛋白表达量
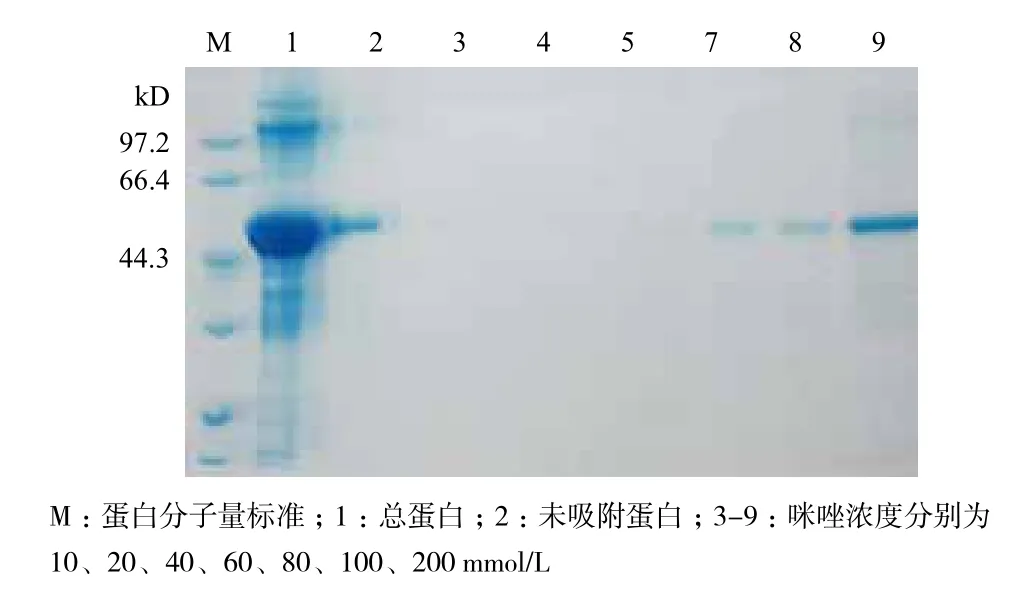
图6 目标蛋白在不同浓度咪唑洗脱液中的分布
2.5 重组蛋白的酶活性检测
试验对透析复性法得到的重组蛋白进行酶活性测定。在酶活测定体系中,总反应体系为3 mL,加入的酶液为10 μL,每分钟读取1次A340,以OD340对反应时间作图(图7)。

图7 蛋白酶活性测定
取反应曲线的5-10 min内,计算每分钟内OD340的减少值。根据活力单位U的定义(最适条件下,每分钟转化1 μmol底物为1个活力单位),计算A340的变化约为0.03 mim-1,则反应体系里ALDH2的酶活为10 μL的原酶液里有0.014 49 U,那么得到粗酶液的酶活为1.449 U/mL。最终得到的粗酶液为2 mL,发酵液的总体积为200 mL,则酶的最终得率为14.49 U/L,即每单位体积发酵液中活得的酶活力。
3 讨论
在大肠杆菌表达系统中,大部分表达载体采用诱导型启动子控制目的基因的表达。诱导型启动子能控制基因在特定时期、特定部位表达,这既避免了目的基因在宿主细胞内高表达对宿主细胞生长的影响,又可减少菌体蛋白酶对目标产物的降解。本试验采用pET32a表达载体,在IPTG诱导下目的蛋白得到大量表达。此外,表达载体上带有6个组氨酸标签,有利于下游蛋白的纯化。由于目的蛋白是以包涵体形式表达,试验对包涵体的变性,复性和纯化做了研究,并对复性蛋白的酶活性进行鉴定。研究结果有以下两点:(1)对于重组蛋白的复性,尝试了稀释复性法、透析复性法和柱上复性法,但结果显示透析复性法得到的乙醛脱氢酶活性要高于其他两种方法。(2)通过酶活性检测,复性后蛋白的活力为1.449 U/mL,而赵锦等在酵母中表达乙醛脱氢酶,经分离纯化后的乙醛脱氢酶液的酶活为0.994 U/mL。本试验中发酵液总体积为200 mL,得到的粗酶液为2 mL,则酶的最终得率为14.49 U/L。其他研究人员利用酵母表达并分离纯化了乙醛脱氢酶,酶的最终得率仅为11.35 U/L[19],并且该酶的表达量偏低[11],可能原因是:(1)酵母表达的外源蛋白在内质网中的聚集造成分泌蛋白减少[20];(2)
酵母发酵过程中培养基pH值的变化使得酵母蛋白酶的活性较强,从而导致了外源蛋白的降解[21,22]。本试验获得了较高的乙醛脱氢酶的酶活力和表达量,所以运用基因工程表达乙醛脱氢酶,原核表达系统要优于酵母表达。但是原核表达乙醛脱氢酶时,虽然优化了多种表达条件(如温度,IPTG浓度,培养时间,振荡速度等),均无法获得可溶性的表达产物(结果未展示),而采用变性和复性的技术手段不可避免的导致酶活性的损失和得率的下降。更换表达载体或者进行融合蛋白的表达,可能是解决原核表达乙醛脱氢酶形成包涵体的有效途径之一。
[1]Vasiliou V, Pappa A, Petersen DR. Role of aldehyde dehydrogenases in endogenous and xenobiotic Metabolism[J]. Chemico-Biological Interactions, 2000, 12(9):1-19.
[2]维莉. 酒与化学[J]. 化学教学, 1999, 12:38-39.
[3]刘非凡, 唐瑛, 陈忠庆. 地塞米松治疗双硫仑样反应的临床和实验研究[J]. 内科急危重症杂志, 2008, 4(12):197-205.
[4]Yokoyama A, Muramatsu T, Ohmori T. Esophageal cancer and aldehyde dehydrogenase2 genotypes in Japanese male[J]. Cancer Epidemiolog, Biomarkers & Prevention, 1996, 5(6):99-104.
[5]Yang CX, Matsuo K. Esophageal cancer risk by ALDH2 and ALDH2 polymorphisms and alcohol consumption:exploration of geneenvironment and gene-gene interactions[J]. Asian Pacific of Journal Cancer Prevention, 2005, 6(3):256-262.
[6]Yoshibara E, Ameno K, Nakamura K. The effects of the ALDH2*1/*2, CYP2E1 C1/C2 and C/D genotypes on blood ethnol eliminatio[J]. Drug Chemical Toxico, 2000, 23(2):371-379.
[7]Crabb DW, Edenberg HJ, Bosron WF. Genotypes for aldehyde dehydrogenase deficiency and alcohol sensitivity:the inactive ALDH2*2 allele is dominant[J]. The Journal of Clinical Investigation, 1989, 83(1):314-318.
[8]Mizoi Y, Yamamoto K, Ueno Y. Involvement of genetic polymorphism of alcohol andaldehyde dehydrogenases in individual variation of alcohol metabolism[J]. Alcohol, 1994, 29(3):707-712.
[9]Schrader T, Zarnt G. NAD(P)-dependent aldehyde dehydrogenase induced during growth of Ralsstonia eutropha strain be on tetrahydrofuryl alcohol[J]. Journal of Bacteriology, 2001, 183(24):408-411.
[10]Fong WP, Choy KF. Purification and characterization of grass carp mitochondrial aldehyde dehydrogenase[J]. Chemico-Biological Interactions, 2001, 130(3):161-171.
[11]黄锟, 赵玉凤. 人乙醛脱氢酶基因在毕赤酵母SMDl168中的表达研究[J]. 中国医学生物技术, 2009, 25(1):44-48.
[12]赵锦, 赵玉凤. 人乙醛脱氢酶2基因在毕赤酵母中的高效表达[J]. 化学与生物工程, 2010, 27(2):50-56.
[13]龙彩虹, 吴少庭. 弓形虫表面抗原SAG2基因片段的克隆与原核表达[J]. 中国人兽共患病杂志, 2003, 19(12):91-97.
[14]萨姆布鲁克J, 拉塞尔DW. 分子克隆实验指南[M]. 北京:科学出版社, 2003:7408-7411.
[15]谢宝童, 李涛. 在L-3Loop cDNA细胞内载体的构建和识别人类的血管内皮生长因子受体[J]. 肿瘤研究与临床, 2007, 19(2):47-53.
[16]庄东红, 欧阳永长. 苦瓜MAP30基因功能性片段的克隆和表达[J]. 遗传, 2004, 26(5):701-704.
[17]Lee KH, Kim HS, Jeong HS. Chaperonin GroESL mediates the protein folding of human liver mitochondrial aldehyde dehydrogenase in Escherichia coli[J]. Biochemical and Biophysical Research, 2002, 298(2):216-224.
[18]Okibe N, Amada K, Hirano S. Gene cloning and characterization of aldehyde dehydrogenase from a petroleum-degrading bacterium strain HD-1[J]. Journal of Bioscience and Bioengineering, 1999, 88(1):7-11.
[19]陈瑞, 方剑, 王静涵. 乙醛脱氢酶2基因在毕氏酵母中的表达和分离纯化[J]. 生物加工过程, 2013, 11(6):7-11.
[20]Hohenblum H, Borth N, Mattanovich D. Assessing viability and cell-associated product of recombinant protein producing Pichia pastoris with flow cytometry. 2003, 102(3):281-290.
[21]李鹏飞, 孙红兵, 游丽金. 利用毕赤酵母系统直接分泌表达具有活性的谷氨酰胺转胺酶[J]. 生物工程学报, 2013, 29(2):180-188.
[22]林俊涵. 毕赤酵母高密度发酵工艺的研究[J]. 中国生物工程杂志, 2009, 29(5):120-125.
(责任编辑 李楠)
Expression and Activity Assay of Human Aldehyde Dehydrogenase2 in Escherichia coli
Huang Juan Wang Hehua Zhang Xiaoji Pan Boyu Chen Xiaoping Wu Yuanxin
(School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Key Laboratory for Green Chemical Process of Ministry of Education,Wuhan 430073)
The commercial acetaldehyde dehydrogenase is mainly extracted from animal cell and hepatocellular mitochondria. Source is limited and the cost is high. So the micobiological fermentation was used to obtain large amounts of aldh2, which had been cloned into the expression vector pET32a with 6His tag that was advantageous to purify the recombinant protein by nickel-chelate chromatography, then the recombinant was transformed into E.coli BL21(DE3). After induced by IPTG, the recombinant protein had been expressed and their molecular masses were determined to be approximately 55 kD by SDS-PAGE. Through the optimization of inducing expression conditions, the results showed that the condition(37℃, 1.0 mmol/L IPTG, induced for 6 h)is the optimal. Because all target protein were almost expressed in the form of inclusion body, the bioactive acetaldehyde dehydrogenase was obtained by means of degeneration, purification and renaturation for the inclusion body, and measured the concentration of the renaturated protein by the Bradford method that was 77 μg/mL. Experimental data showed that the final yield of enzyme was 14.49 U/L. Activity tests showed that the protein has the acetaldehyde dehydrogenase activity of about 1.449 U/ mL. By constructing a recombinant vector pET32a-ALDH2 and optimizing the expression condition, aldh2 in prokaryotic expression host get a lot of expression. In addition, the activity of renaturation protein was improved by the dialysis renaturation method.
aldh2 Cloning Condition optimization Activity assay
10.13560/j.cnki.biotech.bull.1985.2014.12.034
2014-05-26
国家自然科学基金项目(81172178)
黄娟,女,硕士研究生,研究方向:微生物发酵及下游产物的分离;E-mail:huangjuan412@foxmail.com
吴元欣,男,博士,教授,研究方向:微生物发酵及下游产物的分离;E-mail:wyx@mail.wit.edu.cn
