4-硝基酚对大鼠肝脏的毒性及氧化损伤
2014-03-22宋美艳张永辉朴元国李春梅
宋美艳,张永辉,朴元国,李春梅
南京农业大学动物科技学院,南京 210095
环境内分泌干扰物是一类通过干扰生物体内调节发育过程的天然激素的合成、分泌、运输、结合、反应和代谢等过程,从而对生物体的生殖、神经和免疫系统等的功能产生影响的外源性化学物质。4-硝基酚(4-nitrophenol,PNP)是一种重要的化工原料,广泛应用于生产杀虫剂、除草剂、染料、医药等行业,常常在生产和使用过程中被释放到环境中,它们难以降解,在环境中可长期残留,对土壤、水体和大气造成严重的污染[1-3],已被美国环境保护局和我国列为“优先控制污染物”之一。最近研究发现柴油车尾气[4-5]和酸雨[6]中也含有PNP,而且PNP是对硫磷、甲基对硫磷、马拉硫磷等有机磷农药的水解产物[7]。环境中各种来源的PNP严重威胁着人类及动物的健康。我们的前期研究发现PNP具有雌激素和抗雄激素样作用[8],能够引起睾丸激素分泌紊乱[9-10],扰乱雄性大鼠肾上腺皮质类固醇激素的分泌[11]。肝脏是外来化学物质代谢的主要靶器官,PNP在动物体内最终通过葡萄糖醛酸盐形式或硫酸盐形式排出[12-13],其在代谢过程中是否对大鼠肝脏造成影响尚未见报道。
核因子相关因子-2(Nrf2)通路是近年来发现的化学应激的防御性转导通路,正常情况下,Nrf2和细胞骨架相关蛋白Keap1结合在一起,当机体受到外来化学物质刺激时,两者分离,Nrf2转移入核与抗氧化反应元件ARE结合,启动Nrf2下游靶基因醌氧化还原酶(NQO1)、血红素加氧酶(HO-1)以及谷氨酸-半胱氨酸连接酶催化亚基(GCLC)等的表达。我们通过预实验发现PNP能够引起大鼠肝脏氧化应激,而Nrf2信号通路是抗氧化应激的主要通路之一,因此本试验通过对大鼠皮下注射不同剂量的PNP,探讨PNP对大鼠肝脏功能及Nrf2信号转导通路的影响。
1 材料与方法(Materials and methods)
1.1 试验材料和试剂
1.1.1 主要试剂及仪器
4-硝基酚(4-nitrophenol,PNP,纯度99.9%,成都科隆化学品有限公司),多聚甲醛(上海凌峰化学试剂有限公司),动物切片石蜡(熔点60~62 ℃,上海国药集团化学试剂有限公司),抗氧化和肝功能测试盒(南京建成生物工程研究所),HE(苏木精-伊红)染液(南京建成生物科技有限公司),反转录试剂盒和PCR定量试剂盒(上海皓嘉科技发展有限公司)。
石蜡切片机Leica RM2235和烘片机Leica HI1220(上海徕卡仪器有限公司),光学显微镜Nikon YS100(日本Nikon株式会社),酶标仪(美国Thermo公司),5417R型台式冷冻高速离心机(德国Eppendorf公司),低温冷冻离心机J2-MI型(德国Beckman公司),Real-time PCR仪(美国Bio-rad公司)。
1.1.2 试验动物和样品采集
选取20只21日龄SD雄性大鼠(购自南京青龙山实验动物研究所),饲养在人工控制的环境中,12 h光照(07:00 至 19:00)和12 h黑暗,温度(23±2 ℃),湿度(50%±10%),自由采食和饮水。随机分为4组,每组5只,各组间体重无显著性差异(p>0.05)。溶剂是含0.05% Tween 80的PBS,PNP溶解于溶剂中。预饲一周后,分别皮下注射溶剂1、10和100 mg·kg-1体重的PNP,每天早晨9点注射一次,连续注射28 d。最后一次注射24 h后,大鼠颈动脉采血及采集肝脏样品。采集的部分肝脏固定于4 %多聚甲醛,用于HE染色;部分样品用2.5 %戊二醛缓冲液固定,用于透射电镜观察;再取一小部分保存于-80 ℃,用于RNA检测;剩余肝脏保存于-20 ℃,用于生化指标测定。
1.2 试验方法
1.2.1 血清肝功能指标检测
颈动脉采血后,3 500 r·min-1离心15 min,吸取上清液,采用试剂盒测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)的活性和总胆红素(TBIL)的含量。
1.2.2 肝脏组织抗氧化指标检测
称取肝脏组织0.1~0.15 g,按重量体积比加入9倍体积的冰冷生理盐水,用组织匀浆机10 000~15 000 r·min-1充分研磨,然后3 800 r·min-1离心15 min,吸取上清液备用。采用试剂盒测定过氧化氢(H2O2)、丙二醛(MDA)、谷胱甘肽(GSH)的含量和过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)的活性。
1.2.3 肝脏组织结构观察
对照组和处理组大鼠肝脏组织经4%多聚甲醛固定24 h后,梯度酒精脱水,二甲苯透明,石蜡包埋处理,切片,HE染色,观察肝脏显微结构变化。取对照组和100 mg·kg-1PNP组大鼠的部分肝脏,固定于2.5%磷酸戊二醛溶液,环氧树脂包埋,超薄切片,锇酸染色,在透射电镜下观察肝细胞超微结构的变化并记录。
1.2.4 肝脏组织总RNA的提取和定量测定
按照Trizol说明书提取肝脏组织的总RNA,提取的RNA保存于-70 ℃超低温冰箱中,或立即用于反转录。反转录时,按照Takara Prime Script ® RT reagent Kit反转录试剂盒说明书,取上述纯化的总RNA 2.0 μg 加入2×RT Buffer 10 μL、20×RT Enzyme Mix 1 μL、Nuclease-free H2O补足至20 μL,置于PCR仪内37 ℃ 15 min,95 ℃反转录灭活15 s,反应结束后所得cDNA用于定量PCR。按照Takara SYBR®Premix Ex TaqTM定量试剂盒说明书,依次往定量PCR管加入下列试剂(20 μL体系):H2O 6.8 μL、引物(10 μmol·L-1各0.4 μL、模板2 μL、ROX Reference Dye 0.4 μL、SYBR Premix Ex Taq 10 μL,混匀离心后在Real-time PCR仪上反应检测,反应程序如下: 95 ℃变性10 min,95 ℃ 15 s,60 ℃ 45 s,重复45个循环;反应结束绘制熔解曲线。利用2-△△Ct法对基因表达进行相对定量,下表为试验中所用引物序列,见表1。

表1 Real-time PCR所用引物Table 1 Primers for Real-time PCR analyses
1.3 数据统计分析
各组数据均采用平均数±标准误(Mean ± SEM)表示,数据采用单因素方差分析(ANOVA),Dunnett 法进行差异性比较,p< 0.05为差异显著,p< 0.01为差异极显著,p< 0.001为差异极显著。以上数据分析均采用GraphPad Prism 5 软件完成。
2 结果(Results)
2.1 4-硝基酚对大鼠体重和肝脏重量的影响
对照组和PNP处理组大鼠生长正常,体重、肝脏的绝对重量和相对重量均无显著性差异(p> 0.05),PNP处理组大鼠的体重与对照组相比,略有下降趋势,但差异不显著(p> 0.05),见表2。
2.2 4-硝基酚对大鼠血清肝功能的影响
与对照组相比,血清中ALT、AST、AKP活性和TBIL含量在100 mg·kg-1组均显著性升高(p< 0.05);1 mg·kg-1组AST和AKP活性显著性升高(p< 0.05);10 mg·kg-1组AKP的活性显著性升高(p< 0.05),见表3。
2.3 4-硝基酚对大鼠肝脏组织结构的影响
图1为各组大鼠肝脏的显微结构变化,从中可以看到,对照组肝细胞排列紧密,形态正常(图1A)。
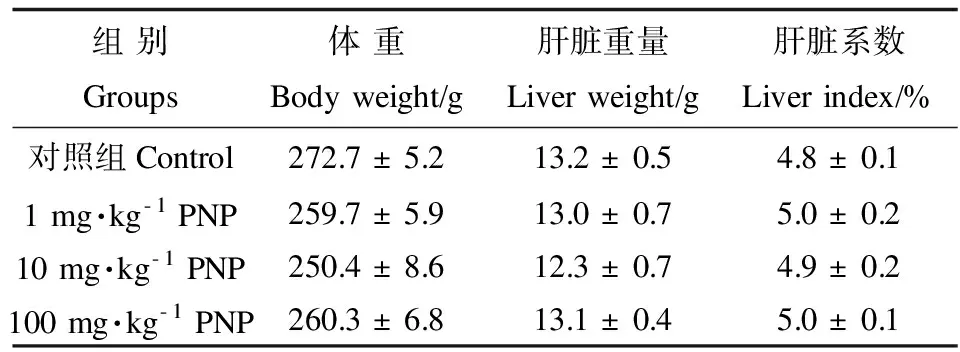
表2 PNP对大鼠体重、肝脏重及肝脏系数的影响Table 2 Effects of PNP on the body weight, liver weight and liver index of rats
注:数据采用平均数±标准误(Mean±SEM)表示,n=5
Note:Values are expressed as Mean ± SEM,n=5
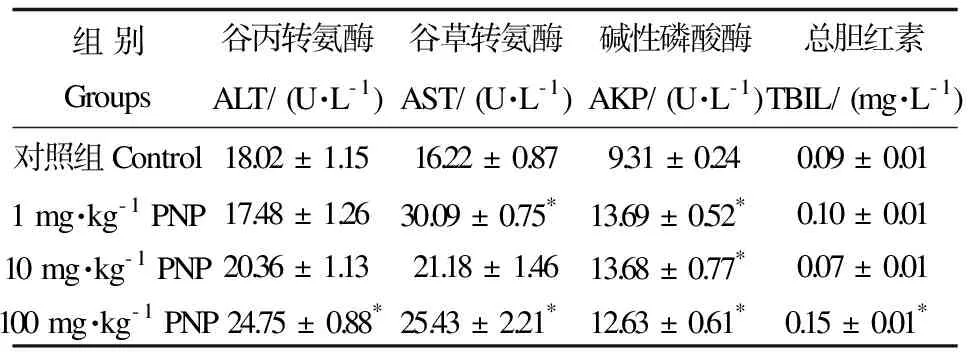
表3 PNP对大鼠血清中肝功能标志物的影响Table 3 Effects of PNP on the indicators of liver function in serum of rats
注:数据采用平均数±标准误(Mean±SEM)表示,n=5。与对照组相比,*p<0.05。
Note: Values are expressed as Mean ± SEM for 5 animals. Compared with control group, *p< 0.05.
与对照组相比,1 mg·kg-1PNP组肝细胞核着色较深,汇管区有大量淋巴细胞浸润(图1B);10 mg·kg-1PNP组肝脏汇管区有大量淋巴细胞浸润(图1C);100 mg·kg-1PNP组中央静脉有大量淋巴细胞浸润,肝血窦变宽(图1D)。
图2为对照组和100 mg·kg-1PNP组大鼠肝脏的超微结构图。从中可以看到,对照组肝细胞核呈圆形,细胞核周围有大量的线粒体和内质网,线粒体完整,内质网排列整齐(图2A)。与对照组相比,100 mg·kg-1PNP组肝细胞核发生固缩(图2B)、内质网排列紊乱(图2C)、出现凋亡小体(图2D)、线粒体部分内外膜消失和线粒体嵴断裂(图2E)。
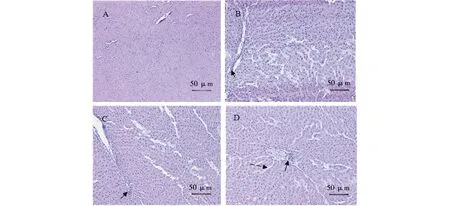
图1 PNP处理对大鼠肝脏显微结构的影响(A)对照组;(B)1 mg·kg-1 PNP组;(C)10 mg·kg-1 PNP组;(D)100 mg·kg-1 PNP组Fig. 1 Effects of PNP on microstructure change in rat liver (A) Control group;(B) 1 mg·kg-1 PNP group;(C) 10 mg·kg-1 PNP group;(D) 100 mg·kg-1 PNP group
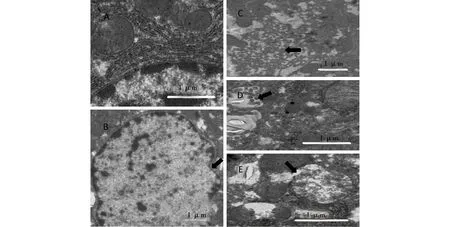
图2 PNP处理对大鼠肝脏超微结构的影响(A)对照组;(B)、(C)、(D)、(E)100 mg·kg-1 PNP组Fig. 2 Effects of PNP on ultrastructure change in rat liver (A) Control group;(B、C、D、E) 100 mg·kg-1 PNP group
2.4 4-硝基酚对大鼠肝脏氧化和抗氧化系统的影响
与对照组相比:H2O2和MDA含量均在1 mg·kg-1组显著性升高(p< 0.01,p< 0.05,见图3A、3B);10 mg·kg-1和100 mg·kg-1组CAT活性均显著性降低(p< 0.01,p< 0.001,见图3C);1、10和100 mg·kg-1组SOD活性均显著低于对照组(p< 0.001,见图3D);10和100 mg·kg-1组GSH含量(p< 0.01,p< 0.001,见图3E)及GSH-PX活性(p< 0.01,p< 0.05,见图3F)均显著性降低。
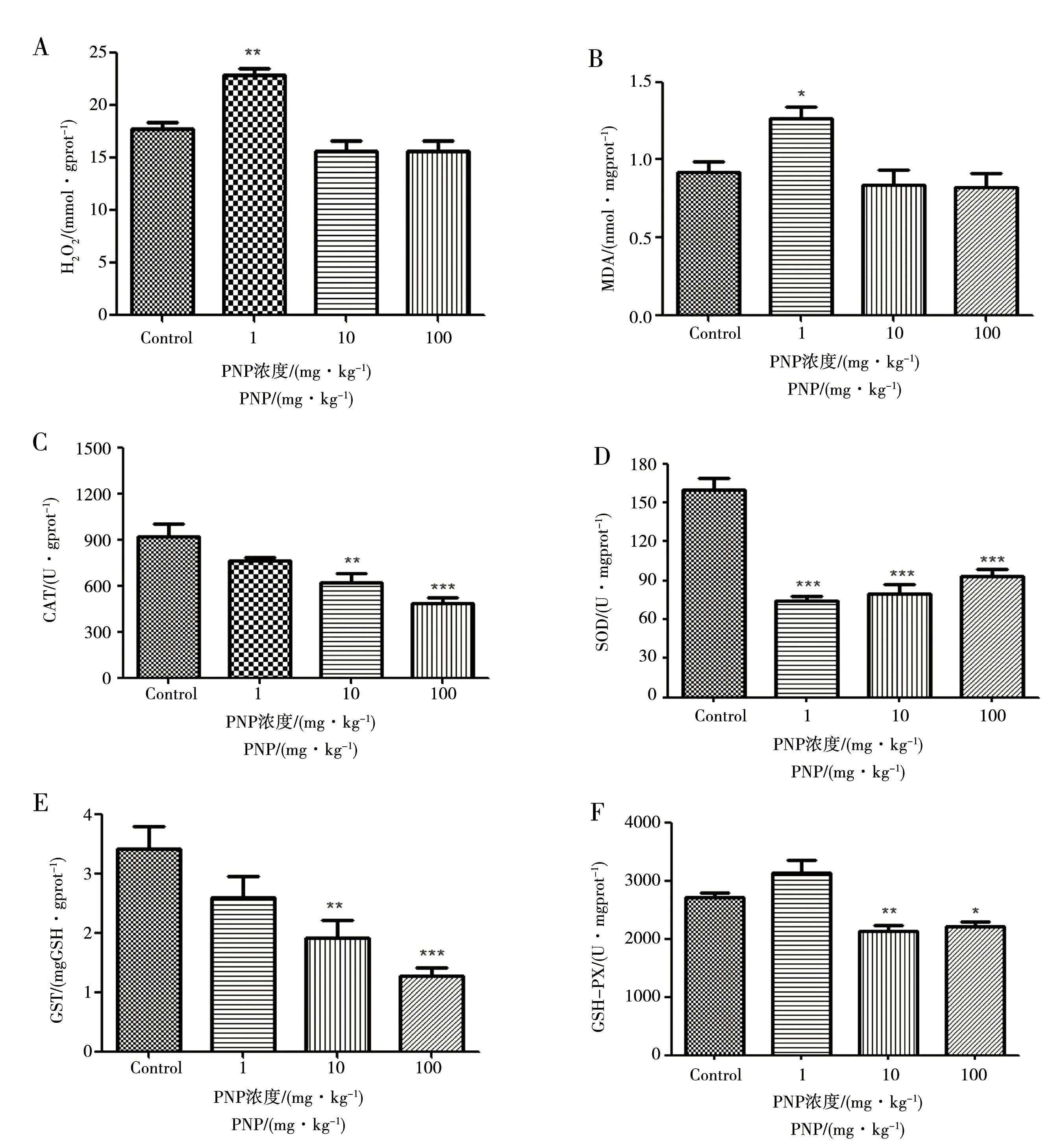
图3 PNP处理对大鼠肝脏氧化和抗氧化系统的影响 (A)H2O2,(B)MDA,(C)CAT,(D)SOD,(E)GSH,(F)GSH-PX 注:数值用Mean±SEM表示,n=5,与对照组相比,* p < 0.05;** p < 0.01;*** p < 0.001Fig. 3 Effects of PNP on oxidation and antioxidant system in rat liver (A) H2O2,(B) MDA,(C) CAT,(D) SOD,(E) GSH,(F) GSH-PXNote:Values are expressed by the Mean ± SEM of 5 rats per group.* p < 0.05,** p < 0.01,*** p < 0.001
2.5 4-硝基酚对大鼠肝脏Nrf2相关基因表达的影响
图4为各组大鼠肝脏的Nrf2、HO-1、NQO1和GCLC mRNA相对表达量的变化。与对照组相比,1 mg·kg-1组的Nrf2(图4A)、HO-1(图4B)和NQO1(图4C)显著性升高(p< 0.05),GCLC(图4D)有升高趋势(p> 0.05);Nrf2、HO-1和NQO1在100 mg·kg-1组有升高趋势,但差异不显著(p> 0.05)。
3 讨论(Discussion)
3.1 4-硝基酚对大鼠体重和肝脏重量的影响
脏器系数一般适用于检测心、肝、脾、肺和肾等实质性器官,如果脏器系数变小,表明脏器可能出现萎缩和退行性变化;如果脏器系数变大,表明脏器可能出现水肿、充血和增生等病变[14]。本试验PNP处理没有引起大鼠体重、肝脏重和肝脏系数发生显著性变化,说明PNP在本实验剂量下对大鼠生长没有显著性影响。
3.2 4-硝基酚对大鼠血清肝功能的影响
肝脏是动物体物质代谢活动的中心,含有大量酶类。肝脏酶的释放是反应肝细胞损伤的重要指标。外源化学物质能以肝脏为主要靶器官,促使肝细胞损伤,导致肝脏分泌到血清中的酶类发生变化。本试验结果显示,100 mg·kg-1PNP处理组的大鼠血清ALT和AST活性以及TBIL含量显著性升高,10 mg·kg-1PNP组AKP活性显著性升高,1 mg·kg-1PNP组大鼠血清AST活性显著性升高,这一结果与柳成刚等[15]研究的二甲基亚硝胺对大鼠肝损伤的结果一致。我们的研究结果说明皮下注射PNP能够引起肝脏的功能损伤。
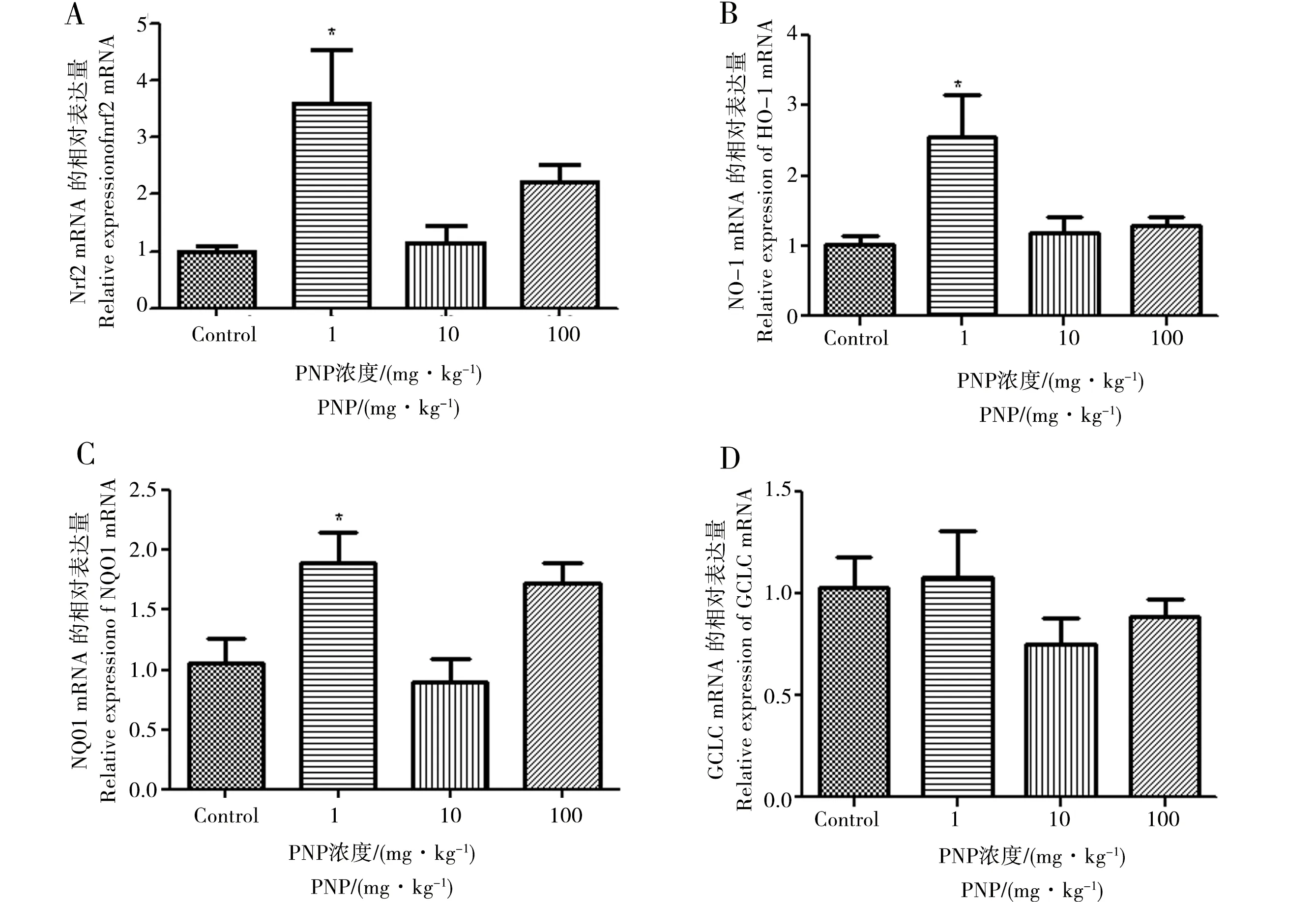
图4 PNP处理对大鼠肝脏Nrf2及其相关基因的mRNA相对表达量的影响(A)Nrf2 mRNA,(B)HO-1 mRNA,(C)NQO1 mRNA,(D)GCLC mRNA注:数值用Mean±SEM表示,n=5,与对照组相比,* p < 0.05Fig. 4 Effects of PNP on the mRNA expression`levels of Nrf2 and related genes in rat liver (A) Nrf2 mRNA,(B) HO-1 mRNA,(C) NQO1 mRNA,(D) GCLC mRNANote:Values are expressed by the Mean±SEM of 5 rats per group, * p < 0.05.
3.3 4-硝基酚对大鼠肝脏的氧化损伤
动物机体存在两类抗氧化防御体系,一类是酶促抗氧化系统,包括CAT、SOD、GSH-Px等;另一类是非酶促抗氧化系统,包括谷胱甘肽、维生素E、类胡萝卜素、微量元素铜、硒等[16]。当外源化学物质进入机体后,会导致机体内自由基和氧化产物增多,使体内的氧化与抗氧化失去平衡,出现生理不适现象。MDA是细胞膜脂质过氧化产物,在抗氧化酶活性降低的情况下,MDA和H2O2含量应该是升高的。本试验研究发现,1 mg·kg-1PNP处理组大鼠MDA和H2O2含量显著性升高,但10 mg·kg-1和100 mg·kg-1PNP处理组大鼠的肝脏中GSH含量和CAT、SOD活性均显著性降低,MDA和H2O2含量均没有显著性变化。这可能是由于以下原因:第一,机体的酶系防御系统受到破坏时,非酶系统发挥作用,短时间内并不会造成组织细胞膜损伤;第二,多羟基酚性成分具有捕捉自由基的功能,较高剂量PNP可能通过捕捉细胞内自由基,避免引起细胞膜脂质过氧化损伤,从而降低脂质过氧化产物的产生[17]。
3.4 4-硝基酚对大鼠肝脏Nrf2相关基因表达的影响
近年研究发现,在应激条件下,如血红素、H2O2、重金属和内毒素等,均可通过Nrf2 启动HO-1 的表达表现出明显的抗氧化作用[18-19]。李梅等[20]研究发现顺铂能显著诱导肾脏中Nrf2 核转位, 其下游Ⅱ相解毒酶基因NQO1、GCLC和HO-1 mRNA 表达水平也显著增加。本试验也发现1 mg·kg-1PNP处理使大鼠肝脏Nrf2 mRNA表达升高,HO-1和NQO1 mRNA表达水平也升高,变化趋势基本一致。试验结果表明,大鼠在应激条件下可能通过启动Nrf2信号通路来抵抗PNP引起的肝脏氧化损伤。但本试验中10 mg·kg-1和100 mg·kg-1PNP处理组大鼠Nrf2相关基因的表达均没有显著性变化,原因可能是较高剂量PNP引起肝脏毒性,激活了肝脏的其它通路,这还有待进一步研究。
综上所述,皮下注射1 mg·kg-1PNP引起了大鼠肝脏氧化损伤,机体通过提高Nrf2及其相关基因mRNA的表达水平来抵抗PNP引起的肝脏损伤。100 mg·kg-1PNP组大鼠肝脏的显微和超微结构有较严重损伤,肝脏抗氧化酶活性显著低于对照组,然而Nrf2通路相关基因的mRNA表达水平却没有显著性升高。由此我们推测,100 mg·kg-1PNP改变了肝脏的正常生理功能,造成肝细胞超微结构病理损伤,导致肝脏毒性。
参考文献:
[1] Bhushan B, Chauhan A, Samanta S K, et al. Kinetics of biodegradation of p-nitrophenol by different bacteria [J]. Biochemical and Biophysical Research Communications, 2000, 274(3): 626-630
[2] 吴萍, 张海燕, 李梅, 等. 对硝基苯酚降解菌Pseudomonassp. HY1 的分离与活性分析[J]. 首都师范大学学报: 自然科学版, 2009, 30(3): 25-29
Wu P, Zhang H Y, Li M, et al. Biodegradation of p-nitrophenol byPseudomonassp. HY1 [J]. Journal of Capital Normal University (Natural Science Edition), 2009, 30(3): 25-29 (in Chinese)
[3] Wan N S, Gu J D, Yan Y. Degradation of p-nitrophenol by Achromobacter xylosoxidans Ns isolated from wetland sediment [J]. International Biodeterioration & Biodegradation, 2007, 59(2): 90-96
[4] Noya Y, Mikami Y, Taneda S, et al. Improvement of an efficient separation method for chemicals in diesel exhaust particles: Analysis for nitrophenols [J]. Environment Science and Pollution Research, 2008, 15(4): 318-321
[5] Taneda S, Kamata K, Hayashi H, et al. Investigation of vasodilatory substances in diesel exhaust particles (DEP): Isolation and identification of nitrophenol derivatives [J]. Journal of Health Science, 2004, 50(2): 133-141
[6] Nishioka M G, Lewtas J. Quantification of nitroxylated nitroaromatic polycyclic aromatic hydrocarbons in selected ambient air daytime winter samples [J]. Atmosphere Environment, 1992, 26(11): 2077-2087
[7] Kim T S, Kim J K, Choi K, et al. Degradation mechanism and the toxicity assessment in TiO2photocatalysis and photolysis of parathion [J]. Chemosphere, 2006, 62(6): 926-933
[8] Li C M, Taneda S, Akira K, et al. Estrogenic and anti-androgenic activities of 4-nitrophenol in diesel exhaust particles [J]. Toxicology and Applied Pharmacology, 2006, 217(1): 1-6
[9] Li X Z, Li C M, Suzuki A K, et al. 4-Nitrophenol isolated from diesel exhaust particles disrupts regulation of reproductive hormones in immature male rats [J]. Endocrine, 2009, 36(1): 98-102
[10] Zhang Y H, Piao Y G, Li C M, et al. 4-Nitrophenol induces leydig cells hyperplasia, which may contribute to the differential modulation of the androgen receptor and estrogen receptor-α and -β expression in male rat testes [J]. Toxicology Letters, 2013, 223(2): 228-235
[11] Li C M, Li X Z, Suzuki A K, et al. Effects of exposure to nanoparticle-rich diesel exhaust on adrenocortical function in adult male mice [J]. Toxicology Letters, 2012, 209(3): 277-281
[12] Gessner T, Hamada N. Identification of p-nitrophenyl glucoside as a urinary metabolite [J]. Journal of Pharmaceutical Sciences, 1970, 59(10): 1528-1529
[13] Quebbemann A J, Anders M W. Renal tubular conjugation and excretion of p-nitrophenol in the chicken, differing mechanisms of renal transfer [J]. The Journal of Pharmacology and Experimental Therapeutics, 1973, 184(3): 695-708
[14] 沈建忠. 动物毒理学[M]. 北京: 中国农业出版社, 2002, 107-108
[15] 柳成刚, 王晓丽, 姜德友, 等. 肝达康对DMN 致大鼠肝损伤血清ALT、AST、TBIL、TP 及ALB 的影响[J]. 中医药信息, 2012, 29(4): 74-76
Liu C G, Wang X L, Jiang D Y, et al. Effects of gandakang (GDK) on ALT, AST, TP, ALB and TBIL in serum of hepatic injury rats induced by DMN [J]. Information on Traditional Chinese Medicine, 2012, 29(4): 74-76
[16] 曾昭惠, 张宗玉. 自由基对线粒体DNA的氧化损伤与衰老[J]. 生物化学与生物物理进展, 1995, 22(5): 429-432
Zeng Z H, Zhang Z Y. The oxidative damage of mitochondrial DNA by free radicals and aging [J]. Progress in Biochemistry and Biophysics, 1995, 22(5): 429-432 (in Chinese)
[17] 张婧, 熊正英. 迷迭香对大鼠脑组织抗氧化酶活性和MDA含量的影响[J]. 陕西师范大学学报(自然科学版), 2008, 36(4): 103-105
Zhang J, Xiong Z Y. The effect of rosemary on the antioxidase activity and the content of MDA in the brain of rats trained by maximus intensive endurance [J]. Journal of Shanxi Normal University: Natural Science Edition, 2008, 36(4): 103-105 (in Chinese)
[18] Nguyen T, Yang C S, Pickett C B. The pathways and molecular mechanisms regulating Nrf2 activation in response to chemical stress [J]. Free Radical Biology and Medicine, 2004, 37(4): 433-441
[19] Nguyen C N, Kim H E, Lee S G. Caffeoylserotonin protects human keratinocyte HaCaT cells against H2O2-induced oxidative stress and apoptosis through upregulation of HO-1 expression via activation of the PI3K/Akt/Nrf2 pathway [J]. Phytotherapy Research, 2013, 27(12): 1810-1818
[20] 李梅, 金晶, 李佳, 等. 五味子乙素激活Nrf2/ARE 通路对顺铂致HK-2 细胞氧化应激损伤的保护作用[J]. 药学学报, 2012, 47(11): 1434-1439
Li M, Jin J, Li J, et al. Schisandrin B protects against nephrotoxicity induced by cisplatin in HK-2 cells via Nrf2-ARE activation [J]. Acta Pharmaceutica Sinica, 2012, 47(11): 1434-1439 (in Chinese)
