心脏死亡器官捐献供肾的缺血再灌注损伤
2014-03-21季曙明综述陈劲松审校
季曙明 综述 陈劲松 审校
心脏死亡器官捐献(DCD)供肾开启我国器官移植新时代[1],目前已向全国推广,将推动我国建立一个健康、符合伦理的肾移植体系,使我国的肾移植事业走向一个广阔的可持续发展之路[2,3]。但与传统尸体供肾移植相比,来源于DCD供肾的受者术后移植肾功能延迟恢复(DGF)、移植肾切除和死亡的发生率高,且更高于亲属活体供肾移植。DCD供肾缺血再灌注损伤(IRI)是导致这种效果较差的根本原因[4-7]。最近研究发现DCD供者体内C3a和 C5a活化与供肾IRI密切相关,本文就此作一综述。
C3a/C5a活化
补体并非单一分子,而是存在于血清、组织液和细胞膜表面的一组不耐热的经活化后具有酶活性的蛋白质,并由各种刺激(如感染、组织损伤和心脏死亡)激发其连锁反应。补体的活化产生大量的效应分子,包括大碎片C3b 及其代谢产物(iC3b, C3dg)、小碎片(C3a,C5a)、终末产物C5b-9,也称为膜攻击复合物(MAC)[8]。补体在活化过程中C2、C3、C4、C5均分别裂解成2个或2个以上的片段,分别标以a、b等符号,如 C3a、C3b、C3c等。其中C2a、C3b、C4b、C5b直接或间接结合在靶细胞上,以固相的形式参与溶细胞过程,C3a、C5a游离在液相[9]。补体在激活过程中,C5、C6、C7经活化后还可聚合成C567,并与C3a、C5a一起发挥多种生物功能,例如C3b具有促成病原体的调理作用,C3a 和 C5a 诱导局部炎症和细胞活化,MAC促进病原体和组织损伤。以往应用补体缺失(如C3、C4、C5、C6及B因子)或补体抑制剂(如CD55、CD59)证明补体活化与肾脏IRI的发病机制有关。许多研究也表明在肾小管上皮细胞内形成C5b-9是通过补体介导IRI的一个关键性的效应机制[10]。目前认为C3a和C5a活化可能是在DCD供肾IRI过程中起一个重要作用。
C3a和C5a活化在DCD供肾IRI中的作用
最近研究发现DCD供者激发体内C3a和C5a活化,DCD供肾捐献前血浆C3a和C5a水平明显高于亲属活体供者[11]。DCD供肾者体内C3a和C5a的释放与肾小管C3a受体(C3aR)和C5aR表达增加密切相关。结果表明C3a和C5a在DCD供肾IRI中的活化可能是该损伤过程中最重要的途经[11,12]。Fuquay等[13-15]发现DCD供肾IRI后肾组织内C3aR和C5aR表达明显增强、细胞浸润增多,肾脏损伤分子1(KIM-1) mRNA水平、促炎性介质和黏附分子表达增强,而且C3aR和C5aR的表达与DCD供肾IRI、细胞凋亡及DGF、移植肾排斥反应及移植肾存活时间具有很强的相关性。提示C3a和C5a过度活化在DCD供肾IRI的机制中发挥重要的作用[16]。
C3aR和C5aR信号调节在IRI发生机制中的关键性因素[17-19]。肾小管上皮细胞、浸润的中性粒细胞、单核细胞和巨噬细胞参与IRI是产生促炎性介质的重要来源。为了进一步研究浸润细胞上C3aR和C5aR的表达与局部炎症之间的相关性,评估在缺氧-复氧条件下,C3aR和C5aR 在巨噬细胞上的表达是否增加相应的炎性介质的产生,分别从组织学和免疫学变化方面,确定C3a和C5a对IRI效应机制的作用[20]。采用自然雄性C57BL/6小鼠获取腹膜巨噬细胞和原肾小管上皮细胞,分别在缺氧(5%CO2和95%N2)和复氧(21% O2和 5% CO2) 条件下培养24h。采集上清液,通过流式细胞仪小球微阵列术检测细胞因子[(肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)]和趋化因子。
在缺氧和复氧条件下,加入C3a和C5a刺激巨噬细胞产生促炎因子、细胞因子和趋化因子。研究数据表明C3aR 和 C5aR信号是肾脏IRI发生的主要因素[20],相关的肾细胞、浸润白细胞和巨噬细胞是炎性介质的主要来源。为了进一步研究C3aR 和 C5aR在浸润细胞上的表达与局部炎症的相关机制,在缺氧和复氧条件下,巨噬细胞上C3aR和C5aR 表达是否增加其炎性介质的产生?制备野生大鼠巨噬细胞,暴露于缺氧和复氧条件下,加入或不加入C3a或C3a,C5a或 C5a ,随着剂量依赖的情况下(C3a:0~50 nM,C5a:0~20 nM),巨噬细胞产生TNF-α、IL-6和角质细胞化学趋化因子(KC) 明显增加。与对照组相比,同时加入 C3a 和C5a 同样也诱导巨噬细胞产生细胞因子和趋化因子。这些资料提示在IRI过程中,C3a 和C5a可刺激巨噬细胞产生炎性细胞因子。
在缺氧和复氧条件下,加入C3a和C5a刺激近曲小管上皮细胞(PTECs)观察促炎细胞因子、趋化因子和KIM-1的表达。位于肾脏皮髓交界处的PTECs很容易遭受IRI[16],它们对病理刺激反应也能产生一些炎性细胞因子和趋化因子。然而,评估对原先培养PTECs在缺氧和复氧条件下,C3aR和C5aR的表达是否增加炎性介质的产生,也可观察到与巨噬细胞同样的现象。单独加入 C3a 或 C5a 或C3a和C5a刺激PTECs 产生TNF-α和KC明显增加。除细胞因子和趋化因子外,评估对原先培养PTECs在缺氧和复氧条件下,C3aR 和C5aR的表达是否增加KIM-1的表达,与敲除所有受体小鼠缺血后肾脏一样,KIM-1表达明显降低,单独加入C3a 或 C5a或同时加入 C3a和C5a刺激后,KIM-1在PTECs的表达明显增加。说明在肾脏IRI过程中C3a和C5a直接作用于肾小管上皮细胞。
C3a和C5a活化在DCD供肾IRI中的作用机制
DCD供者IRI激发了全身和局部小分子裂片促炎性因子(C3a和C5a)的活化,C3a和C5a是不是与这种损伤的发生机制有关,如何发生仍不明确。Peng等[20]应用C3aR和C5aR缺失老鼠IRI的动物实验模型进行观察:通过骨髓移植产生了野生型(WT)和双基因敲除(DKO)的小鼠嵌合体。将小鼠分为四组:(1)WT小鼠移植给WT小鼠骨髓形成WT/WT,肾脏细胞和循环白细胞均表达C3aR和C5aR;(2)DKO小鼠移植给DKO小鼠骨髓形成DKO/DKO,肾脏细胞和循环白细胞均缺失C3aR和C5R;(3)DKO小鼠移植给WT小鼠骨髓形成DKO/WT,肾脏细胞缺失C3aR和C5aR,而循环白细胞表达C3aR和C5aR;(4)WT小鼠移植给DKO小鼠骨髓形成WT/DKO,肾脏细胞表达C3aR和C5aR,而循环白细胞缺失C3aR和C5aR。在8周时,用这些小鼠诱导IRI,在再灌注后24h内,评估肾功能的损害。进一步证实肾脏固有细胞和浸润白细胞C3aR和C5aR表达促进了IRI。
C3aR和C5aR缺失在肾IRI小鼠实验中具有保护作用为了评估C3aR和C5aR缺失对肾脏IRI的影响,引用四组WT、C3aR-/-、C5aR-/-和DKO小鼠,在再灌注后24h和48h测定尿素氮(BUN)。在同一时间点与WT小鼠组比较,所有三组双基因敲除小鼠BUN水平明显降低。获取再灌注后24h和48h的肾组织作组织学分析,与WT小鼠组比较,可见三组双基因敲除组肾小管损伤包括肾小管稀少、扩张、近端小管刷状缘脱落和蛋白管型明显减少,这些结果与肾功能损伤一致,C5aR-/-或DKO小鼠肾小管损伤减轻明显。由于缺血后啮齿类动物肾脏KIM-1表达很高,KIM-1被称为是急性肾损伤的生物标志[21]。测定WT、C3aR-/-、C5aR-/-和DKO 小鼠损伤肾脏的KIM-1 mRNA的表达,与WT小鼠组比较双基因敲除三组肾脏KIM-1表达明显降低,在灌注24h后25%(C3aR-/-)、50%(C5aR-/-)、60%(DKO);在灌注48h后,C5aR-/-和DKO组KIM-1的表达也明显低于WT 组。总之,这些研究表明C3aR和(或)C5aR缺失对肾脏IRI提供了肾脏功能和结构的保护。因此,无论C5aR单一缺失或C3aR和C5aR双缺失都具有很好的保护作用。
C3aR和C5aR缺失的情况下能减少肾IRI后炎性介质的产生肾缺血损伤后炎性介质与急性肾损伤有关。应用半定量实时RT-PCR技术,在同样的动物模型中,进一步分析灌注24h和48h,炎性细胞因子[(TNF-α、IL-1β、γ干扰素(IFN-γ)],趋化因子[KC、IL-8、单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎性蛋白(MIP-1α,MIP-1β)]和黏附分子:细胞间黏附分子(ICAM-1)、CD146和血管假性血友病因子在肾组织内的表达[22,23]。在灌注24h和48h,来源于 C5aR-/-或DKO 小鼠的肾组织显示炎性细胞因子(TNF-α、IL-1β、IFN-γ) 和趋化因子(KC、MCP-1) 表达明显低于 WT小鼠。C3aR-/-小鼠肾组织内这些细胞因子和趋化因子的合成降低;只有 TNF-α在再灌注后24h降低十分明显。C3aR-/-、C5aR-/-和DKO 小鼠[MIP-1α、MIP-1β、ICAM-1、CD146和血管假性血友病因子表达水平均明显低于 WT小鼠。在DKO小鼠中,只有一些分子表达明显降低(如MIP-1α,MIP-1β和ICAM-1)。上述结果提示在C3aR或C5aR缺失的情况,肾IRI后炎性介质的产生明显减少。
C3aR和C5aR缺失的情况下能降低肾IRI后的细胞浸润除肾小管损伤外,肾间质细胞浸润是肾脏IRI的特征性病理改变。为了评估C3aR 和 C5aR 对浸润细胞的影响,再灌注24h后采集肾组织,应用流式细胞仪分析(CD45,Gr-1和F4/80)和免疫组织化学染色。来源于 C5aR-/-或DKO组缺血肾组织Gr-1+和F4/80+细胞明显低于WT组。在所有双基因敲除小鼠流式细胞仪测定细胞浸润数明显减少。在C3aR-/-,C5aR-/-和DKO小鼠单个细胞悬液,三种类型的细胞(CD45+,Gr-1+,F4/80+) 的百分比低于WT小鼠。研究结果表明C3aR和(或)C5aR单缺失或双缺失均能减少肾缺血损伤反应后24h肾组织白细胞浸润(主要包括中性粒细胞、单核细胞和巨噬细胞)[24]。
总之,C3a和C5a活化是DCD供肾IRI过程中最重要的途经。C3a和C5a与肾小管上皮细胞上相应的特异性受体C3aR和C5aR结合,炎性细胞引起细胞活化产生促炎性细胞因子和趋化因子,由于内皮细胞的活化促使白细胞聚集(图 1)。另外,在白细胞趋化因子的作用下C3a和C5a 的直接作用,C3a和C5a两者可通过损伤部位肾脏细胞、单核细胞和巨噬细胞产生其他化学趋化因子间接介导白细胞趋化作用。因此,C3a或C5a介导这些炎性因子或且与其他补体成分(如C5b-9)一起作用,促进DCD供肾IRI后的急性肾损伤。
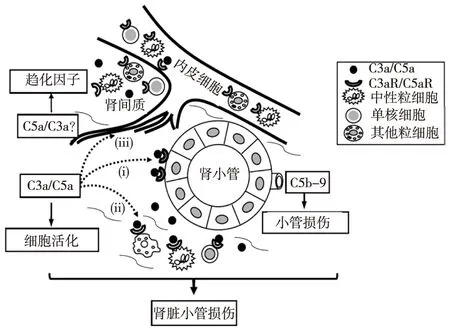
图1 C3a和C5a导致DCD供肾IRI的作用机制
DCD供肾IRI的防治
根据上述DCD供肾IRI的研究机制,寻找DCD供肾IRI防治的新思路及新靶点。目前认为减少缺血时间和应用C3aR和C5aR靶向拮抗剂是防治DCD供肾IRI的关键。
减少缺血时间从DCD供肾到移植肾血流开放的整个时间,即热缺血、温缺血和冷缺时间,这些不同的时间截点,分别与取肾灌注、植肾吻合和冷藏保存密切相关。因此,尽最大努力缩短各个环节的缺血时间,这是减轻DCD供肾IRI 的根本措施[25,26]。
应用C3aR和C5aR拮抗剂选择合适的、效果肯定的器官保存液是减轻移植肾IRI的重要前提。Ziegler等[27]在同基因C57BL/6小鼠肾移植模型的冷缺血过程中,应用C5aR拮抗剂对早期肾功能、炎症和细胞凋亡具有保护作用。在威斯康大学保存液中加入C5aR拮抗剂保存的移植肾存活率由29%增至57%。移植肾存活率增加与降低肾小管细胞损伤和细胞凋亡,阻断C5aR的表达,降低TNF-α和巨噬细胞炎性蛋白2有关。应用C5aR抑制剂的保存液可以改善DCD供肾移植后的早期肾功能[19]。最近研究通过抑制C5a 受体活性,观察其在IRI中的作用[28]。使用C5a 受体拮抗剂及制造梗死模型对小鼠大脑中动脉进行临时闭塞。24h后评估IRI的结果,进行神经学损伤评分和测算脑梗死体积。结果使用C5a 受体拮抗剂治疗的小鼠神经功能有所改善、梗死体积显著减少。证明C5a 受体拮抗剂显著改变小鼠缺血再灌注损伤程度。C5aRA是一种环肽[29],目前研究最广泛的是AcF〔OpdChaWR〕(PMX-53)[30]。已被证明在不同的啮齿动物疾病模型中可明显阻止C5a的介导效果。局部缺血前应用C5aRA 能充分抑制IRI诱导的肾脏损害。
终末补体拮抗剂(Eculizumab,h5G1.1)是抑制末端补体成分活化的重组人源型单克隆抗体,能特异性地键合到人末端补体蛋白C5,通过抑制人补体C5向C5a和C5b的裂解以阻断炎症因子C5a的释放及C5b-9的形成[31]。临床前期研究表明该抗体对C5a有高度亲和力,能阻断C5a和C5b-9的形成,并保护哺乳动物细胞不受C5b-9介导的损伤[32]。在灌洗液中加入C5aR拮抗剂或对受者在术前、术后应用药物来防治移植肾IRI,改善移植肾早期功能[33]。终末补体拮抗剂阻断C3aR 和C5aR mRNA表达。“拮抗”C3aR 和C5aR 是防治和减轻DCD供肾IRI的强有力的作用靶点。
1Huang J,Wang H,Fan ST,et al.The national program for deceased organ donation in China.Transplantation,2013,96(1):5-9.
2陈劲松,文吉秋,季曙明,等.亲属肾移植供者术后早期肾功能变化的影响因素.肾脏病与透析肾移植杂志,2013,22(2):106-111.
3谢轲楠,陈劲松.活体肾移植供者的心理状态及影响因素分析.肾脏病与透析肾移植杂志,2013,22(2):180-183.
4Wadei HM,Heckman MG,Rawal B,et al.Comparison of kidney function between donation after cardiac death and donation after brain death kidney transplantation.Transplantation,2013,96(3):274-281.
5Pine JK,Goldsmith PJ,Ridgway DM,et al.Comparable outcomes in donation after cardiac death and donation after brainstem death:a matched analysis of renal transplants.Transplant Proc,2010,42(10):3947-3948.
6Wang C,Fu Q,Liu L,et al.Kidney transplantation from donation after cardiac death donors in China-A single-center experience.Transplant Proc,2012,44(4):862-864.
7Summers DM,Johnson RJ,Allen J,et al.Analysis of factors that affect outcome after transplantation of kidneys donated after cardiac death in the UK:A cohort study.Lancet,2010,376(9749):1303-1311.
8Nozal P,Garrido S,Alba-Domínguez Ma,et al.An ELISA assay with two monoclonal antibodies allows the estimation of free factor H and identifies patients with acquired deficiency of this complement regulator.Mol Immunol,2013,58(2):194-200.
9Lefaucheur C,Loupy A,Zeevi A.Complement-binding anti-HLA antibodies and kidney transplantation.N Engl J Med,2014,370(1):85-86.
10 Duehrkop C,Rieben R.Ischemia/reperfusion injury:effect of simultaneous inhibition of plasma cascade systems versus specific complement inhibition.Biochem Pharmacol,2014,88(1):12-22.
11 van Werkhoven MB,Damman J,van Dijk MC, et al.Complement mediated renal inflammation induced by donor brain death:Role of renal C5a-C5aR interaction.Am J Transplant,2013,13(4):875-882.
12 Mastellos DC,Deangelis RA,Lambris JD.Complement-triggered pathways orchestrate regenerative responses throughout phylogenesis.Semin Immunol,2013,25(1):29-38.
13 Fuquay R,Renner B,Kulik L,et al.Renal ischemia-reperfusion injury amplifies the humoral immune response.J Am Soc Nephrol,2013,24(7):1063-1072.
14 Regner KR,Roman RJ.Role of medullary blood flow in the pathogenesis of renal ischemia-reperfusion injury.Curr Opin Nephrol Hypertens,2012,21(1):33-38.
15 Bao L,Wang Y,Haas M,et al.Distinct roles for C3a and C5a in complement-induced tubulointerstitial injury.Kidney Int,2011,80(5):524-534.
16 Stiegler P,Sereinigg M,Puntschart A,et al.Oxidative stress and apoptosis in a pig model of brain death(BD) and living donation(LD).J Transl Med,2013,11:244.
17 de Vries B,Köhl J,Leclercq WK,et al.Complement factor C5a mediates renal ischemia reperfusion injury independent from neutrophils.J Immunol,2003,170(7):3883-3889.
18 Zheng X,Zhang X,Feng B,et al.Gene silencing of complement C5a receptor using siRNA for preventing ischemia/reperfusion injury.Am J Pathol,2008,173(4):973-980.
19 Lewis AG,Köhl G,Ma Q,et al.Pharmacological targeting of C5a receptors during organ preservation improves kidney graft survival.Clin Exp Immunol,2008,153:117-126.
20 Peng Q,Li K,Smyth LA,et al.C3a and C5a promote renal ischemia-reperfusion injury.J Am Soc Nephrol,2012,23:1474-1485
21 Ichimura T,Bonventre JV,Bailly V,et al.Kidney injury molecule-1(KIM-1),a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain,is up-regulated in renal cells after injury.J Biol Chem,1998,273(7):4135-4142.
22 Takada M,Nadeau KC,Shaw GD,et al.The cytokine-adhesionmolecule cascade in ischemia/reperfusion injury of the rat kidney.Inhibition by a soluble P-selectin ligand.J Clin Invest,1997,99(11):2682-2690.
23 Xue C,Liu Y,Li C,et al.Powerful protection against renal ischemia reperfusion injury by t cell-specific NF-κB inhibition.Transplantation,2014,97(4):391-396.
24 Martin U,Bock D,Arseniev L,et al.The human C3a receptor isexpressedon neutrophils and monocytes,but not on B or T lymphocytes.J Exp Med,1997,186(2):199-207.
25 Sert I,Colak H,Tugmen C,et al.The effect of cold ischemia time on delayed graft function and acute rejection in kidney transplantation.Saudi J Kidney Dis Transpl,2014,25(5):960-966.
26 Gill J,Dong J,Eng M, et al.Pulsatile perfusion reduces the risk of delayed graft function in deceased donor kidney transplants,irrespective of donor type and cold ischemic time.Transplantation,2014,97(6):668-674.
27 Ziegler E,Gueler F,Rong S,et al.CCL19-IgG prevents allograft rejection by impairment of immune cell trafficking.J Am Soc Nephrol,2006,17(9):2521-2532.
28 Kim GH,Mocco J,Hahn DK,et al.Protective effect of C5a receptor inhibition after murine reperfused stroke. Neurosurgery,2008,63(1):122-125.
29 Schnatbaum K,Locardi E,Scharn D,et al.Peptidomimetic C5a receptor antagonists with hydrophobic substitutions at the C-terminus:Increased receptor specificity and in vivo activity.Bioorg Med Chem Lett,2006,16(19):5088-5092.
30 Arumugam TV,Shiels IA,Strachan AJ,et al.A small molecule C5a receptor antagonist protects kidneys from ischemia/reperfusion injury in rats.Kidney Int,2003,63(1):134-142.
31 Park SJ,Shin JI.Benficial effect of eculizumab on thrombotic microangiopathies:another point of view.Am J Kidney Dis,2014,63(1):166-167.
32 Legendre C,Sberro-Soussan R,Zuber J,et al.Eculizumab in renal transplantation.Transplant Rev (Orlando),2013,27(3):90-92.
33 Kaabak M,Babenko N,Kuznetsov O,et al.Eculizumab reverses the potentially fatal effects of kidney graft reperfusion injury.Pediatr Transplant,2014,18(2):E44-47.
