多氟多氰类负性液晶化合物的合成
2014-03-21曹建华孟劲松华瑞茂
郭 剑,隋 岩,曹建华,孟劲松,华瑞茂,3*
(1.诚志永华显示材料有限公司 北京研发中心,北京100084;2.河北省平板显示材料工程技术研究中心,河北 石家庄050091;3.清华大学 化学系,北京100084)
1 引 言
随着液晶显示技术的不断发展,人们对液晶材料的性能提出了新的要求。由于任何单组分液晶都不可能满足显示的全部要求,因此需要开发性能各异的单体液晶,然后将多种液晶化合物按适当比例混合调配,以求得到各种特殊参数的最佳配比来满足各种不同显示的要求。
介电各向异性是液晶的重要性质,负介电各向异性液晶有着广泛的用途:(1)在动态散射(DS)模式液晶显示器件中,利用了液晶的电光效应,使用的是负介电各向异性液晶材料。电控双折射(ECB)模式中的垂直排列相位畸变(DAP)型显示中采用了介电各向异性为负的液晶。宾主(GH)型显示中实现正性显示的一种方法就是使用负介电各向异性液晶和P型染料,可以实现无色背景下的着色图案。铁电液晶(FLC)显示要求铁电液晶有负的介电各向异性的液晶,它具有快速寻址、高对比度及宽工作区间的特点[1]。聚合物分散型液晶显示(PDLC)中也可以用到负介电各向异性液晶实现反型显示;(2)在液晶显示中,常常要调节Δε/ε⊥以改善显示特性。由于负介电各向异性液晶具有较大的ε⊥,可以通过在正介电各向异性液晶混合物中加入负介电各向异性液晶来降低Δε/ε⊥以提高超扭曲显示的电光特性曲线陡度,从而达到提高多路驱动能力和对比度、改善视角关系以及增大信息显示容量等目的[2]。
氰基的范德华半径较大(1.47nm),偶极矩为-4.05D(1D=3.338×10-30C·m),因此氰基广泛应用于分子的侧向取代基团以增强液晶的负介电各向异性。氰基类液晶的化学稳定性较好,所以是目前使用最为广泛的液晶材料之一,因此本文设计并合成了2种含有多氟多氰结构的新型液晶单体。通过核磁共振(NMR)、元素分析(EA)等方法确定了分子结构;利用偏光显微镜(POM)、示差扫描量热仪(DSC)等测试手段,对其参数进行测定。实验表明,该类新型的多氟多氰类化合物具有较小的光学各向异性(Δn)和负值很大的介电各向异性(Δε),可以用于液晶母体的调配,改善液晶材料的部分性能。
2 实 验
2.1 实验原料和测试仪器
实验中采用的原料主要有以下几种:
邻苯二甲腈(北京偶合科技有限公司,纯度>99.5%);氯化锌(北京偶合科技有限公司,纯度>98.0%);2,2,6,6–四甲基哌啶(北京偶合科技有限公司,纯度>99.5%);丁基锂(2.5 M 己烷溶液,北京偶合科技有限公司);四三苯基膦钯(北京偶合科技有限公司,纯度>98.0%);2,3-二氟-4-正戊基苯硼酸(石家庄诚志永华显示材料有限公司,纯度>99.5%);正戊基三氟硼酸钾盐(石家庄诚志永华显示材料有限公司,纯度>98.0%);[1,1’-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(北京偶合科技有限公司,纯度>98.0%);邻二氟苯(北京偶合科技有限公司,纯度>99.5%);硼酸三甲酯(北京偶合科技有限公司,纯度>99.5% )。
实验室中所用的试剂主要有四氢呋喃、石油醚、甲苯、无水乙醇、异丙醇、四甲基乙二胺、N,N-二甲基甲酰胺、碘、叔丁醇钾、碳酸钠、碳酸铯等(均为商业采购,化学纯)。
测定单体液晶化合物光学各向异性Δn 和介电各向异性 Δε 参数所用的母体液晶是SLC0112,其 主 要 参 数 为:Cp=73 ℃;Δn =0.0890;Δε=-1.4。由石家庄诚志永华显示材料有限公司出产。
测量单体液晶化合物的性能参数所用的混晶母体是FMTA,其主要参数为:Cp=64.3 ℃;Δn=0.103 1;Δε =-2.54;γ1=125.4mPa·s。由石家庄诚志永华显示材料有限公司出产,负性液晶母体。
实验中所用的测试仪器如下:
TA-2010示差扫描量热仪(美国TA 仪器公司),用于测量化合物的差热分析;JOEL JNM-ECA 300 MHz核磁共振波谱仪(JOEL公司),用于确定所合成化合物结构;Vario EL III元素分析仪(德国elementar公司),用于验证所合成化合物结构;LWT300LPT 偏光显微镜(上海测维光电技术有限公司),用于观察所合成化合物的相变的转换;HIOKI 3522-50LCR 测试仪(日置电机株式会社),用于介电常数的测试;NAR-4T 阿贝折射仪(ATAGO),用于测试折射率(no,ne);NDJ-79旋转黏度计(上海平轩科学仪器有限公司),用于测量混晶母体的旋转黏度。
2.2 多氟多氰类负性液晶化合物的合成路线
本文合 成 了1,4-二(2,3-二 氟-4-正 戊 基 苯基)-2,3-二氰基苯(1a)和1-(2,3-二氟-4-正戊基苯基)-4-(2,3-二氰基-4-正戊基苯基)-2,3-二氟苯(1b)两种多氟多氰取代的单体,合成路线分别见图1和图2。
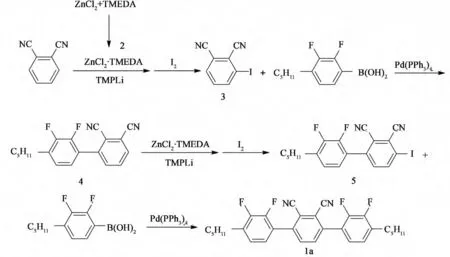
图1 化合物1a的合成Fig.1 Synthesis of compound 1a
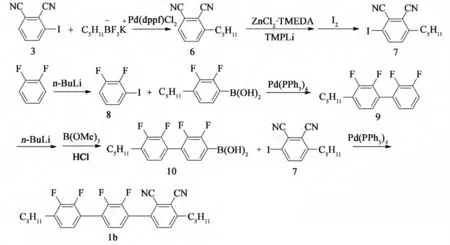
图2 化合物1b的合成Fig.2 Synthesis of compound 1b
2.3 多氟多氰类负性液晶化合物的合成过程
2.3.1 1,4-二(2,3-二氟-4-正戊基苯基)-2,3-二氰基苯(1a)的合成
(1)中间体氯化锌四甲基乙二胺络合物(2)的合成[3]
向250mL反应瓶内,投入6.0g(44.0mmol)的无水氯化锌和120mL 的四氢呋喃,氮气保护。然后滴加10.2g(87.8mmol)的四甲基乙二胺,滴完后室温反应2h。将体系转入250mL圆底瓶中旋干,加入50mL的石油醚,超声10min,抽滤,得到白色固体产品10.6g,收率95%。
(2)中间体2,3-二氰基碘苯(3)的合成[3]
向250 mL 三 口 瓶 内,投 入5.7 g (40.0 mmol)的2,2,6,6-四甲基哌啶和40 mL 的四氢呋喃,氮气保护,保持0 ℃向体系滴加16mL 2.5 mol/L(40.0 mmol)的正丁基锂的己烷溶液,滴完后保持0 ℃反应30 min。然后加入5.1g(20.0mmol)的氯化锌四甲基乙二胺络合物2,加完后继续保持0 ℃反应30min。然后滴加8mL 2.5mol/L(20.0mmol)的正丁基锂的己烷溶液,滴完后保持0 ℃反应1h。向体系内滴加2.6g(20.0mmol)邻 苯 二 甲 氰 的20 mL 四 氢 呋 喃 溶液,滴加完毕后室温反应2h。滴加15.2g(60.0 mmol)碘的30mL 四氢呋喃溶液,滴加完毕后室温反应过夜。向体系加入40 mL 的饱和硫代硫酸钠水溶液,搅拌10min。分液,有机相用40mL的饱和硫代硫酸钠水溶液洗2次,水相用20mL的乙酸乙酯萃取2 次,合并有机相,旋干过硅胶柱。V(石油醚)∶V (乙酸乙酯)=4∶1淋洗得到黄色固体产品3.3g,测得气相色谱纯度GC 为98.4%,收率:65%。
(3)2,3-二氟-4-(2,3-二氰基苯基)-正戊基苯(4)的合成
向500mL反应瓶内,投入2.2g(8.8mmol)的2,3-二氰基碘苯(3)、2.0g(8.8mmol)的2,3-二氟-4-正戊基苯硼酸、3.7g(35.2mmol)的碳酸钠,202mg(0.18mmol)的四三苯基膦钯,然后投入40 mL的甲苯、10mL的乙醇和10mL的水,回流反应4h,TLC 监测表明反应完全。向体系加入20 mL的饱和食盐水和20 mL 的乙酸乙酯,搅拌分液,水相用20mL乙酸乙酯萃取2次,有机相用20 mL饱和食盐水洗2次,合并有机相,旋干后得到黑色固体。过硅胶柱,V(石油醚)∶V (乙酸乙酯)=4∶1淋洗得到白色固体产品2.3g,测得气相色谱纯度GC为99.4%,收率:83%。
(4)2,3-二氰基-4-(2,3-二氟-4-正戊基苯基)碘苯(5)的合成
试验方法与2.3.1步骤(2)3合成类似,测得气相色谱纯度GC为97.9%,收率72%。
(5)1,4-二(2,3-二氟-4-正戊基苯基)-2,3-二氰基苯(1a)的合成
试验方法与2.3.1步骤(3)4合成类似,测得气相色谱纯度GC为98.9%,收率88%。
测试结果如下:
1H NMR(CDCl3,300mol/L):δ =7.80(s,2H,Ph-H),7.10~7.19(m,3H,Ph-H),2.74(t,4H,J=7.6Hz,-CH2-),1.63~1.73(m,4H,-CH2-),1.39(t,8H,J=3.5Hz,-CH2-),0.93(t,6H,J=6.8Hz,-CH3);
13C NMR (CDCl3,300M):δ=151.0 (d,J=12.2Hz),149.5(d,J=14.4 Hz),147.7(d,J=12.3 Hz),146.2 (d,J=14.5 Hz),139.8,134.7,134.6(d,J=13.1 Hz),125.6(t,J=4.0Hz),124.9(d,J=3.4Hz),123.1(d,J=11.4 Hz),117.1,114.8,31.6,29.6,29.0,22.5,14.0;
元素分析结果:
4a:C30H28F4N2,理论值(%)∶C:73.15,H:5.73,N:5.69;实测值(%):C:73.61,H:5.88,N:5.44;
上述结果表明,所得化合物1a结构正确。
2.3.2 1-(2,3-二氟-4-正戊基苯基)-4-(2,3-二氰基-4-正戊基苯基)-2,3-二氟苯(1b)
(1)中 间 体2,6- 二 氰 基-正 戊 基 苯(6)的合成[4-5]
向100 mL 三 口 瓶 中,加 入2.0 g (11.0 mmol)的 正 戊 基 三 氟 硼 酸 钾 盐[6-7]、2.5g(10.0 mmol)的2,3-二 氰 基 碘 苯(3)、410 mg (0.5 mmol)的[1,1’-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物和9.8g(30.0mmol)的碳酸铯,然后加入100mL的甲苯和30mL的水,90 ℃下反应4h,TLC 监测表明反应完全。向体系加入50mL的饱和食盐水和500 mL 的乙酸乙酯,搅拌分液,水相用20 mL 乙酸乙酯萃取2 次,有机相用20mL饱和食盐水洗2 次,合并有机相,旋干后得到黄色固体。过硅胶柱,V(石油醚)∶V(乙酸乙酯)=4∶1淋洗得到白色固体产品1.5g,测得气相色谱纯度GC为98.6%,收率:76%
(2)中间体2,3-二氰基-4-正戊基碘苯(7)的合成
试验方法与2.3.1步骤(2)3合成类似,测得气相色谱纯度GC为97.4%,收率77%
(3)中间体2,3-二氟碘苯(8)的合成
向500 mL 三 口 瓶 内,加 入11.4g (0.10 mol)的邻二氟苯、12.3g(0.11 mol)的叔丁醇钾,然后加入120mL 的四氢呋喃和30mL 的甲基叔丁基醚,氮气保护,将体系冷却至-78 ℃。滴加44mL 2.5M (0.11mol)的正丁基锂的己烷溶液,滴完后保持-78 ℃反应2h。滴加33.0g(0.13mol)的碘的60mL 四氢呋喃溶液,滴加完后将体系缓慢升至室温并反应2h。向体系加入40mL 的饱和硫代硫酸钠水溶液,搅拌10 min。分液,有机相用40mL的饱和硫代硫酸钠水溶液洗2次,水相用20 mL 的乙酸乙酯萃取2 次,合并有机相,旋干过硅胶柱。石油醚淋洗得到无色液体产品18.7 g,测得气相色谱纯度GC 为96.7%,收率:78%。
(4)中间体2,3-二氟-4-(2,3-二氟苯基)-正戊基苯(9)的合成
试验方法与2.3.1步骤(3)4合成类似,测得气相色谱纯度GC为98.4%,收率91%。
(5)中间体2,3-二氟-4-(2,3-二氟-4-正戊基苯基)苯硼酸(10)的合成
向500 mL 三 口 瓶 内,加 入5.4 g (18.2 mmol)的2,3-二氟-4-(2,3-二氟-4-正戊基苯基)苯硼酸(10)和2.5g(21.9mmol)的叔丁醇钾,然后加入100mL的四氢呋喃和20mL的甲基叔丁基醚,氮气保护,将体系冷却至-78 ℃。滴加9mL 2.5M (21.9 mmol)的正丁基锂的己烷溶液,滴完后保持-78 ℃反应1h。滴加2.8g(27.3mmol)的三硼酸甲酯的20mL四氢呋喃溶液,滴加完后保持-78 ℃反应1h,然后将体系缓慢升至室温并反应2h。向体系加入30 mL 6N的盐酸,室温反应2h。分液,有机相用20mL的饱和食盐水溶液洗2次,水相用20mL 的乙酸乙酯萃取2次,合并有机相,旋干得红色固体。加入100mL石油醚,超声5 min,抽滤得到黄色固体产品4.8g,收率:80%。
(6)1-(2,3-二氟-4-正戊基苯基)-4-(2,3-二氰基-4-正戊基苯基)-2,3-二氟苯(1b)的合成
试验方法与2.3.1步骤(3)4合成类似,测得气相色谱纯度GC为98.6%,收率92%。
测试结果如下:
1H NMR(CDCl3,300M):δ=7.72(s,2H,Ph-H),7.29(s,2H,Ph-H),7.09(s,2H,Ph-H),2.97(t,2H,J=7.4 Hz,-CH2-),2.72(t,2H,J=7.3 Hz,-CH2-),1.68~1.76(m,4H,-CH2-),1.39~1.41(m,8H,-CH2-),0.92(s,6H,-CH3);
13C NMR (CDCl3,300 M):δ=151.0(d,J=12.7Hz),149.9(q,J=14.2Hz),149.0,147.7(d,J=12.7 Hz),146.6(q,J=14.2 Hz),137.3,134.8,134.0,133.1(d,J=13.1 Hz),126.3,126.0(d,J=11.7 Hz),125.4,125.2,121.0(d,J=12.3Hz),116.8,116.1,115.0(d,J=18.9 Hz),34.7,31.5,31.4,30.4,29.7,28.9,22.5,22.4,14.0,13.9;
元素分析结果:
1b:C30H28F4N2,理论值(%):C:73.15,H:5.73,N:5.69;实测值(%):C:72.68,H:5.66,N:5.62;
上述结果表明,所得化合物1b结构正确。
3 结果与讨论
3.1 相关液晶参数的测量方法[8-9]
(1)单体液晶化合物的相态温度变化是采用TA-2010 型差热分析扫描仪,采用初始温度30 ℃,加热速率为10℃/min,升温至300℃测定的;通过偏光显微镜观察化合物的织构,并与液晶的标准相图对照,确定化合物的相态。
(2)单体液晶化合物的光学各向异性(Δn)是使用NAR-4T 型阿贝折射仪,采用钠光源(589 nm),在25 ℃温度下,测定由95%(质量分数)SLC0112母体液晶和5%实验单体液晶化合物组成的均匀混合物的nol,nel,计算得到光学各向异性Δnl(Δnl=nol-nel),再外推算出纯(100%)实验单体液晶化合物的光学各向异性(Δn)。
(3)单体液晶化合物的电学各向异性(Δε),是采用HIOKI 3522-50 型电容电抗测试仪,在25 ℃温度下,1kHz条件下,测定由95%(质量分数)SLC0112母体液晶和5%实验单体液晶化合物组成的均匀混合物的ε∥l和ε⊥l,计算得到的电学各向异性Δεl(Δεl=ε∥l-ε⊥l),再外推算出纯(100%)实验单体液晶化合物的电学各向异性(Δε)。
(4)单体液晶化合物的旋转黏度γ1,是采用NDJ-79旋转黏度计,在25 ℃温度下测定由95%(质量分数)FMTA 本体液晶和5%实验单体液晶化合物组成的均匀混合物的γ1,根据公式Logγ1=∑CiLogγ1i,其中Ci是各组分的含量,γ1i是对应组分的粘度值,γ1是混合后的黏度值,再外推算出纯(100%)实验单体液晶化合物的旋转黏度γ1。
3.2 相关液晶参数的测定结果
采用上面的测试方法,得到的液晶参数如表1所示。化合物1a的近晶相织构图如图3所示。
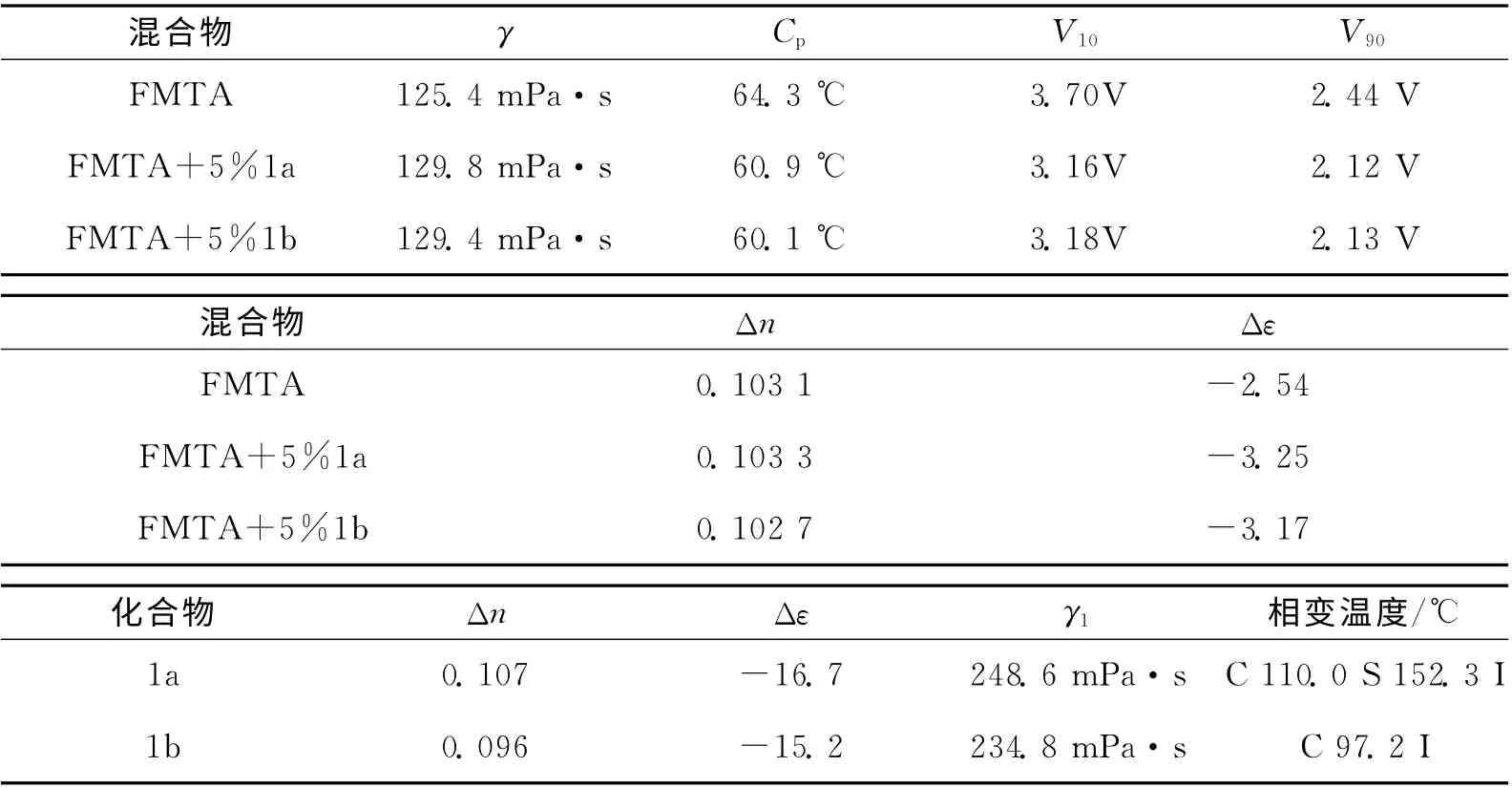
表1 相关的液晶参数Tab.1 Parameters of liquid crystals

图3 化合物1a在降温至114.3 ℃时呈现出的近晶相织构图Fig.3 Smectic texture of 1a at 114.3 ℃ during cooling
3.3 讨论[10-11]
(1)本文合成的2个多氟多氰类化合物,其中合成的中间体结构单元,可以广泛应用于其他液晶单体的合成,并得到多种含有多氟多氰结构的负介电各向异性液晶单体。
(2)分子中引入体积较大的氰基作为侧向取代基使得体系黏度有所上升,降低了化合物的光稳定性,随着氰基数量的增加,与其他液晶混溶性会变差,清亮点也有所降低。而侧向双氰基取代的液晶中因为2个氰基的偶极矩矢量和恰好与分子长轴垂直而呈现出更强的负介电各异性值,达到了-15左右,但是黏度并不按比例增加,并且会促进近晶相的形成。
(3)由于侧向含有氰基取代基,会在一定程度上增加体积的黏度降低清亮点,而侧向引入多个氟原子基本不会改变母体化合物的相态特征,还可以保持低黏度和低熔点,还具有高电荷保持率和光稳定性较高等特点,这使得该类化合物与同类型含有氰基化合物相比,更容易在对母体黏度影响较小的情况下调节介电各向异性Δε,使之有更广泛的应用,这在一定程度上缓解了引入双氰基所带来的缺点。
(4)由于分子中含有多个苯环结构,使得分子中的共轭体系较长,但是由于分子中侧向含有较多氟原子,降低了苯环分子的电子云密度,极化度变弱,液晶分子的光学各向异性(Δn)值下降,所以和同类型的无氟无氰基液晶分子相比光学各向异性(Δn)值较小。
综上所述,本文合成的两种含有多氟多氰类结构的液晶化合物具有较小的光学各向异性(Δn)和负值很大的介电各项异性(Δε)。氰基和氟原子的引入,使得该类化合物熔点较低,具有较大的负介电各向异性(Δε)值和较小的光学各向异性(Δn)值。该类多氟多氰化合物可以应用于液晶显示器件,有效地改善液晶母体的性能,调节液晶母体的介电各向异性值和降低驱动电压等。
4 结 论
以邻苯二甲腈和邻二氟苯为原料,通过一系列反应合成了2种含有多氟多氰结构的新型液晶单体。通过核磁共振(NMR)、元素分析(EA)等方法确认了分子结构;利用偏光显微镜(POM)、示差扫描量热仪(DSC)和旋转黏度计等测试手段,对其参数进行测定。实验表明,该类新型的多氟多氰类化合物具有具有较小的光学各向异性值(Δn=0.096~0.107)、负值很大的介电各向异性值(Δε=-15.2~-16.7)和较大的旋转黏度(γ1=234.8~248.6mPa·s),可 以 用 于 液 晶 母体的调配,改善液晶材料的部分性能,且制备方法原料易得,收率较高,易于实现工业化生产。
[1] Tamai K,Kaneko T,Shiomi M,et al.FLC mixtures containing laterally fluorinated compounds with an acetylene linkage for theτ-Vminmode[J].Bull.Chem.Soc.Jpn.,1994,67(9):2550-2553.
[2] Reiffenrath V,Krause J,Plach H J,et al.New liquid-crystalline compounds with negative dielectric anisotropy[J].Liq.Cryst.,1989,5(1):159-170.
[3] Snegaroff K,Komagawa S,Chevallier F,et al.Deprotonative metalation of substituted benzenes and heteroaromatics using amino/alkyl mixed lithium-zinc combinations[J].Chem.Eur.J.,2010,16(27):8191-8201.
[4] Molander G A,Rivero M R.Suzuki cross-coupling reactions of potassium alkenyltrifluoroborates[J].Org.Lett.,2002,4(1):107-109.
[5] Dreher S D,Lim S E,Deidre L,et al.Suzuki-Miyaura cross-coupling reactions of primary alkyltrifluoroborates with aryl chlorides[J].J.Org.Chem.,2009,74(10):3626-3631.
[6] Ren C L,Xu S Y,Xu J,et al.Planar macrocyclic fluoropentamers as supramolecular organogelators[J].J.Org.Lett.,2011,13(15):3840-3843.
[7] Molander G A,Biolatto B.Efficient ligandless palladium-catalyzed suzuki reactions of potassium aryltrifluoroborates[J].Org.Lett.,2002,4(11):1867-1870.
[8] Greenfield S,Coates D,Goulding M,et al.Nematogenic later ally fluorinated biphenyls with polar terminal groups[J].Liq.Cryst.,1995,18(4):665-672.
[9] Peer K,Matthias B.Nematic liquid crystals for active matrix displays:molecular design and synthesis[J].Angew.Chem.Int.Ed.,2000,39(23):4216-4235.
[10] 尚洪勇,张建立,刘鑫勤,等.多氟二苯乙炔类负性液晶化合物的合成[J].液晶与显示,2009,24(5):650-655.Shang H Y,Zhang J L,Liu X Q,et al.Synthesis of multifluorotolane negative dielectric anisotropy liquid crystals[J].Chinese Journal of Liquid Crystals and Displays,2009,24(5):650-655.(in Chinese)
[11] 史子谦,丰景义,贵丽红,等.高折射率液晶化合物与液晶混合物[J].液晶与显示,2013,28(3):310-314.Shi Z Q,Feng J Y,Gui L H,et al.High birefringence LC compounds and LC mixtures[J].Chinese Journal of Liquid Crystals and Displays,2013,28(3):310-314.(in Chinese)
