罗布泊糖霉菌属放线菌系统进化分析
2014-03-21韩晓雪吕玲玲罗晓霞张利莉
韩晓雪 吕玲玲 罗晓霞 张利莉
(塔里木大学生命科学学院/新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室, 新疆 阿拉尔 843300)
罗布泊位于新疆塔里木盆地东部,曾是我国第二大内陆湖,现已干涸。罗布泊地区常年干旱,日照强度强,昼夜温差大,夏季气温高达71 ℃,为一望无际的戈壁滩,被视为“生命禁区[1]”。2012年,关统伟对罗布泊地区土壤放线菌非培养和可培养多样性进行了研究。可培养发现18个属的放线菌,其中放线多孢菌属(Actinopolyspora)是罗布泊盐湖中纯培养的优势类群,并且发现8个新物种;非培养结果发现,糖霉菌属(Glycomyces)为罗布泊地区优势菌群,打破了人们对环境中链霉菌为放线菌优势菌群的常规认识[2]。
Glycomyces为糖霉菌科(Glycomycetaceae)典型属,1997年由Stackebrandt等人根据16S rRNA序列相似性提出[3],是糖霉菌科中最大的一个属,包括11个有效发表的种,Glycomycesharbinensis作为该科的模式种[4]。Glycomyces放线菌均分离自植物或土壤,除Glycomyceshalotolerans分离自极端特殊环境,可耐受10%盐浓度外,其余种都分离自普通环境[4-10]。迄今为止,罗布泊Glycomyces多样性的研究鲜有报道。本研究以新疆罗布泊地区土壤样品为材料,使用5种培养基,共分离到7株Glycomyces放线菌,将分离得到的Glycomyces放线菌菌株通过16S rDNA测序,利用系统发育分析,以期揭示罗布泊土壤Glycomyces放线菌的多样性,为开发利用这一类微生物资源提供理论基础和菌种支持。
1 材料与方法
1.1 材料
1.1.1 样品来源及处理
2010年从新疆罗布泊采集土壤样品。样品采集后装于无菌的自封袋中,运抵实验室后保存在-20℃冰箱中。
土壤样品自然风干,称取2 g土壤样品放入18 mL的无菌15. 06% NaCl溶液中,加入无菌玻璃珠,37℃充分振荡1 h,制成10-1悬浊液。
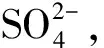

表1 罗布泊土壤样品理化性质鉴定结果
1.1.2 主要仪器和试剂
PCR仪:德国SensoQuest Labcycler;凝胶成像系统:美国BIO-RAD;高速离心机:德国Eppendorf。
PCR扩增全套试剂购自广州东盛生物科技有限公司;限制性内切酶HaeIII,连接试剂盒pMD18-T购自TaKaRa。其他生化试剂均为国产分析纯。
1.2 培养基
分离培养基:(1)甘油精氨酸培养基(G-J)[12](2)甘露醇酸水解酪蛋白培养基(GW1)[13](3)高氏一号培养基(GSA) (4)淀粉酸水解酪蛋白培养基(SCK)[14](5)甘油天冬氨酸培养基(C1)[15]。
1.3 菌株的分离与纯化
利用上述培养基,分别设置1. 5%、5%、10%、15%和20%五个盐浓度梯度,采用稀释平板涂布法进行分离。培养基加入重铬酸钾以抑制细菌和霉菌的生长。37℃恒温培养3周,再挑取分离培养平板上放线菌形态不同的单菌落转接到相应盐浓度的纯化培养基ISP-4上。
1.4 DNA的提取、菌株鉴定及其系统发育分析
采用SDS-CTAB法提取菌株DNA[16],选取细菌16S rRNA通用引物27F(5′-AGAGTTTGATCCTGGCTC-3′),1492R(5′-CGGCTACCTTGTTACGACTT-3′)进行扩增。将PCR扩增产物纯化后进行测序。测序结果在GenBank 数据库中通过BLAST 程序进行相似性比对,构建系统进化树。用MEGA 5.1 Bate2 软件进行多序列比对,并采用邻接法(Neighbor-joining)构建系统发育树。
1.5 抗菌活性
牛津杯法又称管蝶法[17-18]。以金黄色葡萄球菌,表皮葡萄球菌,大肠杆菌和白色念珠菌为靶标菌(表2)。以Glycomyces放线菌发酵液为原料,筛选菌株抗菌活性。
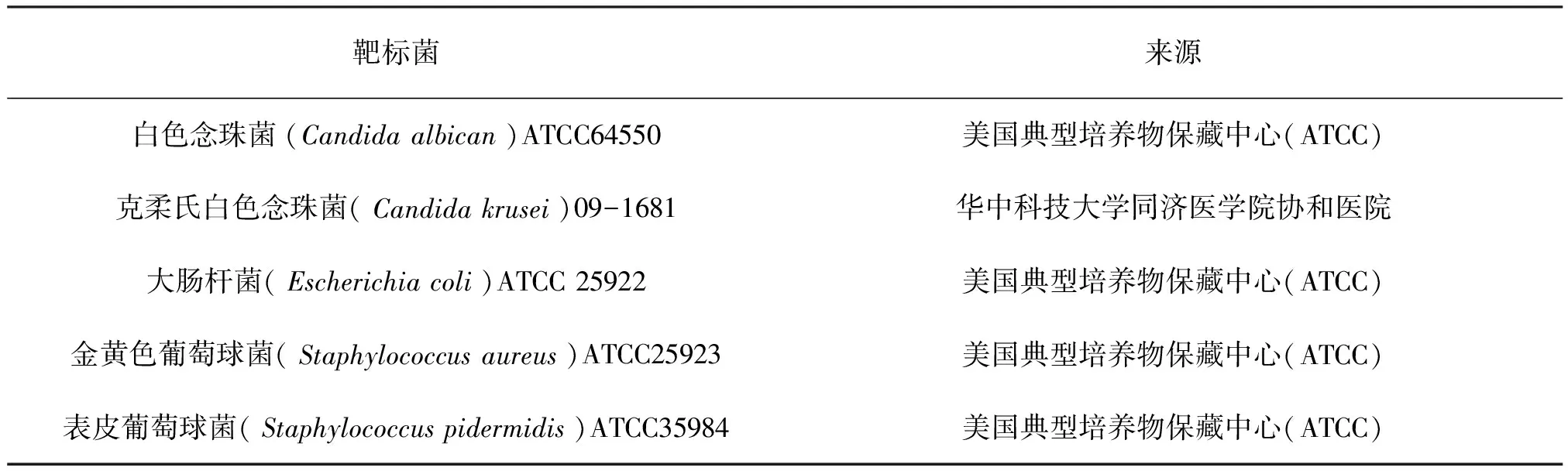
表2 靶标菌信息
2 结果
2.1 罗布泊地区Glycomyces放线菌物种多样性
通过稀释平板涂布法对罗布泊土壤放线菌进行分离培养,经过测序和序列比对,共分离到7株Glycomyces的放线菌菌落形态见图1,菌丝形态见图2。菌株TRM 49570和TRM 45406与Glycomyceshalotolerans TRM 40137T相似性为99. 07%和100%,其余5株TRM 49117、TRM 49136、TRM 45387、TRM 45127和TRM 45198与其亲缘关系最近菌株的相似性在94. 00~96. 58%之间(表3),可能为Glycomyces的潜在新分类单元。

图1 罗布泊Glycomyces放线菌单菌落形态

图2 罗布泊Glycomyces放线菌菌丝形态(100×)
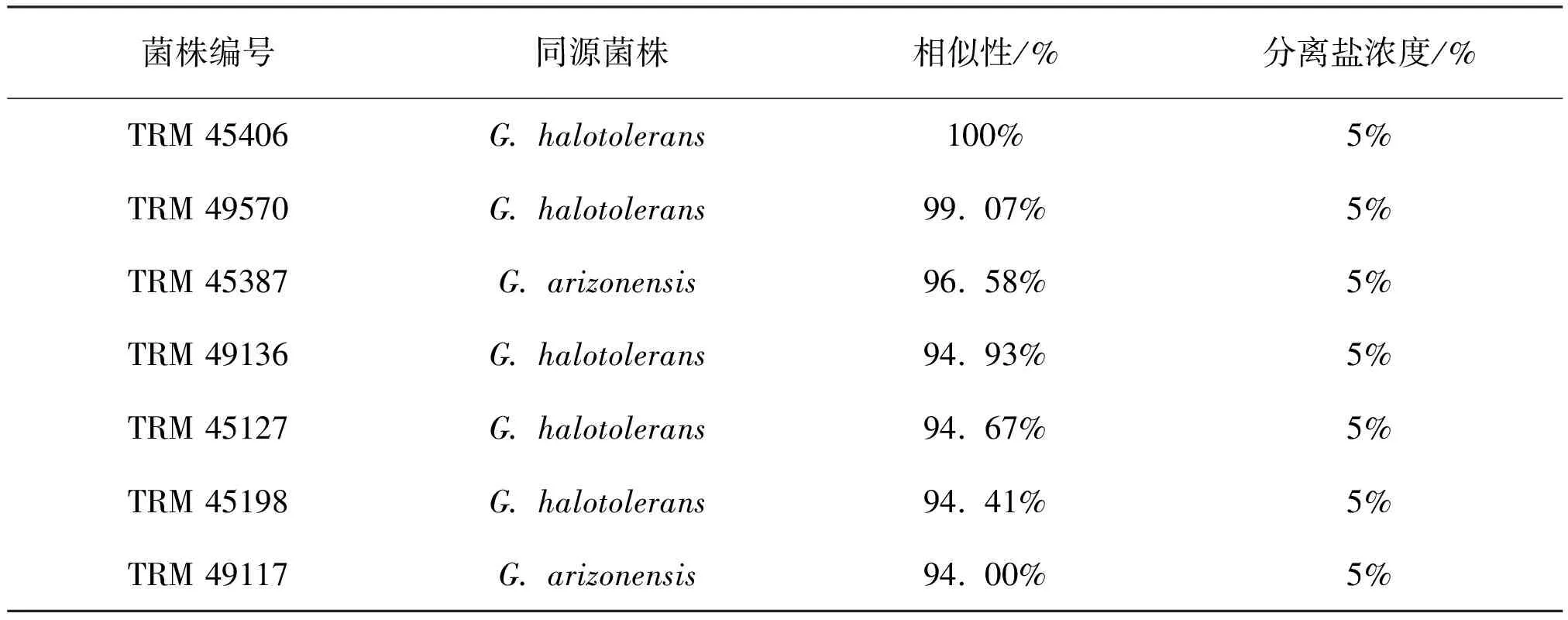
表3 罗布泊Glycomyces放线菌16S rRNA序列相似性比对结果
由图1和2可以看出,罗布泊地区Glycomyces放线菌形态多样,菌落圆形,TRM 45198菌落为肉芋色,其余均为白色,TRM 45127和TRM 45198菌落表面光滑,呈珍珠状,TRM 45406和TRM 49570菌落表面呈绒毛状,TRM 49117,TRM 45387和TRM 40137菌落表面有明显的褶皱,除TRM 45127和TRM 45198都可产生白色的气生菌丝,TRM 49117还可产生深褐色的可溶性色素。在光学显微镜下可见细长、弯曲的菌丝,分枝明显。其中,TRM 45387、TRM 45127和TRM 49117菌丝分枝较多。
2.2 罗布泊地区Glycomyces放线菌系统进化关系
将7株Glycomyces放线菌测序后,通过GenBank 数据库由BLAST 程序进行相似性比对,下载邻近菌株序列,用MEGA 5.1 Bate2 软件在Glycomycetaceae内进行多重序列比对,采用邻接法(Neighbor-joining)构建系统发育树,如图3所示。
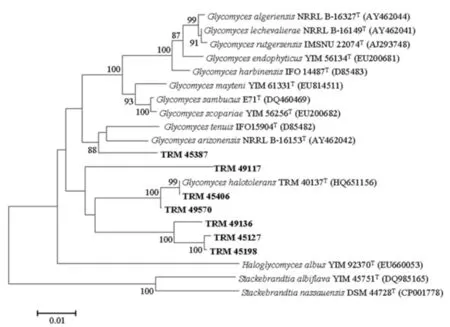
图3 罗布泊地区Glycomyces菌株系统发育树
由图3可见,菌株TRM 49117、TRM 49136 、TRM 45387、TRM 45127和TRM 45198以极高的自展值在Glycomycetaceae科内形成稳定的、独立的分支,根据比对结果和进化距离分析,它们同最近亲缘关系的G.halotoleransTRM 40137T和G.arizonensisNRRL B-16153T的相似性仅为94. 00%、94. 93% 、96. 58%、94. 67%和94. 41%代表Glycomyces内的新种。
菌株TRM 45127和TRM 45198间的相似性为99%,可能为同一个种的不同菌株;TRM 45127和TRM 45198与TRM 49136的相似性均为98%,可能为相同种,但是根据菌株的菌落形态(图1 e、f、g)和显微形态(图2 e、f、g)特征差异,可以初步推断TRM 45127和TRM 45198与TRM 49136为不同种,还需进一步验证。菌株之间的相似性见表4。
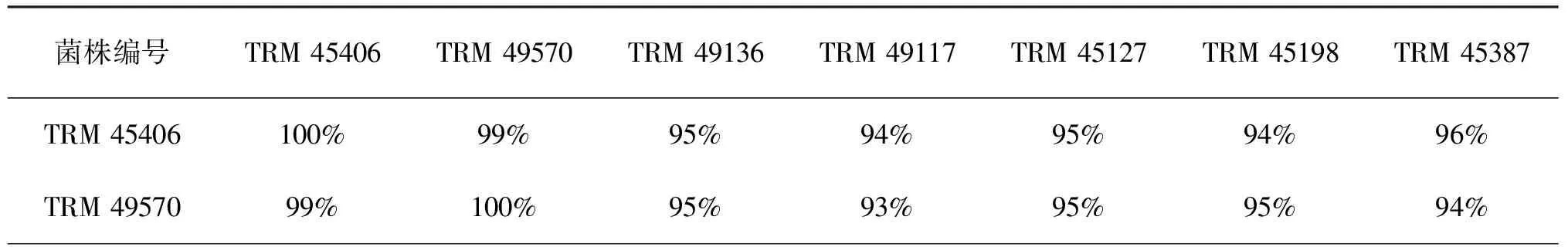
表4 罗布泊Glycomyces菌株间相似性比较
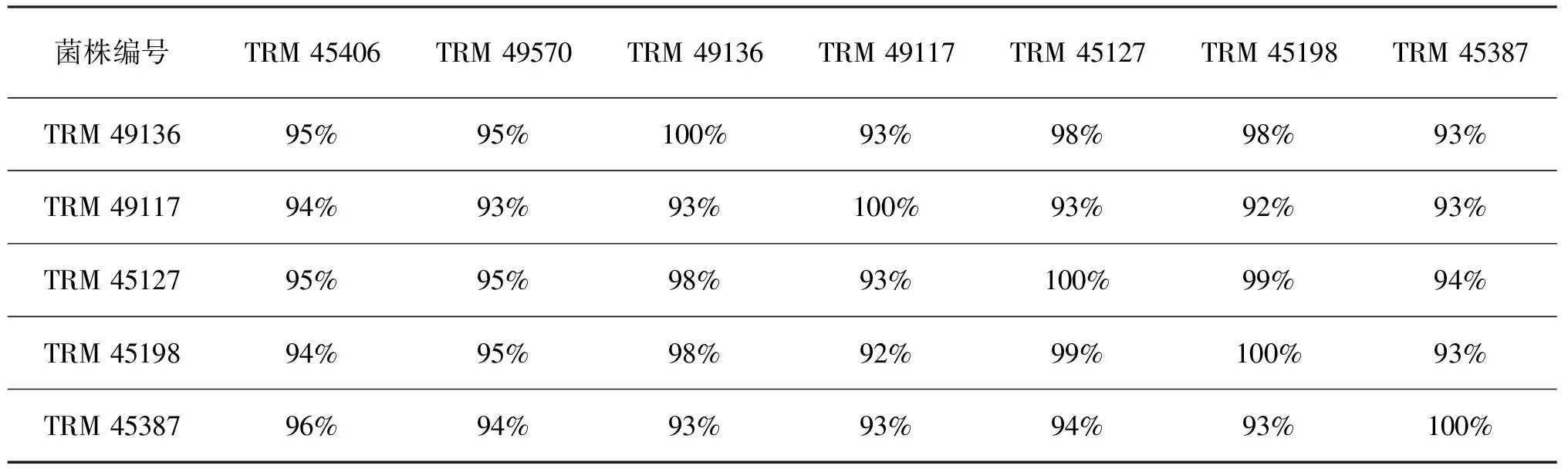
续表4 罗布泊Glycomyces菌株间相似性比较
2.3 抗菌活性
7株Glycomyces放线菌发酵液经过抗菌活性检测,结果见图4。
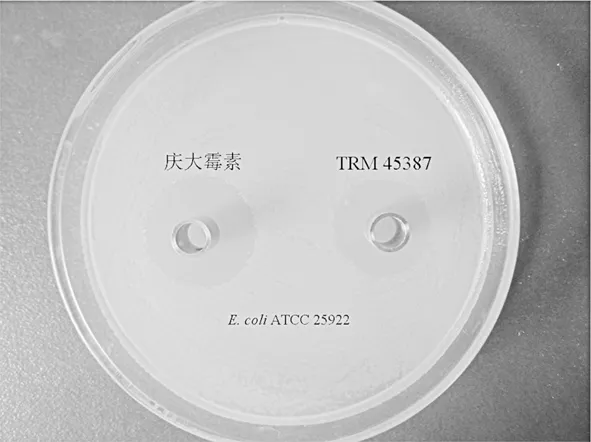
图4 菌株TRM 45387对E. coli 7-5抑菌活性(庆大霉素 5μg/mL)
由以上结果可以看出,仅TRM 45387对E. coli 7-5表现出抑制作用,抑菌圈大小为22±1 mm,其余6株均未对白色念珠菌、金黄色葡萄球菌、表皮球菌、大肠杆菌表现出抑制活性。
3 讨论
本研究表明罗布泊地区Glycomyces放线菌在营养需求上与普通环境的Glycomyces放线菌表现出明显差异,这种差异主要表现在分离培养基的营养配比上。从已有研究来看,Glycomyces放线菌除G.halotolerans分离自极端特殊环境土壤外,其余种类都分离自植物和土壤等普通环境,比较这些Glycomyces放线菌的分离培养基发现,主要含有酵母提取物[4-10],酵母提取物的主要成分为多肽、氨基酸、核苷酸、B族维生素及微量元素,被认为是最为理想的生物培养基原料。而酵母提取物用于罗布泊贫瘠土壤则分离不到任何Glycomyces放线菌。土样理化性质检测表明,罗布泊地区属于典型的盐碱环境,与已报道分离出Glycomyces的其它环境有较大区别,土壤总盐含量为15. 06%,阳离子主要为Na+,其次为K+,阴离子则以Cl-为主,土壤有机质含量极低,营养极为匮乏。这些原因可能导致了罗布泊地区Glycomyces在种类上明显不同于其它普通环境。
本研究分离到的7株Glycomyces放线菌中70%以上的菌株与已发表菌株序列的相似性低于97%,且亲缘关系最近的G.halotoleransTRM 40137T也分离自罗布泊。从系统进化树中也可以看出,除TRM 45387外,罗布泊地区的Glycomyces放线菌形成一个相对独立的大分支。从已完成的TRM 49117和TRM 49136的多相分类工作来看,比较它们与Glycomyces其它成员的差异发现,罗布泊地区Glycomyces可耐受较高的盐浓度,可在高于10%的培养基中生长;细胞化学组成也不同于Glycomyces其他成员,如TRM 49117和TRM 49136的极性脂类型较Glycomyces其他成员更丰富。根据表型、化学型及基因型的特征,因此可以确定菌株TRM 49117和TRM 49136是Glycomyces的新分类单元。这些罗布泊地区Glycomyces放线菌的独特性可能是在罗布泊独特的地理位置和高温干旱的气候环境中长期适应进化而形成的。地理位置和气候环境可能是导致它们差异的根本原因,这些种类是否存在真正意义上的生物地理分布,尚有待进一步研究。
自抗生素被发现以来,三分之二以上都是由放线菌产生的。当普通环境发现新活性代谢产物的可能性逐渐降低时,人们将目光投向了极端特殊环境和海洋环境。目前,已从土壤[5]、药用植物[9]、海洋[10]和海洋沉积物[19]等环境中分离到Glycomyces的放线菌。而罗布泊高温干旱、高盐碱的环境蕴藏着大量Glycomyces放线菌的未知新资源,这些新物种的发现必定将伴随着新的代谢产物及活性物质的产生。自1985年Labeda等人建立Glycomyces以来的20多年中,仅 Labeda等人(1987)报道了来源于菌株G.harbinensisATCC 43155T能产生无定形的氨基酸类物质,具有抗菌和抗肿瘤活性,对革兰氏阴性菌、阳性菌、小鼠淋巴细胞性白血病 P388、人类肺癌和结肠癌细胞等有抑制作用[20]。近年来,随着研究技术的不断进步,越来越多具有抗菌活性的Glycomyces放线菌被报道。Adeline Su Yien Ting等人(2009)从土壤和植物根际土壤中分离到2株Glycomyces放线菌,它们对金黄色葡萄球菌,大肠杆菌和绿脓杆菌都有很好的抑制作用[21];袁丽杰等人(2012)从药用植物蒿本的根际土壤中分离到一株Glycomyces放线菌I06-02658,其发酵液具有Caspase7 抑制活性[22]。通常放线菌产生的代谢产物多数都对革兰氏阳性菌有明显的抑制作用,对革兰氏阴性菌的抑菌率相对较低,而本研究中TRM 45387仅对大肠杆菌表现出较好的抑菌活性。有研究表明氨基糖苷类、β-内酰胺类或四环素类抗生素对革兰氏阴性菌有很好的抑制作用的同时,对革兰氏阳性菌也有抑菌活性[23]。由此看来TRM 45387可能具有产生只抑制革兰氏阴性菌的“特异性”新化合物的能力,而罗布泊来源的Glycomyces是否具有其它生物活性尚不得而知。因此可以认为,Glycomyces作为一类较为“年轻”的物种具有较高的研究价值,值得深入研究。
[1] 袁世斌,周婷,董微,等. 罗布泊沙土微生物生态分布特征[J]. 兰州大学学报(自然科学版),2009, 45(6): 19-22.
[2] 关统伟. 新疆罗布泊盐湖放线菌多样性及多相分类[D]. 四川农业大学,2012.
[3] Stackebrandt E, Rainey F A, Ward-Rainey N L. Proposal for a new hierarchic classification system, Actinobacteria classis nov.[J]. Int J Syst Bacteriol, 1997, 47: 479-491.
[4] Labeda D P, Testa R T, Lechevalier M P, et al.Glycomyces, a New Genus of the Actinomycetales[J]. Int J Syst Evol Microbiol Bacteriology, 1985, 35: 417-421.
[5] Labeda D P, Kroppenstedt R M. Emended description of the genusGlycomycesanddescriptionofGlycomycesalgeriensissp. nov.,Glycomycesarizonensissp. nov. andGlycomyceslechevalieraesp. nov[J]. Int J Syst Evol Microbiol, 2004, 54(6): 2343-2346.
[6] Qin S, Wang H B, Chen H H, et al.Glycomycesendophyticussp. nov., an endophytic actinomycete isolated from the root of Carex baccans Nees[J]. Int J Syst Evol Microbiol, 2008, 58(11): 2525-2528.
[7] Guan T W, Xia Z F, Xiao J, et al.Glycomyceshalotoleranssp. nov., a novel actinomycete isolated from a hypersaline habitat in Xinjiang, China[J]. Antonie Van Leeuwenhoek, 2011, 100(1): 137-143.
[8] Qin S, Chen H H, Klenk H P, et al.Glycomycesscopariaesp. nov. andGlycomycesmayteni sp. nov., isolated from medicinal plants in China[J]. Int J Syst Evol Microbiol, 2009, 59(5): 1023-1027.
[9] Gu Q, Zheng W, Huang Y.Glycomycessambucussp. nov., an endophytic actinomycete isolated from the stem of Sambucus adnata Wall[J]. Int J Syst Evol Microbiol, 2007, 57(9): 1995-1998.
[10] Evtushenko L I, Taptykova S D, Akimov V N, et al.Glycomycestenuissp. nov[J]. Int J Syst Bacteriol, 1991, 41: 154-157.
[11] 鲍士旦. 土壤农化分析[M].第三版.北京: 中国农业出版社,2000.
[12] Shirling E B, Gottlieb D. Methods for characterization of Streptomyces species[J]. Int J Syst Bacteriol, 1966, 16: 313-340.
[13] 关统伟,吴晋元,唐蜀昆,等. 新疆塔里木盆地可培养嗜盐放线菌系统发育多样性[J]. 微生物学通报, 2008, 35(11): 1698-1702.
[14] Cui X L, Mao P H, Zeng M, et al.Streptimonosporasalinagen. nov., sp. nov., a new member of the family Nocardiopsaceae[J]. Int J Syst Evol Microbiol, 2001, 51(2): 357-363.
[15] 陈正军. 硝尔库勒湖放线菌多样性及聚酮类功能基因的发掘硝尔库勒湖放线菌多样性及聚酮类功能基因的发掘[D]. 塔里木大学, 2012.
[16] 徐丽华,李文均,刘志恒. 放线菌系统学---原理、方法及实践.第一版.北京:科学出版社,2007: 98-99.
[17] 钱存柔,黄仪秀.微生物学实验教程[M].北京大学出版社,2000: 207-208.
[18] Diao W R, Hu Q P, Feng S S, et al. Chemical Composition and Antibacterial Activity of the Essential Oil from Green Huajiao (Zanthoxylum schinifolium) against Selected Foodborne Pathogens[J]. Agricultural and Food Chemistry. 2013, 61(25):6044 6049.
[19] Bredholdt H, Galatenko O A, Engelhardt K, et al. Rare actinomycete bacteria from the shallow water sediments of the Trondheim fjord, Norway: isolation, diversity and biological activity[J]. Environ Microbiol, 2007, 9(11): 2756-2764.
[20] Lee M D, Borders D B, Labeda D P, et al. Preparation of antibiotic LL-D05139 beta from cultures ofGlycomycesharbinensis, gen. nov., sp. nov.[P]. US4568646A.
[21] Ting A S Y, Tan S H, Wai M K. Isolation and Characterization of Actinobacteria with Antibacterial Activity From Soil and Rhizosphere Soil[J]. Australian Journal of Basic and Applied Sciences, 2009, 4(3): 4053-4059.
[22] 袁丽杰,刘爱华,张玉琴,等. 一株根际放线菌的分离鉴定及其生物活性初探[J]. 生物技术通报,2012(03): 117-122.
[23] 张致平. 抗革兰氏阴性细菌感染药物的研究现状与进展[J]. 中国抗生素杂志,2003,28(12): 705-711,736.
