新疆民族特色酸奶及酸奶疙瘩中乳酸菌的分离鉴定及其生物膜形成能力检测
2014-03-21
(1新疆南疆特色农产品深加工兵团重点实验室, 新疆 阿拉尔 843300)(2新疆塔里木大学生命科学学院, 新疆 阿拉尔 843300)(3 辽宁大连工业大学食品学院, 辽宁 大连 116000)
乳酸菌(Lactic acid bacteria,LAB)是一类能够发酵碳水化合物主要产物为乳酸的无芽孢、革兰氏阳性细菌的总称。它在自然界中广泛存在,它不仅可以提高食品附加值和保藏性,还能帮助调节肠道微生态平衡,具有促进营养物质有效吸收的保健功能[1]。近年来,乳酸菌已经作为益生菌广泛应用于食品及药品领域中,含有大量乳酸菌的乳制品是营养与保健功能兼备的现代人的理想食品之一。新疆民族特色酸奶及酸奶疙瘩因其独特的风味及丰富的营养逐渐成为一种流行的优质食品。酸奶疙瘩是酸奶子的结晶体,是哈萨克族、柯尔克孜族及蒙古族等少数民族牧民家制的自然发酵奶制品之一,它是采用牛(羊)奶自然发酵后去水自然干燥成的固体或半固体食品[2]。千百年来新疆牧民沿袭古老而传统的方法制作的酸奶疙瘩具有风味独特的特点,这表明酸奶疙瘩中蕴含有传代性好、抗逆性强、风味独特的乳酸菌菌群,进而可以分离筛选出发酵性能良好的乳酸菌,应用于发酵乳制品的生产中。国内学者对新疆酸奶及酸奶疙瘩中乳酸菌也有报道,赵蕊[3]等对15份采自新疆伊犁牧民家庭传统方法制作的酸奶子中分离出71株乳酸菌,并发现乳杆菌为优势菌,其中瑞士乳杆菌(L.helveticu)为最优势种;彭斌[2]等对对采自新疆伊犁、塔城、乌鲁木齐白杨沟的传统奶疙瘩中的乳酸菌进行了分离,经形态学和生化试验,得到初步定为乳酸菌的菌株18株;而对于新疆其他地区牧民家庭自制的酸奶及酸奶疙瘩的研究并未见报道。乳酸菌能够产生多种有益的代谢产物,例如乳酸、细菌素、胞外多糖等。胞外多糖是由发酵产生的、分泌于细胞外的一种糖类化合物,它对改善发酵乳制品的组织状态起着重要作用。同时,它也是细菌形成生物膜结构的必需物质。生物膜是一种黏附于生物或者非生物材料表面由细菌群体和包裹群体的基质组成的聚合体[3]。这种包裹菌体的基质是生物膜形成的必要条件,其主要成分即为胞外多糖,占总量的50%~90%[4]。目前有关将微生物生物膜的特性应用于生防试剂、生物反应器及生物修复等方面已有较多报道,乳酸菌是一类公认安全的益生菌,其生物膜的应用前景更为广阔。
本研究以新疆民族特色乳制品为研究对象,对其进行乳酸菌的分离,然后采用生理生化检测与分子生物学手段相结合的方法对乳酸菌进行鉴定,然后探索其生物膜的形成情况,为更进一步开发利用乳酸菌资源及乳酸菌生物膜奠定基础。
1 材料和方法
1.1 实验仪器
PCR仪(Bio-Rad),96孔细胞培养板(Labphil),恒温培养箱(上海),移液器( Eppendorf),吸收光酶标仪(Biolog ELx808TM)等。
1.2 实验药品
MRS肉汤培养基(北京奥博星生物技术有限公司),PCR相关试剂均购自Takara公司,碳源利用试验中的各种糖醇类试剂均为进口分装,其他实验相关药品均为国产分析纯。
1.3 样品采集
样品为分别采自从新疆克孜勒苏柯尔克孜自治州阿合奇县、伊犁哈萨克自治州那拉提草原及新源县城、哈密地区巴里坤草原等地区的酸奶及奶疙瘩等民族特色乳制品。
1.4 乳酸菌的分离纯化及鉴定
1.4.1 乳酸菌的分离及纯化
液体样品直接划线接种于固体MRS平板;固体样品表面用无菌生理盐水清洗,研碎后以1:9的比例置于MRS液体培养基中富集培养[1],37 ℃静置培养24~48 h,梯度稀释后划线接种于固体MRS平板;MRS琼脂培养基均添加有1/10 000浓度放线菌酮,接种后置于37 ℃条件下培养24~72 h。将分离纯化后的菌株进行革兰氏染色及过氧化氢酶测定,将革兰氏阳性、过氧化氢酶阴性的菌株暂定为乳酸菌[5]。将其用甘油管保存于-80 ℃冰箱中备用。
1.4.2 乳酸菌的理化鉴定
参考相关文献[6-7],对分离纯化的乳酸菌进行生理生化鉴定,包括葡萄糖产酸产气试验、耐盐性试验、温度生长试验、pH耐受试验、碳源利用试验(包括阿拉伯糖、果糖、半乳糖、葡萄糖、乳糖、麦芽糖、甘露醇、鼠李糖、核糖、山梨醇、蔗糖、木糖、棉籽糖)、明胶液化试验、石蕊牛奶试验、硫化氢产生试验、柠檬酸盐利用试验、硝酸盐还原试验等。
1.4.3 乳酸菌16S rDNA测序分析[9]
采用SDS法提取细菌基因组DNA,对其进行16S rDNA测序分析。革兰氏阳性细菌的通用引物作为扩增引物,上游引物(27F):5’-AGAGTTTGATCATGGCTCAG-3’;下游引物(1492R):5’-AAGGAGGTGATCCAGCC-3’;扩增条件为:94 ℃,5 min;(94 ℃,30 s;55 ℃,1 min;72 ℃,1. 5 min;30个循环);72 ℃,10 min。PCR扩增结束后,120 V电泳30 min,EB染色,凝胶成像系统成像,将PCR产物送至上海生工测序。测序结果与Genbank中的序列进行同源性比对(http://www.ncbi.nlm.nih.gov/BLAST/),将比对结果作为菌株最终的鉴定结果。
1.5 乳酸菌生物膜形成情况检测
根据文献报道[9-10]并略作改动,采用微量板半定量法对所分离得到的乳酸菌进行生物膜形成能力检测。按1:200的比例接种过夜培养的菌液至MRS液体培养基中,吸取200 μL上样至96孔细胞培养板,37 ℃恒温静置培养48 h,拍出培养液,无菌水洗板4次,56 ℃烘干固定1 h,50 μL 0. 5%结晶紫染色5 min,自来水冲洗除去多余染液,37 ℃晾干,用酶标仪测定波长490 nm处的OD值。每一培养板中同时设阳性对照(ATCC 35984)、阴性对照(ATCC 12228)与空白对照(等体积的空白MRS培养基),所有生物膜形成检测试验均在不同时间重复3次。
2 结果与分析
2.1 新疆民族特色酸奶及酸奶疙瘩中乳酸菌多样性分析
经分离纯化后共获得110株乳酸菌,分别通过生理生化及分子生物学鉴定后,乳酸菌分布情况见表1。从表中可以看出,在本研究中,新疆民族特色酸奶及酸奶疙瘩中所分离得到的戊糖乳杆菌(L.pentosus),占菌株总数的48. 18%,在本研究结果中为优势种;其次为副干酪乳杆菌(L.paracasei),占菌株总数的25. 45%;同时发现乳杆菌占所分离菌株总数的92. 72%,在所采集的样本中为绝对优势菌属,主要可能有两个方面的原因,一是与所采集的酸奶及酸奶疙瘩样品酸度较高有关系,一般来说,酸度高有利于乳酸杆菌的生长,而会抑制乳酸球菌的生长。据报道,新疆塔城地区酸奶疙瘩的酸度平均为2. 8(酸度以乳酸计)[2]。酸度高也有利于抑制霉菌的生长;二是可能与所采用的分离培养基有关,MRS培养基所含有的营养物质更适合于乳酸杆菌的生长繁殖[12],导致在所分离的菌株中乳杆菌为绝对优势菌属。另外,还发现了一株潜在新种,编号为48,属于肠球菌属,其最相近种为屎肠球菌(EnterococcusfaeciumATCC 19434),经测序比对之后其16S rRNA相似度为93. 9%,该菌株的进一步鉴定工作正在进行中。所分离菌株的系统发育分析见图1。从图1中可以看出,所分离得到的乳酸菌分布在2个属,共10个种,其中潜在新种属于肠球菌属,命名为Enterococcusxinjiangensis-48。

表1 所分离乳酸菌分布情况

续表1 所分离乳酸菌分布情况

图1 所分离乳酸菌的系统发育分析
2.2 乳酸菌生物膜形成能力检测
对所分离得到的110株乳酸菌进行生物膜形成能力检测,结果如图2所示。在检测的乳酸菌中,生物膜为阳性的共70株,占菌株总数的63. 64%。在本研究中检测的生物膜阳性乳酸菌全为乳酸杆菌,并且生物膜阳性乳杆菌的比例占总数的68. 32%,从中可以看出乳杆菌生物膜形成能力较强,这可能与大多数乳杆菌都能够分泌合成大量胞外多糖所致。在生物膜阳性的乳杆菌中,戊糖乳杆菌(L.pentosus)共43株,占生物膜阳性菌株总数的62. 32%,同时占戊糖乳杆菌总分离菌株数的81. 13%;副干酪乳杆菌(L.paracasei),占生物膜阳性菌株数的26. 09%,占总分离菌株数的64. 29%。另外值得指出的是,所分离的9株肠球菌属的乳酸菌,其生物膜表型检测均为阴性,这可能是因为本研究中所分离得到的均为屎肠球菌(E.faecium),而国内外所报道的能够形成生物膜的肠球菌多为粪肠球菌(E.faecalis),而无屎肠球菌,可能是因为该种肠球菌形成胞外多糖的能力有限所致。
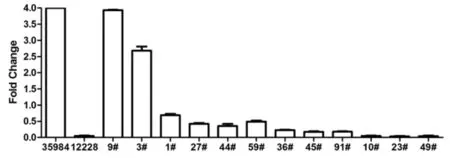
图2 所分离乳酸菌部分菌株生物膜形成情况
有文献[13]指出,生物膜的光密度值(即OD值)能够反映生物膜与接触表面黏附的牢固程度,依据临界OD490值(指空白孔的平均OD490值加上其3倍标准差而得到)可将生物膜进行分类,分别分为阴性(-)、弱阳性(+)、中等阳性(++)及强阳性(+++),在本研究中经试验得出临界OD490值为0. 14,所分离乳酸菌中生物膜形成情况见表2。从表2中可以看出,乳杆菌所形成的生物膜将近一半均为强阳性生物膜(OD490>0. 56),该结果也更进一步说明乳酸菌,尤其是乳杆菌具有较强的生物膜形成能力,这为更进一步开发利用乳酸菌生物膜的特性奠定基础。
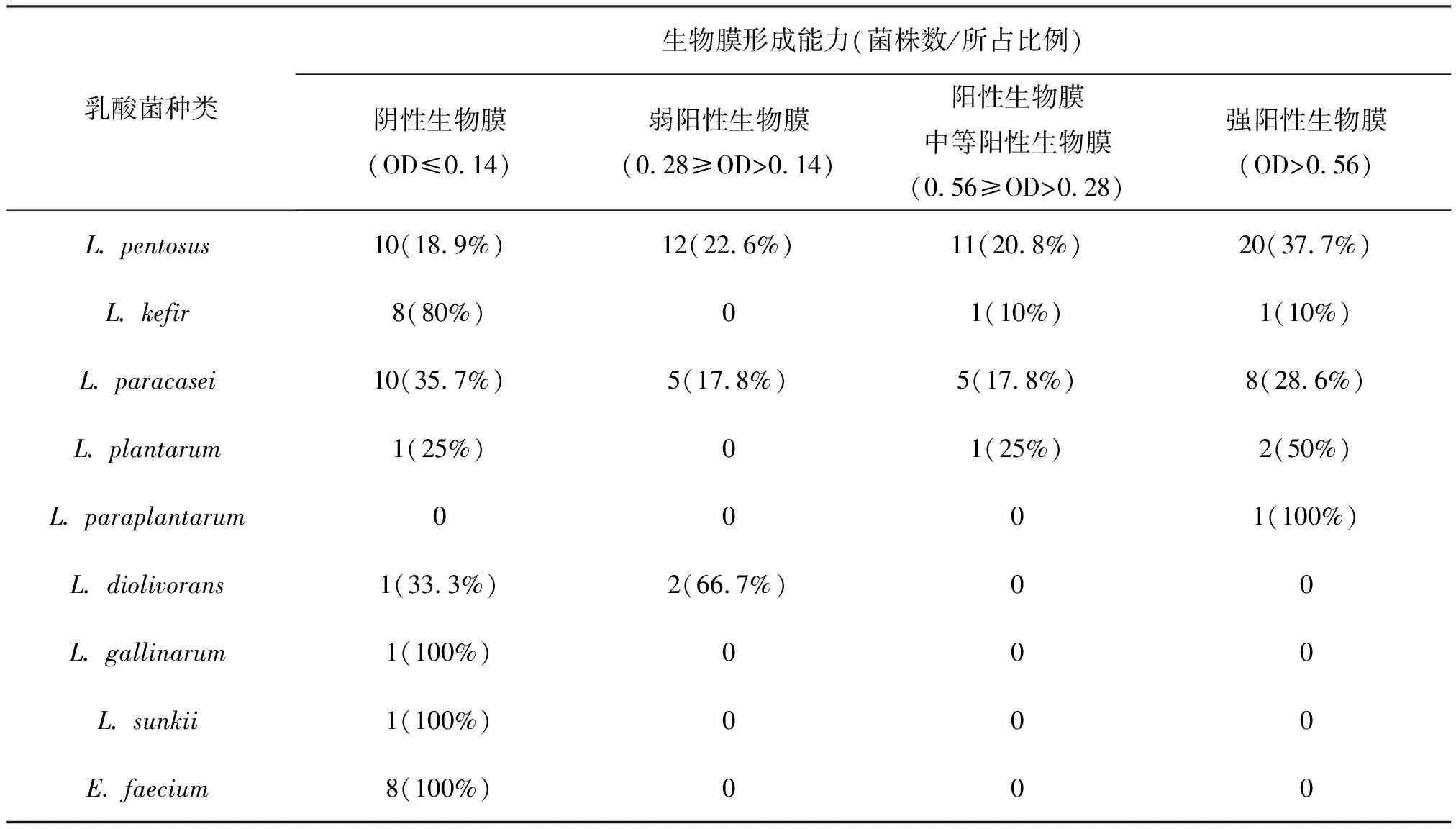
表2 不同乳酸菌生物膜形成情况及其分布
3 讨论
新疆是一个多民族聚居的地区,在这里少数民族一直都有食用自制发酵乳制品的习惯。这些民族特色发酵乳制品风味独特,营养价值极高,同时富含本地区自然环境中丰富的微生物资源,乳酸菌即是其重要的组成部分。乳酸菌具有维持肠道菌群微生态平衡,降低血清胆固醇、抗氧化、防癌抗癌等功效[14]。在本研究中,所得到的乳杆菌占分离乳酸菌总数的92. 72%,为绝对优势种群,分析其原因可能是与采集样品酸度高及分离培养基有关。由于酸度高,因此耐酸性差的乳球菌到发酵后期难以存活,所以很难从中分离出乳球菌。该结果也与孙天松[6]等得到的结果相一致。有学者[15][16]对内蒙古及青海等地区传统乳制品中乳酸菌进行分离得出,乳杆菌也均为其优势种群。这体现了乳杆菌作为发酵乳制品的优势菌种的重要地位。从表2中可以看出,不同乳杆菌生物膜的形成能力存在很大差异,同一种的乳酸菌其生物膜形成能力也极为不同。例如所分离得到的53株戊糖乳杆菌(L.pentosus),在四种类型的生物膜形成能力中均有分布,并且比例大致为1:1:1:2,分布较为平均。这可能是由于在同一种乳酸菌中还存在众多亚种,各个亚种之间存在差异,编码各自生物膜形成的基因不同,导致生物膜表型不一致。对于同一种内的亚种,还有待采用进一步的分析检测手段进行区分。
乳酸菌代谢产物如乳酸、细菌素及胞外多糖等广泛应用于食品药品领域。胞外多糖(exopolysaccharide,EPS)是由乳酸菌发酵产生的、分泌于细胞外的、常渗入培养基中的一种糖类化合物[17],它是近十年来乳品科学的研究热点。在乳酸菌中,有关乳杆菌胞外多糖的研究报道越来越多。大多数产EPS 乳杆菌菌株是从发酵乳及乳制品、发酵肉制品以及发酵蔬菜中分离获得的。胞外多糖的重要作用之一在于它是一种天然的增稠剂,可以改善发酵乳制品的流变学特性。同时EPS也是一种物理稳定剂,能够结合水并限制物料脱水收缩,赋予产品吸引人的外观和令人满意的口感[18]。另外,EPS还与乳酸菌生物膜的形成有直接关系,是生物膜形成的必需条件,从本研究中这一点也得到了证实。所分离菌株的生物膜阳性率高达63. 63%,并且全部为乳杆菌,这与乳杆菌具有较强的发酵产生EPS的能力密切相关。乳酸菌生物膜的形成可能也与奶源关系密切,少数民族牧民制作乳制品通常采用马奶、羊奶等作为原料,这些奶源中乳糖含量丰富,因此为乳酸菌发酵提供了充足的碳源,产生了大量的胞外多糖,进而能够形成生物膜结构。
4 结论
4.1 本研究从采集自新疆四个地区的传统民族乳制品酸奶子及酸奶疙瘩中分离获得乳酸菌共110株,经生理生化检测及分子生物学鉴定得出,L.pentosus53株,L.kefir10株,L.paracasei28株,L.plantarum4株,L.diolivorans3株,E.faecium8株,L.paraplantarum、L.gallinarum、L.sunkii各1株;还有1株经16S测序比对后与已知菌株基因序列相似性低于97%(93. 9%),为疑似新种,尚在进一步研究中;乳杆菌为本研究所分离菌株的绝对优势菌属,可能与所采集样品酸度较高及所使用的分离培养基有关;
4.2 对所分离获得的110株乳酸菌进行生物膜形成能力检测,结果显示生物膜阳性率高达63. 64%,这其中强阳性菌株(OD490>0. 56)32株,中等阳性菌株(0. 28 4.3 本研究中生物膜阳性菌株均为乳杆菌,肠球菌生物膜表型均为阴性,其中80%以上的L.pentosus生物膜表型为阳性。乳杆菌胞外多糖不仅在发酵乳的流变学特性、产品的结构和质地以及口感等方面起到重要作用,还具有抗癌、抗溃疡、免疫调节或降胆固醇等活性,逐渐成为近年来研究热点,而对乳杆菌生物膜特性的应用及研究尚处于初级阶段,亟待进一步的开发利用。 [1] 赵胜娟, 赵暄, 罗红霞,等. 新疆传统乳制品中乳酸菌的分离鉴定[J]. 中国乳品工业, 2007, 35(11): 8-11. [2] 彭斌, 王志琴, 张晓红,等. 新疆传统奶疙瘩中乳酸菌的分离及筛选[J]. 草食家畜,2010,6(2): 21-23. [3] 赵蕊, 霍贵成. 新疆酸奶子中乳酸菌多样性分析[J]. 山东大学学报(理学版), 2008, 43(7): 1-6. [4] Costerton J W, Stewart P S, Greenberg E P. Bacterial biofilm: a common cause of persistent infections[J]. Science, 1999, 284(5418): 1318-1322. [5] Barbara V, Miao C, Russell J C, et al. Bacterial extracellular polysaccharides involved in biofilm formation[J]. Molecules, 2009, 14: 2535-2554. [6] 孙天松, 王俊国, 张列兵,等. 中国新疆地区酸马奶中乳酸菌生物多样性研究[J]. 微生物学通报, 2007, 34(3): 451-454. [7] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999. [8] 杨洁彬. 乳酸菌——生物学基础及应用[M]. 北京: 中国轻工业出版社, 1999. [9] 任晓镤. 新疆南疆地区奶牛乳房炎性表皮葡萄球菌生物被膜形成及其影响因素的研究[D]. 新疆: 塔里木大学, 2012. [10] 任晓镤, 陈伟, 张利莉. 新疆南疆地区奶牛乳房炎性表皮葡萄球菌生物被膜形成及其相关基因的检测[J]. 塔里木大学学报, 2011, 23(3): 14-18. [11] Christensen G D, Simpson W A, Younger J J, et al. Adherence of coagulase-negativestaphylococcito plastic tissue culture plates: a quantitative model for the adherence ofstaphylococcito medical devices[J]. J Clin Microbiol, 1985, 22(6): 996-1006. [12] Man D E, Rogosa J D, Sharpe M E. A Medium for the Cultivation of Lactobacilli [J]. J Appl Bact, 1960, 23:130-135. [13] 段韵涵, 韩北忠, 杨葆华,等. 培养条件对金黄色葡萄球菌生物被膜生长的影响[J]. 中国酿造, 2008, 3: 17-20. [14] 董晓婉, 李宝坤, 李开雄,等. 新疆蒙古族和哈萨克族传统乳制品中乳酸菌多样性的比较[J]. 食品工业科技, 2013,34(21): 162-166. [15] 周雨霞, 孟和毕力格, 雷霞,等. 内蒙古不同地区、不同畜种乳及乳制品中乳杆菌属细菌的分布[J]. 2004,32(11): 3-5. [16] 张文羿, 徐杰, 云月英,等. 青海省海西地区传统发酵山羊乳中乳酸菌的分离及鉴定[J]. 2006,34(11): 4-8. [17] 顾瑞霞. 乳酸菌胞外多糖生物合成及生理功能特性的研究[D]. 哈尔滨:东北农业大学, 2000. [18] 张天琪, 杨贞耐, 孔保华. 乳杆菌胞外多糖及其在酸乳中的应用[J]. 食品科学, 2008,29(9): 637-642.
