紫杉醇注射液对一次性使用精密输液器中邻苯二甲酸二(2-乙基)己酯的溶出作用
2014-03-21张虹杨凤敏吴静沈刚杨月阳刘炳荣张淼唐亚林
张虹 杨凤敏 吴静 沈刚 杨月阳 刘炳荣 张淼 唐亚林
1 中国科学院化学研究所 (北京 100190)
2 北京康健源科技有限公司 (北京 100055)
3 北京国医械华光认证有限公司 (北京 100011)
4 江西三鑫医疗科技股份有限公司 (南昌 330200)
0.前言
邻苯二甲酸二(2-乙基)己酯(DEHP)是聚氯乙烯(PVC)一次性使用医疗器械中比较常见的增塑剂之一。DEHP 可以提高塑料的柔软性和耐寒性,降低软化温度,改善加工性能。DEHP 的急性毒性很小,但其亚急性毒性动物试验显示能导致体重减轻、白细胞计数增高、血红蛋白值下降、血尿等,特别是对肝肾功能与生殖功能具有不良影响。另外,DEHP 可导致胎儿死亡率及胎儿畸形率明显增加。因此,需要对PVC 医疗器械中DEHP 的溶出量进行检测,用以确保PVC 医疗器械产品在临床应用中的安全性。近期研究表明,脂溶性药液可以导致PVC 产品中DEHP 的溶出。
紫杉醇(PacLitaxeL,商品名TaxoL,TAX)是当前公认的广谱、强活性的抗癌药物之一,它既是卵巢癌和乳腺癌的一线药物,也是肿瘤晚期行之有效的化疗药物。在临床上由于紫杉醇不溶于水,其制剂常为聚氧乙烯蓖麻油(Cremphor EL)-无水乙醇(50:50,v/v)等体积混合溶液。在紫杉醇的说明书中,明确“滴注紫杉醇时应采用非聚氯乙烯材料的输液瓶和输液器”,主要是由于聚氧乙烯蓖麻油为表面活性剂,能够溶解聚氯乙烯(PVC)输液器中所含的增塑剂[1-3],临床使用过程中存在一定的风险。同时也有文献报道,使用PVC 材质的输注器具输注紫杉醇会造成一定的药液吸附,导致药效下降。鉴于此,本实验选用临床常用的紫杉醇注射液,作为模拟临床使用最为恶劣的极限条件,研究该药液对PVC 产品中DEHP 的溶出情况,旨在用于评价PVC 产品的安全性提供基础数据和检测方法。
1.材料与方法
1.1 试剂与仪器
乙醇(色谱纯,百灵威),纯水(MiLLiQ 超纯水),DEHP 标准物质(Fluka,批号:SZB8301XV,编号:36735-1G),紫杉醇注射液(5mL:30mg,四川升和药业股份有限公司),分析天平(METTLER TOLEDO AB135-S),高效液相色谱(Shimadzu 20A),一次性使用精密输液器(江西三鑫医疗科技股份有限公司批号:100902)。
1.2 浸提液的制备
参照紫杉醇注射液的药品使用说明,按照药物在临床使用过程中的最高浓度进行配置。对于紫杉醇注射液,其临床使用方法为每次120~210 mg,稀释至0.3~1.2mg/mL,静脉滴注3h。由此,实验中将紫杉醇注射液用生理盐水配置成1.2 mg/mL 的药液对一次性使用精密输液器产品中的DEHP 进行溶出实验。
1.3 色谱条件
检测器:紫外/可见光检测器,检测波长n = 272 nm;色谱柱:Sunfire C18, 5μm, 4.6 mm×250 mm;柱温:室温;流动相:甲醇-水(90-10);流速:1.0 mL/min;进样量:20 μL。
1.4 方法学研究
1.4.1DEHP 特征吸收波长的测定
精密称取DEHP 标准品0.2 mg,用乙醇稀释至4 mL,配制成约含50 μg /mL 的溶液,用紫外-可见分光光度计在200~400 nm 波长范围内进行波谱扫描,根据吸收光谱曲线确定DEHP 的HPLC 检测波长(n)。
1.4.2 DEHP 保留时间的确定:
考虑到所用生理盐水中也可能含有一定量的 DEHP,因此对这部分进行检测,在测定样品时扣除这部分的干扰,将空白的溶剂作为空白溶液。
称取DEHP 适量,用乙醇稀释配置得到100 μg /mL 的溶液作为对照品溶液。在1.3 色谱条件下分别将空白溶液、对照品溶液与测试溶液注入高效液相色谱,记录色谱图,得到DEHP 的出峰保留时间。
1.4.3DEHP 标准曲线的绘制
准确称取 DEHP 对照品适量,置于量瓶中,以乙醇为溶剂,配制浓度约为2 mg/mL 的DEHP 乙醇溶液,取此溶液5mL 置于50mL 量瓶中,用乙醇溶液稀释至刻度作为储备液。分别精确量取此溶液适量,置于量瓶中,用乙醇稀释分别配制成浓度为200 μg/mL~0.11 μg/mL 的溶液作为供试品溶液。按照1.3 中色谱条件进样测定,得到各个浓度的峰面积值。以样品浓度(C)为横坐标,以相应的峰面积(A)为纵坐标,进行线性回归。
1.4.4 溶液稳定性的测定
量取 DEHP 对照品适量(约10 mg),置10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1 mL 置10 mL 量瓶中用浸提液稀释定容,分别在0 h、4 h、8h、12 h、24 h 小时,按照1.3 色谱条件对此溶液进行测定,考察峰面积的变化。
1.4.5 进样精密度
取溶液稳定性样品,按照1.3 的色谱条件连续测定5 次,得到其峰面积,计算变异系数(RSD),考察实验结果的重复性。
1.4.6 回收率
精密量取 DEHP 对照品适量(约相当于DEHP 8 mg、10 mg 和12 mg),各3 份,分别置10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1mL 置10 mL 量瓶中用浸提3h 的供试品溶液稀释定容,作为80%、100%、120%的供试溶液;另取DEHP 对照品适量(约10 mg),置10 mL 量瓶中,用乙醇溶液溶解并稀释至刻度。取此溶液1 mL 置10 mL 量瓶中用乙醇溶液稀释定容,作为对照溶液;以乙醇溶液作为空白溶液,以9 mL 浸提3h 的供试品溶液和1 mL 的乙醇混合溶液作为样品溶液。分别取上述四种溶液,按照1.3 的色谱条件进行测定,计算3 种不同浓度溶液的回收率(%)。
1.5 供试液的制备和测定
紫杉醇注射液的临床使用方法为每次 120~210 mg,稀释至0.3~1.2 mg/mL,静脉滴注3 h。按照该药品临床使用的最高浓度,我们将紫杉醇注射液用生理盐水配置成1.2 mg/mL 的药液对产品中的DEHP 进行溶出实验。同时,为了能真实的反应出紫杉醇注射液在临床使用过程中对一次性使用输液器产品的DEHP 溶出量,我们采用临床使用的加药方式,将1.2 mg/mL 的紫杉醇药液保持在37±1˚C 的条件下,自然滴注3h。在输液器的末端用一密闭平底玻璃瓶收集浸提液,冷却至室温后用乙醇稀释定容至500 mL 作为供试品。
2.结果与讨论
2.1DEHP 特征吸收波长的确定
DEHP 的紫外吸收光谱图,如图1 所示。从图中可以看出DEHP 在274 nm 处有最大吸收,选定274 nm 为检测波长。
2.2 DEHP 的出峰保留时间
将 250mL 的生理盐水在37±1˚C 温度下,通过自然滴注的方式通过一次性使用精密输液器,滴注3h 后,收集流出液作为空白溶液。
将紫杉醇注射液用生理盐水配置成1.2 mg/mL 的药液,同样保持在37±1˚C 条件下,自然滴注3h。在输液器的末端分别用一密闭平底玻璃瓶收集浸提液并冷却至室温,用乙醇稀释定容至500 mL 作为测试品溶液。在1.3 色谱条件下分别将空白溶液、对照品溶液与测试溶液注入高效液相色谱,记录色谱图,得到DEHP 的出峰保留时间,如图2 所示。
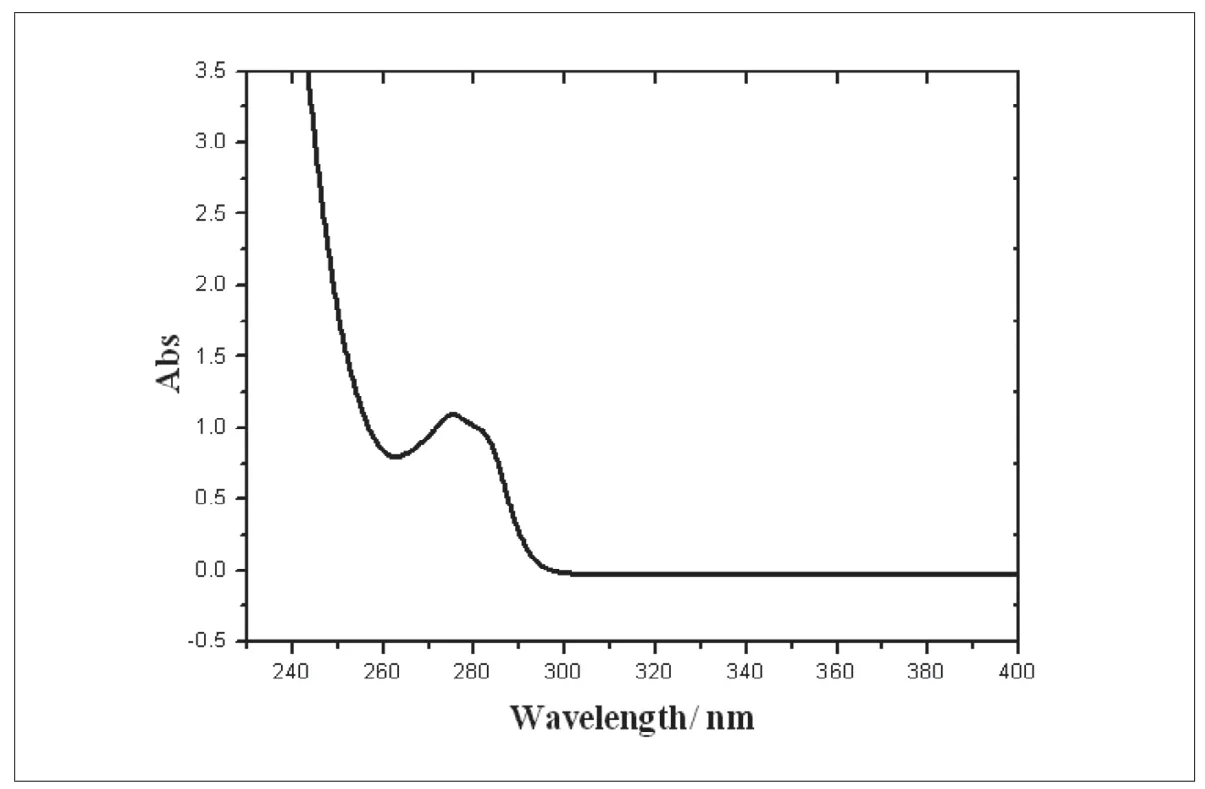
图1. DEHP 的紫外吸收光谱
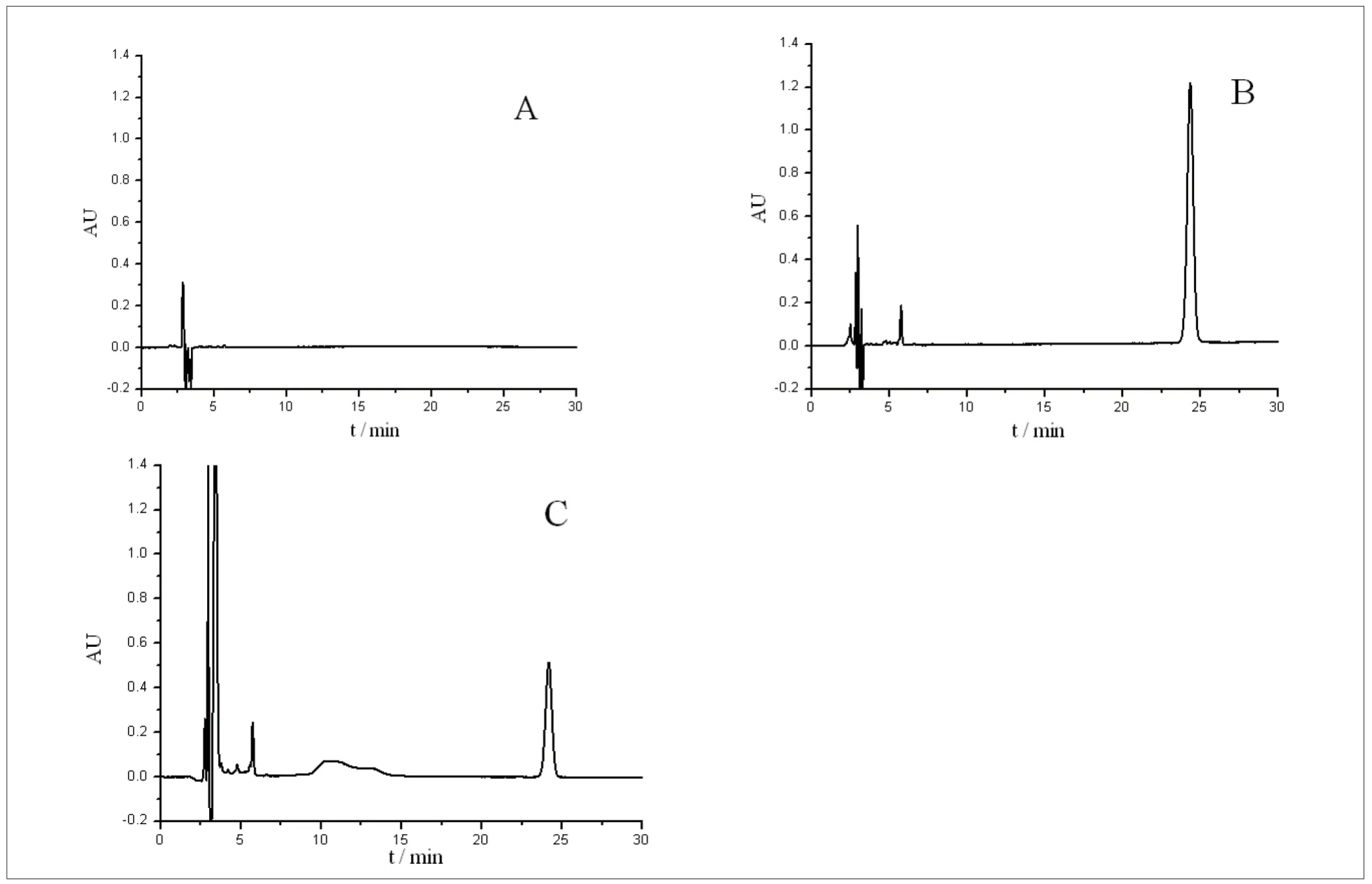
图2. DEHP 的HPLC 保留时间(A:空白溶液;B:DEHP 对照品;C:样品)
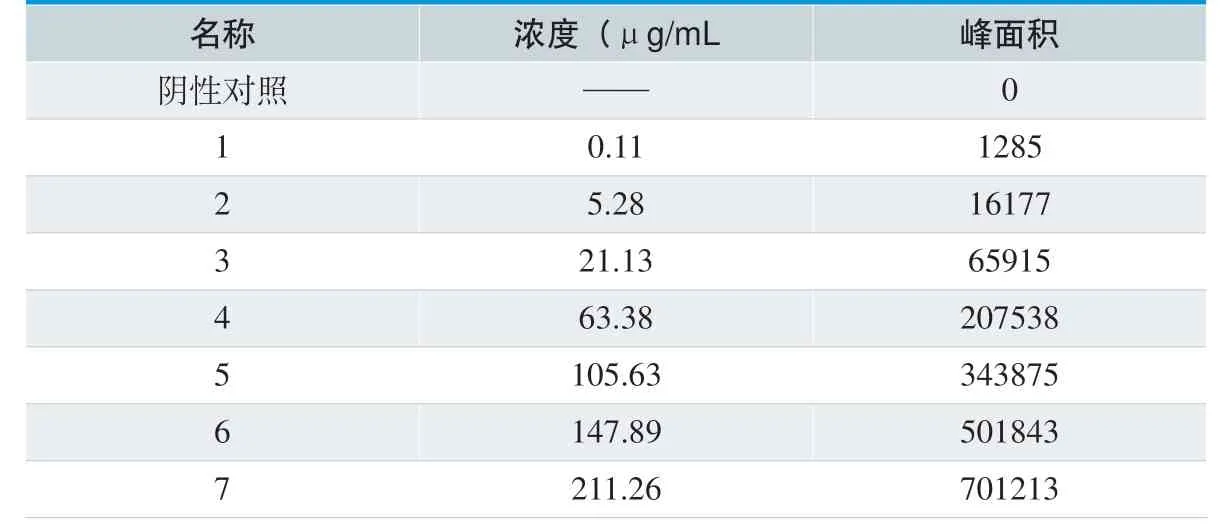
表1. DEHP 溶液浓度及对应的峰面积

图 3. DEHP 的标准曲线
实验结果表明,空白溶液以及紫杉醇药液对DEHP 的检测无干扰。DEHP 对照样品溶液的主峰保留时间为24.333 min,浸提3h 的测试溶液的主峰保留时间为 24.164 min,两峰的保留时间基本一致,说明测试溶液的主峰为DEHP 的色谱峰,DEHP 的峰与邻近的杂质峰分离度良好。
2.3 标准曲线的测定
准确称取 DEHP 对照品适量,置于量瓶中,以乙醇为溶剂,配制浓度约为2 mg/mL 的DEHP 乙醇溶液,取此溶液5mL 置于50mL 量瓶中,用乙醇溶液稀释至刻度作为储备液。分别精确量取此溶液适量,置于量瓶中,用乙醇稀释分别配制成浓度为200 μg/mL、140 μg/mL、100 μg/mL、60 μg/mL、20 μg/mL、5 μg/mL 和0.11 μg/mL 的溶液作为供试品溶液。按照1.3 的色谱条件,量取空白溶液和7 个浓度的供试品溶液各20μL 注入液相色谱仪,以样品浓度(C)为横坐标,以相应的峰面积(A)为纵坐标,进行线性回归。 实验结果表明,DEHP 在0.11-211.26μg/mL 浓度范围内,线性方程的R 值为0.9998,其浓度与峰面积呈良好的线性关系。
2.4 溶液稳定性
取 DEHP 对照品适量(约10 mg),置10 mL 量瓶中,用乙醇溶解并稀释至刻度。取此溶液1 mL 置10 mL 量瓶中用浸提液稀释定容,分别在0h、4h、8h、12h、24h 用1.3 所述色谱方法对溶液进行测定,考察峰面积的变化,实验结果见表2。实验结果表明,溶液在室温条件下放置24 小时,溶液稳定性试验中溶液峰面积的RSD 值为0.43%,小于2%,说明溶液稳定性良好。
2.5 精密度
取溶液稳定性下样品,按照1.3 的色谱方法进行检测,连续进样5 次,计算RSD 值,结果见表3。实验结果表明,按此方法重复测定样品的峰面积, RSD 值为0.56%,小于2%,说明测定方法重复性良好。
2.6 回收率结果
回收率结果见表 5 和表6。9 份样品溶出度的回收率平均值分别为100.23%、97.44%、100.77%,均在90.0%~110.0%之间,RSD 值为1.72%,回收率良好,表明本实验采用的测量方法准确度高,精确度好。
2.7 一次性使用精密输液器产品DEHP 溶出量的检测
利用 1.3 色谱方法,以紫杉醇注射液为浸提液对一次性使用精密过滤输液器产品中的DEHP 溶出量进行测定,结果见表7 和表8 所示。1#样品和2#样品的DEHP 溶出量分别为17.63 mg/套(1#样品)和20.14 mg/套(2#样品),平均值为18.89 mg/套。
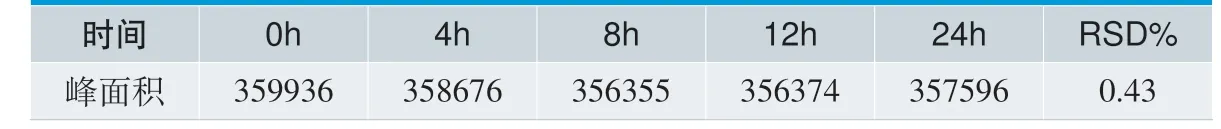
表2. 溶液稳定性实验结果
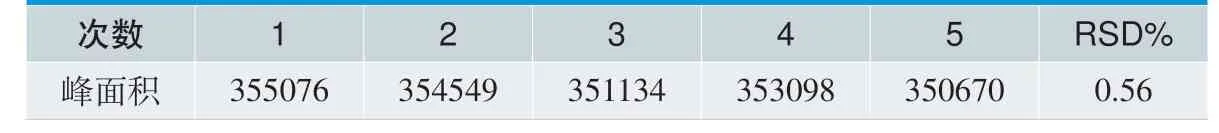
表4. 进样精密度实验结果
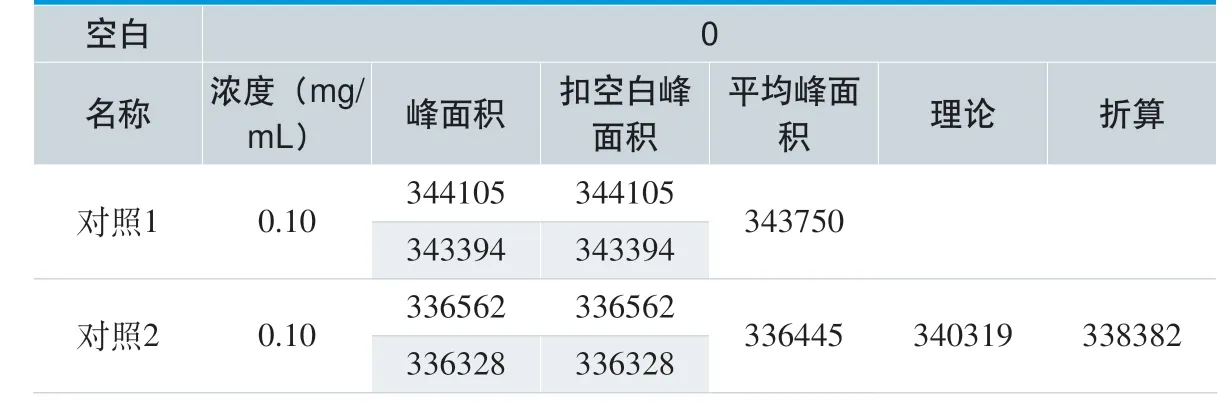
表5. 紫杉醇注射液的回收率对照实验结果

表6. 紫杉醇注射液的回收率实验结果
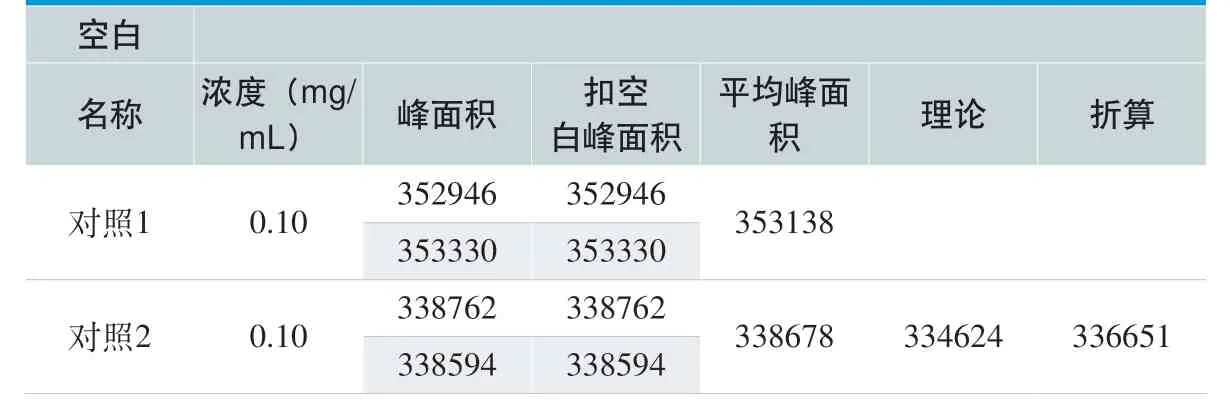
表7. 紫杉醇注射液对一次性使用精密过滤输液器中DEHP 对照品实验结果

表 8. 紫杉醇注射液对一次性使用精密过滤输液器中DEHP 的溶出实验结果
3.结论
聚氯乙烯(PVC)输液器具有耐撞击、不易破损、贮存运输方便等优点。但由于PVC 材料较硬,要制成输液器必须加入增塑剂,例如邻苯二甲酸二(2-乙基)己酯(DEHP)。近些年的研究报道,PVC 对人体健康存在潜在的危害性[4-6]。
为了尽可能模拟出该产品在临床使用过程中DEHP 的最大溶出量,我们选用了目前广泛应用于临床的紫杉醇注射液作为浸提液,对产品中DEHP 的溶出量进行检测,并对检测方法进行方法学验证。在实验过程中,为了模拟临床最恶劣使用条件,我们选用了紫杉醇注射液临床使用的最高浓度(1.2 mg/mL),并在37˚C 条件下,采用自然滴注的方式进行浸提。
实验结果表明,在以甲醇-水(90:10)为流动相,流速1.0 mL/min,检测波长为274nm 的色谱条件下,DEHP 的保留时间为24.333 min,可以与邻近的杂质峰分离度良好(分离度大于1.5)。该方法可以较为快捷的直接检测紫杉醇注射液中的DEHP 含量。同时通过精密度、线性、回收率等实验也证实,该实验方法准确度高、精密度好,可确保实验数据的准确可靠。本次实验测定的一次性使用精密过滤输液器产品,在1.2mg/mL 的紫杉醇注射液中DEHP 溶出量为18.89mg/套。张恩娟等[3]收集重庆市9 所三甲医院紫杉醇包装中配套的输液器,模拟临床输液过程,测定收集液中的DEHP。结果也表明,紫杉醇(浓度为0.48 mg/mL)对输液器中的DEHP 具有较大溶出度。由上述可以看出,在临床使用过程中,紫杉醇药液对于PVC 输液器中DEHP 具有较大溶出,因此在紫杉醇注射液在临床使用过程中,应尽可能使用非PVC 输液器,以此确保患者安全。
[1] 张俊虎,林京.紫杉醇注射液加入软包装输液中引起絮凝1 例.中国医院药学杂志,2002,22(3):180.
[2] Kim J H,Yun J,Sohng J K,et a1.Di(2-ethylhexyl)phthalate leached from medical PVC devices serves as asubstrate and inhibitor for the P glycoprotein[J].Environ Toxicol Pharmacol,2007,23(3):272-278.
[3] 张恩娟,陈琳,曹健.紫杉醇注射液配套输液器中邻苯二甲酸二辛酯的溶出性考察.中国药房,2008,19(9):698-700.
[4] US Food and Drug Administration: safety assessment of di(2-ethyLhexyL) phthaLate (DEHP ) released from PVC medical devices. 2002.
[5] 奚延斐,王春仁,邻苯二甲酸辛酯增塑聚氯乙烯医疗器械的安全性评价,中国医疗器械信息,2005,11(2):27-30.
[6] 张双灵,郭康权,孟娟,几种水溶性溶剂对PVC 膜中增塑剂DEHP 的溶出作用,农业工程学报,2008,24(5):261-263.
