一株石榴炭疽病病原真菌的鉴定
2014-03-20李秀丰谢美华李雪玲杨海艳
李秀丰,谢美华,李雪玲,杨海艳
(1.楚雄师范学院化学与生命科学学院,云南 楚雄 675000;2.云南农业大学农业生物多样性与病虫害控制教育部重点实验室,云南 昆明 650201;3.云南省高校应用生物学重点实验室,云南 楚雄 675000)
石榴科 (Punicaceae)亦称安石榴科,全世界共有1属2种,产于地中海至亚洲西部地区。我国引入栽培1种,即石榴Punica granatum。石榴在南北各省都有分布,根据花的颜色以及重瓣或单瓣等特征又分为若干栽培变种[1]。石榴的根、叶、花、果皮、种子均可入药[2,3]。近年大量研究表明,石榴具有抗氧化、预防心血管疾病、抗菌、抗感染等诸多功效,这与石榴中含有较高的抗氧化活性物质有关[4,5]。
然而,石榴干腐病、褐斑病、桃蛀螟、炭疽病、蚜虫、介壳虫、吸果夜蛾等病虫害常造成石榴树大量落叶,影响树势和产量[6]。石榴炭疽病会导致光合作用和吸收代谢受到制约和影响,影响石榴的品质,甚至引起植株死亡,造成经济损失。
炭疽病的病原菌主要是刺盘孢菌,刺盘孢寄主范围非常广泛,可在多种植物体上繁衍生长,该病具有潜伏性,难以早期诊断、早期防治,因此一旦暴发流行,很难控制和治愈[7,8]。由于刺盘孢菌有的种寄主广泛,形态多变,分类系统复杂,根据寄主专化性、形态学等特征进行种级鉴定对初学者而言比较困难。近年来,分子技术在刺盘孢属内种间的鉴定和分类上取得了巨大进展,如测定炭疽菌ITS rDNA序列差异、RAPD法、PCR-RFLP法、AFLP法、基因组DNA的AT富集区分析法等[9]。随着分子生物学的发展,刺盘孢菌分类研究中,形态学结合多基因联合分析已成一种趋势[10—14]。
虽然石榴炭疽病在我国时常报道,但其病原究竟是什么未见记载,故本研究采取形态学结合多基因联合分析,对石榴炭疽病的病原进行鉴定,为石榴炭疽病的防治提供理论基础。
1 材料与方法
1.1 材料
取患有炭疽病的石榴果,用组织培养法分离病原菌[15],采用科赫氏法则确定其病原,菌株编号yn058。
1.2 方法
1.2.1 形态观察及鉴定
对患有炭疽病的石榴果进行形态观察,并记录其形态特征。分离得到的纯培养物,单孢一代或二代于PDA培养基25℃培养7d,观察菌落形态及生长率、颜色和产孢情况等性状,同时观察分生孢子及附着孢的形态特征并记录。
1.2.2 分子生物学鉴定
用CTAB法提取真菌基因组DNA,选择的目的基因分别为核糖体转录间隔区序列 (internal transcribed spacers,ITS)、β-微管蛋白基因 (β-tubulin gene,TUB2)、3-磷酸甘油脱氢酶基因(glyceraldehydes-3-phoaphate dehydrogenase gene,GPDH)和几丁质合成酶A基因 (chitin synthase A gene,CHS1)进行扩增与测序,相应的PCR扩增引物见表1。
ITS反应体系为 50 μL,包含缓冲液 (10×buffer)4μL;MgCl2(25 mM)4 μL;dNTPs(10 mM)0.8μL;Primer 1(10 pM)2μL;Primer 2(10 pM)2μL;Taq 酶 (5U/μL)0.4μL;模板DNA(20 ng)2μL;ddH2O 34.8 μL。再覆盖上20μL矿物油,以防蒸干。
TUB2、ACT、CAL反应体系为50 μL,共包含缓冲液 (2×buffer)25 μL;dNTPs(2 mM)10μL;Primer 1(10 pM)1 μL;Primer 2(10 pM)1μL;KOD FX Neo酶 (1U/μL)1μL;模板 DNA(20 ng)2μL;ddH2O 10 μL。再覆盖上20 μL矿物油,以防蒸干。
PCR扩增反应程序:ITS、GPDH、CHS1的PCR反应程序PCR扩增条件:95℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸5 min,4℃保存。TUB2的PCR扩增条件:94℃预变性2min,98℃变性10 s,55℃退火30 s,68℃延伸1min,共35个循环;68℃延伸10min,4℃保存。扩增产物用1%琼脂糖凝胶电泳检测,用凝胶成像仪进行观察并拍照。
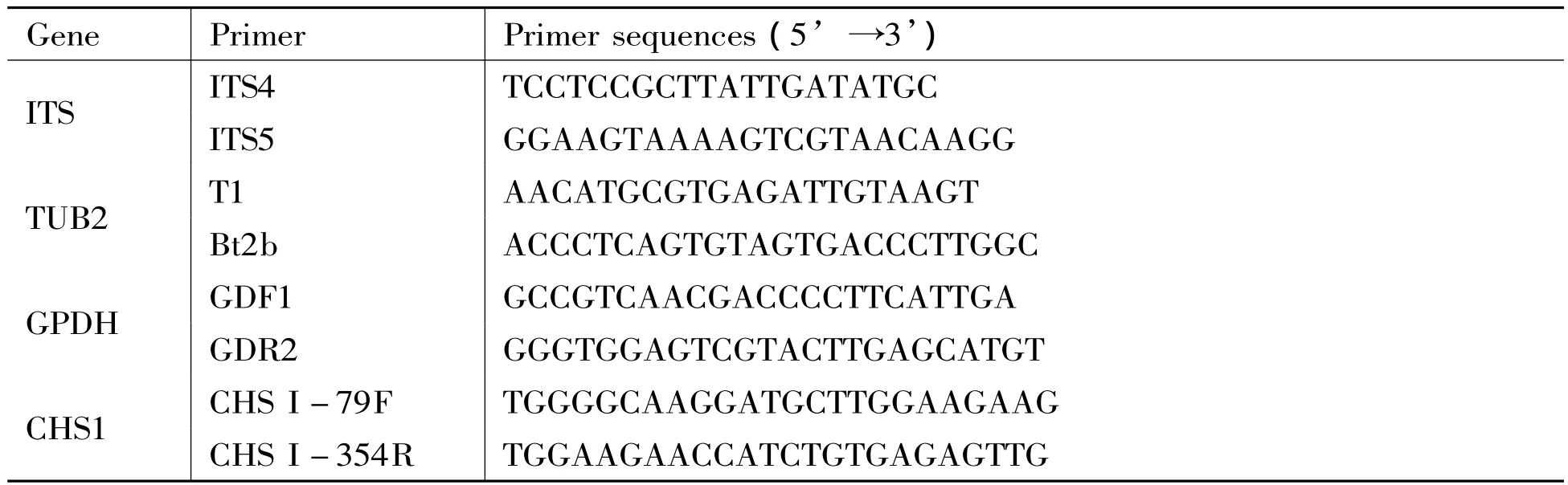
表1 目标基因及相应的引物Tab.1 Primers used for PCR amplification and DNA sequences
2 结果与分析
2.1 形态结果
病斑生于石榴的果皮上,不规则分布,开裂,近圆形,褐色,灰白色。PDA培养基25℃培养7d后菌落直径达26.4mm,生长速率为3.1mm/d。菌丝灰白色,背面黄褐色,培养基不变色,菌落中等高度,絮状,全缘,培养过程中产生菌核。分生孢子直,单孢,无色,圆柱形,顶端钝圆,大小为12.3~16.3×6.1~7.3μm,平均值为14.6×6.6μm,长宽比在1.9~2.6之间,平均为2.2。附着孢圆形至近椭圆形,简单,淡褐色,全缘,大小为5.3~8.7×4.9~5.7μm,平均值为7.1×5.3μm。
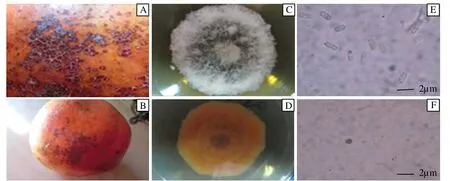
图1 石榴炭疽病病斑和病原菌形态观察(注:A&B:石榴炭疽病斑;C&D:PDA上菌落形态;E&F:分生孢子和附着孢)Fig.1 Speckle of anthracnose and pathogen morphological observation(Note:A&B:spots;C&D:PDA colony morphology;E&F:conidia and appressoria)
2.2 PCR产物检测
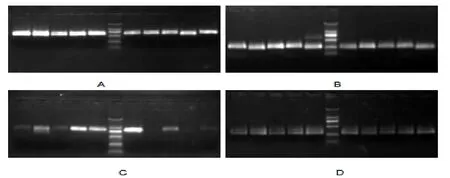
图2 相关基因扩增产物的检测(注A:ITS基因;B:GPDH基因;C:TUB基因;D:CHS1基因)Fig.2 Detection for amplification products(note A:ITS genes;B:GPDH genes;C:TUB gene;D:CHS1 gene)
从图2可以看出,图A中部分菌株ITS序列扩增产物检测结果显示,目标片段在500—750bp之间;图B中部分菌株GPDH基因扩增产物检测结果显示,目的片段在250—300bp之间;图C中部分菌株TUB基因扩增产物检测结果显示,目的片段在700—800bp之间;图D中部分菌株CHS1基因扩增产物检测结果显示,目的片段在300bp左右。选择无杂带、清晰的扩增产物送北京百泰克生物有限公司测序。
2.3 测序结果
将测序结果在NCBI上进行Blast搜索比对,结果如表2所示。供试菌株的CHS序列与C.citricola的同源性为99%,与C.phyllanthi的同源性为98%,供试菌株的GPDH序列与C.karstii,C.boninense,C.gloesporioides的同源性为99%,供试菌株的ITS系列与C.boninens,C.gloeosporioides和C.trucatum的同源性为99%,供试菌株的T1系列与C.karstii,C.boninense,C.phyllanthi,C.annellatum,C.oncidii的同源性为99%,C.petchii,C.citricolad的同源性为98%,与C.cymbidiicola的同源性为96%,与C.torulosum,C.colombiense,C.novae-zelandiae,C.brassicicol的同源性为95%,与C.parsonsiae的同源性为94%,与C.hippeastri的同源性为93%。

表2 参与多相分析的各种名及相关系列Table 2 Names and related sequence involved in multi-gene combine analysis
2.4 分子系统树分析
选取以上同源性较高的序列,将各基因序列以关尾相接的方式进行连接[16],用MEGAV 4.1中的最大简约法 (Maximum parsimony)构建各基因系统发育树,并用bootstrap对系统发育树进行检验,500次重复。结果如图3所示,供试菌株与C.karstii聚为一支,节点支持率为100%,说明二者亲缘关系近。
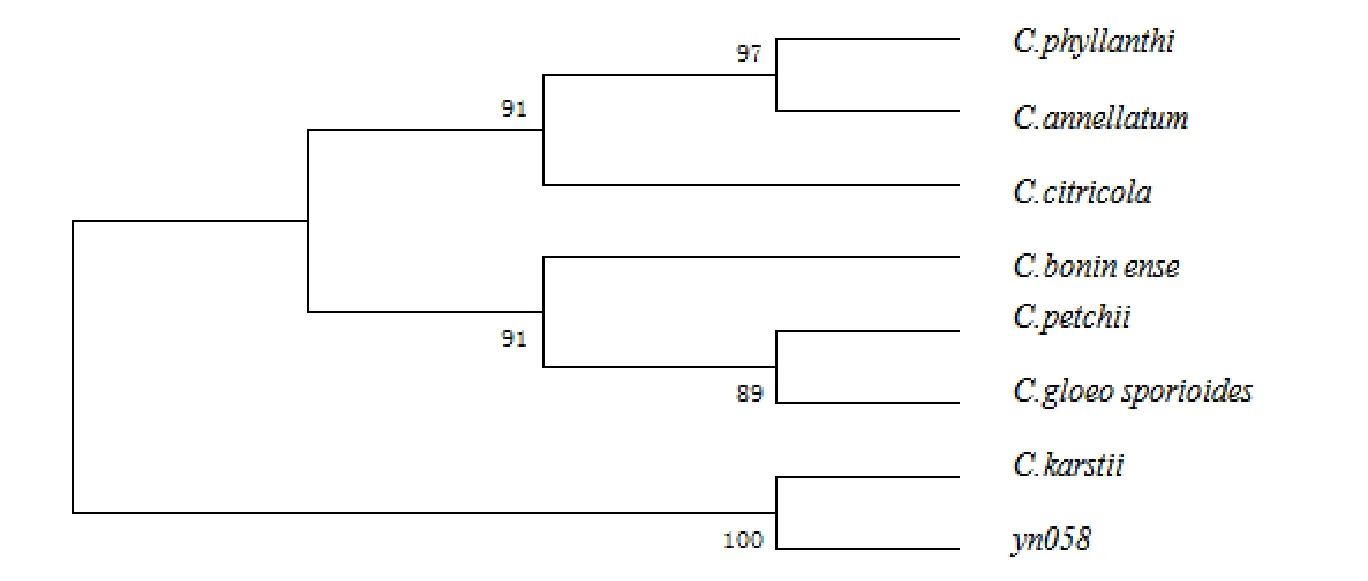
图3 基于ITS、TUB2、GPDH、CHS系列构建的MP树Fig.3 Maxinum parsimony phylograms inferred from combined CHS、GPDH、ITS and TUB2 sequences date
3 讨论与结论
本研究以形态学结合多基因系统学的方法对石榴炭疽病的病原菌进行鉴定。
由于C.karstii的CHS系列缺乏,所以yn058与其同源性无法进行比较。yn058的ITS系列与C.boninense,C.gloesporioides同源性最高,但是在GenBank所登录的序列中,约有四分之三的刺盘孢属真菌的ITS序列被错误定义[18],Cai将在GenBank中定义为C.gloeosporioides的343条ITS序列与该种和其他种的Epitype的ITS构建系统树,发现仅该种的错误率就高达86%以上[19],杨友联在分析壳皮刺盘孢菌时发现,登录在GenBank中的该种的ITS序列中有部分极有可能被错位定义,20株定义为该种的菌株分为了起源上明显较远的4个分枝[17]。说明依据ITS系列对刺盘孢定种必须慎重对待,形态学结合多基因系统学分析结果将更可靠。多基因系统树显示,其与喀斯特刺盘孢亲缘关系最近。杨友联 (2011)报道Colletotrichum karstii:分生孢子圆柱形,单孢,无色,直,12~19.5×6~7.5 μm。附着孢褐色,球形或棍棒形,边缘完整,6.5~14.5×4~8.5μm[17],供试菌株形态特征与其基本相符。
形态学结合分子生物学分析,我们认为供试菌株为该菌Colletotrichum karstii,为该菌在石榴科植物上首次报道。
[1]中国科学院中国植物志编辑委员会.中国植物志.52卷第2分册 [M].北京:科学出版社,1983.
[2]《全国中草药汇编》编写组.全国中草药汇编.下册 [M].北京:人民卫生出版社,1978.
[3]江苏省植物研究所.新华本草纲要.第3册 [M].上海:上海科学技术出版社,1990.
[4]苑兆和,招雪晴,尹燕雷,等.石榴植物化学研究进展 [J].落叶果树,2013,45(5):1—6.
[5]姚立华,何国庆,陈启和.石榴生物活性成分研究进展 [J].食品科技,2006,11:248—251.
[6]刘晓宇,赵莉.石榴减产的原因分析及综合防治对策 [J].生命科学与农业科学,2013,(4):28—29.
[7]王启玉.王德森.园林、园艺植物的炭疽病 [J].农村实用科技信息,2010,(7):74.
[8]郑怀舟.谈植物炭疽病 [J].植物杂志,2002,(3):42—43.
[9]杨海艳.中国刺盘孢及近似属鉴定研究 [D].云南农业大学,2013.
[10]Prihastuti H,Cai L,Chen H,et al.Characterization of Colletotrichum species associated with coffee berries in northern Thailand [J].Fungal Diversity,2009,39:89—109.
[11]Damm U,Woudenberg J H C,Cannon P F,et al.Colletotrichum species with curved conidia from herbaceous hosts[J].Fungal Diversity,2009,39:45—87.
[12]Damm U,Cannon P F,Woudenberg J H C,et al.The Colletotrichum acutatum species complex [J].Studies in Mycology,2012,73:37—113.
[13]Damm U,Cannon P F,Woudenberg J H C,et al.The Colletotrichum boninense species complex [J].Studies in Mycology,2012,73:1—36.
[14]Weir B S,Johnston P R,Damm U.The Colletotrichum gloeosporioides species complex[J].Studies in Mycology,2012,73:115—180.
[15]方中达.植病研究方法.第三版 [M].北京:中国农业出版社,l998.
[16]杨友联.中国贵州、云南、广西炭疽菌属真菌多基因分子系统学研究[D].华中农业大学,2010.
[17]杨友联,刘永翔,刘作易.炭疽菌属真菌分类学研究进展 [J].贵州农业科学,2011,39(1):152—157.
[18]Crouch J A,Clarke B B,Hillman B I.What is the value of ITS sequence data in Colletotrichum systematics and species diagnosis?A case study using the falcate-spored graminicolous Colletotrichum group [J].Mycologia,2009b,101(5):648—656.
[19]Cai L,Hyde K D,Taylor P W J,et al.A polyphasic approach for studying Colletotrichum[J].Fungi diversity,2009,39:183.
