宫颈癌组织P16、P15蛋白检测的临床价值研究
2014-03-18蔡丽梅朱珍珍虞如芬
蔡丽梅,朱珍珍,虞如芬
宫颈癌组织P16、P15蛋白检测的临床价值研究
蔡丽梅,朱珍珍,虞如芬
目的研究P16、P15在宫颈癌组织中的表达与组织学分级和临床分期的关系。方法选择宫颈癌标本82份为宫颈癌组,并选择50份正常宫颈组织为正常组,用免疫组化法检测两组组织P15和P16的表达,分析宫颈癌组P15和P16表达与病理组织学分级、临床分期、有无淋巴结转移和癌栓的关系。结果P15、P16在正常组和宫颈癌组中的阳性表达率分别为98.00%和50.00%、96.00%和51.22%,差异均有统计学意义(均P<0.05);肿瘤组织P15和P16蛋白的阳性表达率与组织学分级、临床分期、有无淋巴结转移、有无癌栓有关,其中组织学分级Ⅲ级<Ⅱ级<Ⅰ级(P<0.05),有淋巴结转移者<无淋巴结转移(P<0.05),有癌栓者<无癌栓者(P<0.05)。结论P16、P15在宫颈癌组织中表达的阳性率明显低于正常组织,缺失越严重其组织学分级和临床分期越高、有淋巴结转移和癌栓的可能性增大;因此宫颈癌组织进行P15、P16蛋白检测对宫颈癌预后的判断可能具有一定的临床价值。
宫颈肿瘤;癌;蛋白
宫颈癌的发生发展是一个涉及多因素、多基因的复杂过程[1]。P16和P15缺失或突变导致P16和P15蛋白的表达降低,P16和P15抑癌功能丧失,造成细胞异常增殖[2]。目前,通过分子标志物检测对肿瘤进行诊断是国际上热门的课题,但关于P15、P16蛋白在宫颈癌组织中表达与病理分级、临床分期间关系的临床研究报道较少,2003年12月至2013年12月收集浙江省瑞安市人民医院存档的宫颈癌石蜡包埋病理标本82份(82例患者),用免疫组化法分析组织中P15、P16蛋白表达,并与50例子宫肌瘤手术切除的正常宫颈组织比较。现总结报道如下。
1 资料与方法
1.1 一般资料82例患者术前未经放疗、化疗治疗;年龄33~72岁,平均(51.2±11.3)岁;病理组织学分级按WHO(2006年出版)的分级标准,其中Ⅰ级28例,Ⅲ级35例,Ⅲ级19例;淋巴结转移32例,无淋巴结转移50例;脉管癌栓39例,无脉管癌栓43例。对照组50例,组织来源于本院同期子宫肌瘤手术切除的宫颈标本;所选组织均经过10%甲醛溶液固定,石蜡包埋,常规HE切片,经二位中级职称以上病理学专科医生确诊,连续4 m切片备用。
1.2 方法
1.2.1 免疫组化染色用免疫组化SP法,P15、P16克隆抗体购自上海麦莎公司,SP试剂盒购于武汉博士德公司;免疫组织化学SP试剂盒购自福州迈新公司。入选组织标本均用10.0%甲醛固定,常规脱水,石蜡包埋备用;抗原修复用微波和抗原修复液,DAB显色,苏木精复染;以TBS缓冲液替代一抗作为阴性对照,已知的阳性组织作为阳性对照,所用的P15、P16单克隆抗体稀释度为1∶100。
1.2.2 免疫组化染色结果判定标准
P16、P15蛋白分布于细胞核或细胞质,阳性结果呈黄色或棕黄色颗粒状。切片在400倍油镜下观察,阳性细胞数<5%为阴性(-);<25%为弱阳性(+);25%~50%为明显阳性(2+);>50%为强阳性(3+)[3]。1.3统计方法用SPSS13.0统计学软件,计数资料采用X2检验分析。P<0.05为差异有统计学意义。
2 结果
2.1 P16与P15在宫颈癌组织和正常组织中的表达比较P15、P16在正常组和宫颈癌组中的阳性表达率分别为98.00%和50.00%、96.00%和51.22%,两组差异均有统计学意义(X2=32.987、 28.711,均P<0.05)。见表1。
2.2 P15蛋白在宫颈癌组织中的表达与组织学特征及临床分期的关系组织学分级越高,P15蛋白的表达越低(P<0.05),临床分Ⅲ期者明显低于Ⅰ期+Ⅱ期(P<0.05),有淋巴结转移者低于无淋巴结转移者(P<0.05),有癌栓者低于无癌栓者(P<0.05)。见表2。
2.3 P16蛋白在宫颈癌组织中的表达与组织学特征及临床分期的关系组织学分级越高,P16蛋白的表达越低(P<0.05),临床分Ⅲ期者明显低于Ⅰ期+Ⅱ期(P<0.05),有淋巴结转移者低于无淋巴结转移者(P<0.05),有癌栓者低于无癌栓者(P<0.05)。见表3。
3 讨论
P15、Pl6基因又称细胞周期依赖性激酶抑制基因(CDKN2B),是两个高度同源的同一个家族的多肿瘤抑制基因(MTS),可与cyclin D竞争性结合CDK 4/ CDK6,使细胞停止生长。细胞周期的调控异常与肿瘤的发生密切相关,细胞周期素依赖性蛋白激酶(CDK)抑制因子细胞周期引擎抑制剂分子(CDI)已经被确认[4]。本研究显示P15、P16在正常组和宫颈癌组中的阳性表达率分别为98.00%和50.00%、96.00%和51.22%,两者差异有统计意义(均P<0.05)。由此可见P15、P16蛋白在正常宫颈组织中的
阳性表达率明显高于宫颈癌组织,参与宫颈癌组织细胞生长周期的调控。
当P15基因发生突变或功能缺失,在肿瘤组织中表达异常时则有可能导致细胞周期调控紊乱,促进细胞无限增值和肿瘤发生、进展[5]。P15基因的失活机制主要有缺失、重排、突变和过度甲基化[6]。P15基因在转录启动子区域5'-CpG岛多位点过度甲基化,是P15基因失活的另一形式[7]。P15基因的异常与免疫功能的失调之间可能有某种联系[8]。目前已公认Pl6缺失导致肿瘤的发生,但如果再有P15的缺失则更易导致肿瘤的发生[9]。Pl6基因作为一个重要的肿瘤抑制基因,参与肿瘤发生的周期调控,P16缺失可使细胞无限制由G1期进入S期,并在细胞未成熟时即开始分裂,最终导致细胞永生化[10]。本组资料发现宫颈癌组织中的P15、Pl6蛋白随着肿瘤组织学分级、临床分期的升高其阳性表达率逐渐下降(P<0.05),有淋巴结转移者P15、Pl6蛋白阳性表达率低于无淋巴结转移(P<0.05),有癌栓者P15、Pl6蛋白阳性表达率低于无癌栓者(P<0.05)。由此可见P15、Pl6蛋白参与宫颈癌组织细胞周期的负性调节因子,P15、Pl6蛋白表达缺失越严重,其组织学分级、临床分期就越高,发生淋巴系统和血行转移的可能性增大,并影响病情的进展。因此笔者认为对宫颈癌组织进行P15、P16蛋白检测对宫颈癌不同阶段诊断、生物学行、预后的判断可能具有一定的临床价值。
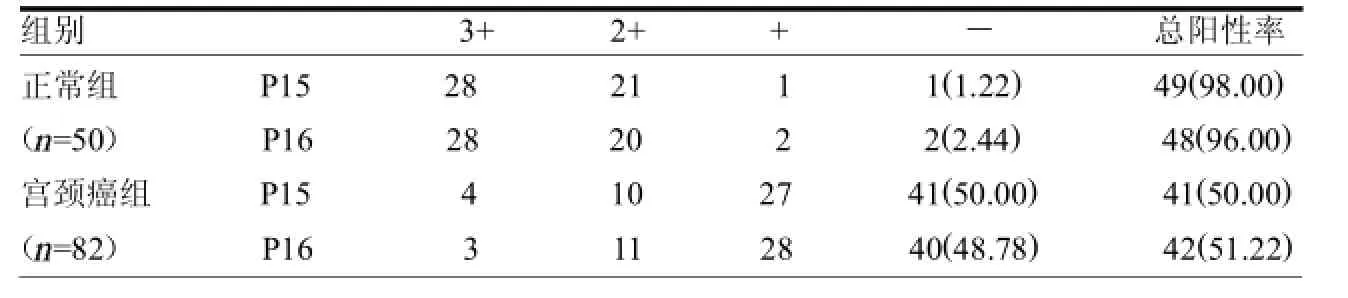
表1 P16和P15在宫颈癌组织和正常组织中的表达比较例(%)
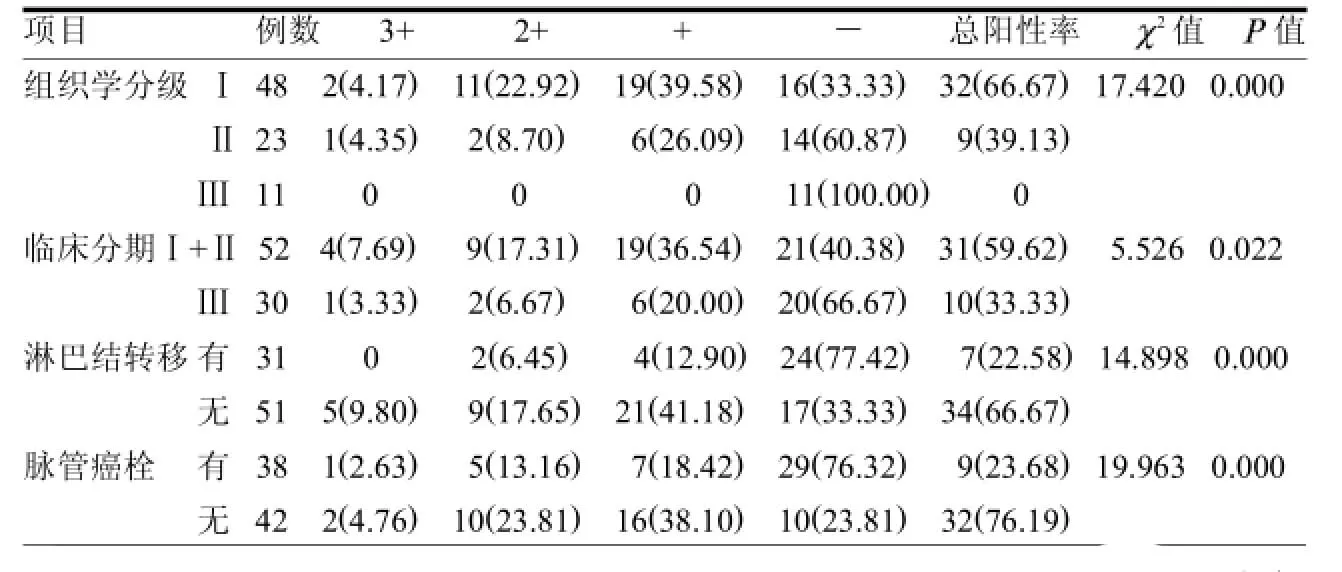
表2 P15蛋白在宫颈癌组织中的表达与组织学特征及临床分期的关系例(%)
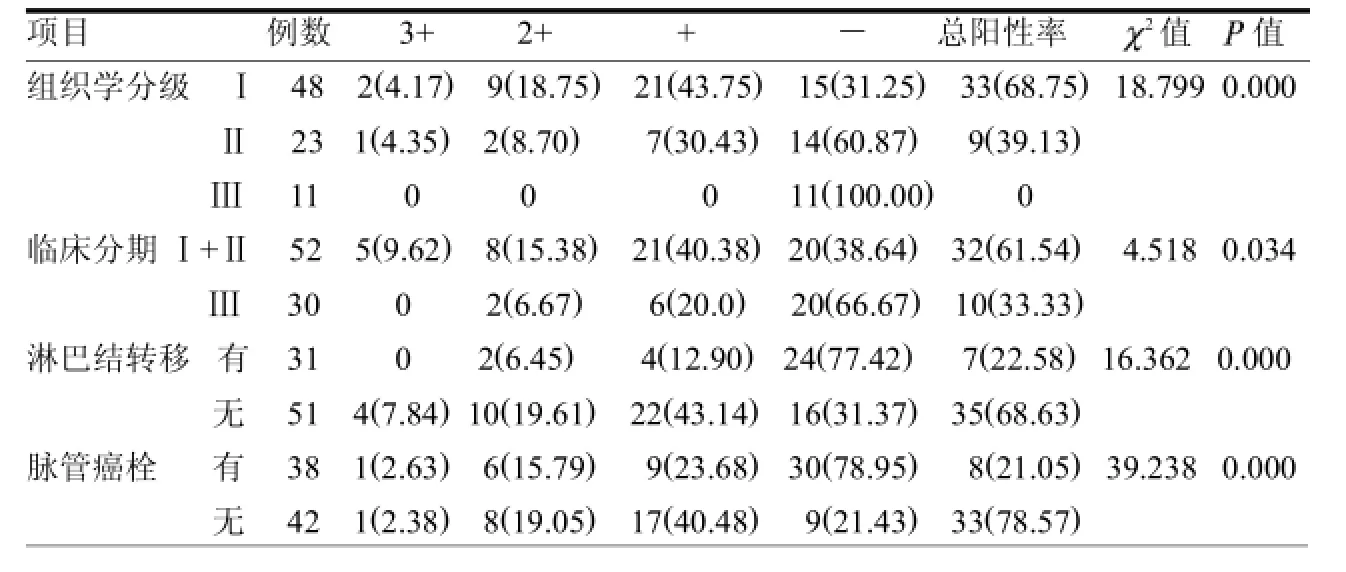
表3 P16蛋白在宫颈癌组织中的表达与组织学特征及临床分期的关系例(%)
[1]燕雯.ERK 2蛋白在新疆维吾尔族子宫颈癌中的表达及临床意义[J].中国卫生产业,2013,7(19):109-110.
[2]郑寰宇,胡月明,李鸥,等.P16、P15及VEGF蛋白在原发性卵巢癌中的表达及临床意义[J].中国肿瘤临床,2013,40(9):521-524.
[3]张巍.P15、P15蛋白在子宫颈癌中的表达及临床病理意义[J].中国医药导报,2009,6(10):61-62.
[4]杨吉成,宋礼华,周建华,等.医用细胞工程[M].上海:上海交通大学出版社,2001:185-189.
[5]Syroid DE,M ayeox PR,Burrola PG,et a1.Cell death in theSchwann cell lineage and its regulation byneuregulin[J].Proc NatlAcad SciUSA,1996,93(17):9229-9234.
[6]陈恩,肖建华.P15基因的研究进展[J].肿瘤学杂志,2009,15(3):246-247.
[7]HessCJ,ErramiA,Berkhof J,eta1.Concurrent methylation of promoters from tumor associated genes predicts outcome in acutemyeloid leukemia[J].Leuk Lymphoma,2008,49(6):1132-1141.
[8]TakeshimaM,Saitoh M,Kusano K,eta1. High frequency of hypermethylation of p14,p15 and p16 in oral precan cerous lesionsassociatedwith betelquid chew ing in SriLanka[J].JOra1 PatholMed,2008, 37(8):475-479.
[9]刘冬满,何世东,张志勇,等.子宫内膜癌中p15及MDM 2蛋白表达[J].中国老年学杂志,2010,30(7):1936-1937.
[10]郭建华,伍亚云,刘俊宏.p53、p16和C-myc基因表达在宫颈癌早期诊断中的价值[J].现代中西医结合杂志,2013,22(23): 2518-2523.
10.3969/j.issn.1671-0800.2014.06.025
R737.33
A
1671-0800(2014)06-0689-02
325200 浙江省瑞安,瑞安市人民医院(蔡丽梅、虞如芬);瑞安市中医院(朱珍珍)
蔡丽梅,Email:992327395@ qq.com。
