不同诱导条件下家蝇(Musca domestica)三龄幼虫免疫相关基因的表达研究
2014-03-17修江帆魏川川陈明明吴建伟
修江帆 魏川川 陈明明 吴建伟
(贵阳医学院,贵阳 550004)
不同诱导条件下家蝇(Musca domestica)三龄幼虫免疫相关基因的表达研究
修江帆 魏川川 陈明明 吴建伟
(贵阳医学院,贵阳 550004)
旨在研究在不同诱导条件下家蝇三龄幼虫先天性免疫基因的表达情况。采用冷刺激、热刺激及革兰氏阴性菌、革兰氏阳性菌和真菌注射诱导12 h后提取家蝇三龄幼虫总RNA。根据GenBank公布的家蝇磷酸甘油醛脱氢酶(GAPDH)基因、攻击素(Attacin)、天蚕素(Cecropin)、防御素(Defensin)、双翅肽(Diptericin)、溶菌酶(Lysozyme)、热休克蛋白(Heat shock protein,HSP)及家蝇抗真菌肽(MAF-1)基因序列进行RT-PCR反应,以GAPDH基因为内参照,分析在不同诱导条件下家蝇三龄幼虫先天性免疫基因的表达情况。结果显示,不同条件诱导下,家蝇免疫相关基因表达显现较大差异,微生物诱导比物理刺激诱导后家蝇免疫相关基因表达水平高;真菌、阳性菌诱导后家蝇免疫相关基因表达量最高,阴性菌次之;冷刺激诱导最低。微生物及物理刺激均能激活家蝇的免疫系统,在不同条件刺激下,家蝇幼虫机体免疫应激反应不同。
家蝇 诱导 先天性免疫 基因表达
家蝇是一种世界性广泛分布的昆虫,隶属于昆虫纲双翅目环裂亚目蝇科蝇属。家蝇从幼虫到成虫均喜好生活在病原物富集的环境中,其体表可携带多种病原体,而自身却不受到病原物的侵害。这一特性归功于其独特而完善的免疫防御机制。家蝇不具有T、B淋巴系统,因此不具有高等动物的获得性免疫系统,然而,昆虫之所以能够对病原体的侵入做出迅速、有效的免疫应答,表明昆虫具有对非特异因子产生免疫应答的高效先天性免疫系统。昆虫的先天性免疫可分为体液免疫和细胞免疫。细胞
免疫主要依靠血细胞对病原体进行包裹、吞噬等作用完成的。体液免疫主要通过脂肪体细胞产生抗菌肽来抵抗、清除外源病原体[1,2]。
抗菌肽是一类普遍存在的防御性蛋白质,具有分子量小、理化性能稳定和广谱抗菌等特点,在昆虫先天免疫防御系统中起着重要的作用[3]。抗菌肽基因的表达是受到严格基因调控的,不同病原体可通过激活不同的信号通路产生各类抗菌肽分子。以模式生物果蝇为例,真菌与大多数革兰氏阳性菌激活Toll受体介导的信号途径,调控果蝇抗真菌肽(Drosomycin)基因表达;革兰氏阴性菌激活IMD信号途径,调控果蝇抗菌肽(Drosocin)、双翅肽(Diptericin)等基因表达;而防御素(Defensin)和攻击素(Attacin)等基因受到Toll及IMD信号途径共同调控[4]。
昆虫体液免疫除了抗菌肽发挥主要作用外,体内一些复合功能性酶及分子伴侣在先天性免疫系统中同样发挥不可替代的作用。溶菌酶(Lysozyme)能催化细菌细胞壁中黏多糖N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的1,4-糖苷键的水解,导致细菌细胞壁破裂、内容物溢出使细菌死亡[5]。热休克蛋白可协助蛋白质的跨膜运输,放置蛋白质前体积累并刺激蛋白转移,在应激情况下能起到稳定多肽链,防止其失活,保护机体的作用[6]。
家蝇作为一种与人类生活密切相关的病原生物,关于其先天性免疫系统激活及先天性免疫相关基因之间协同作用的相关研究报道相对较少。本研究拟选用不同诱导方式及多种微生物分别诱导激活家蝇免疫系统,研究其免疫相关基因的相互作用,旨在为今后系统研究家蝇先天性免疫信号通路奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 家蝇3龄幼虫为本实验室饲养,幼虫均重26.5 mg,饲养温度28℃,相对湿度65%,光照周期10 L∶14 D。
1.1.2 试验菌株 供试菌株,大肠杆菌(Escherich coliDH5α),金黄色葡萄球菌(Staphylococcus aureusATCC6538),枯草芽孢杆菌(Bacillus subtilisCMCC 63501),白色念珠菌(Monilia albicanATCC10231),新生隐球菌(Cryptococcus neoformansF517)为中国生物药品检定所提供,本实验室保存;绿色脓杆菌(Bacteriump ocyaneum)临床鉴定分离株由贵阳医学院附属医院检验科细菌标本室提供,试验在二级生物安全实验室进行。
1.1.3 主要试剂 总RNA提取试剂盒(RNAiso PLUS)、逆转录试剂盒、TaqDNA聚合酶、DNA标志物(DL2000 DNA Marker)、琼脂糖等购置于TaKaRa公司,其余试剂购置于上海生工公司。
1.2 方法
1.2.1 标靶基因选择及引物设计 根据GenBank公布的7种家蝇先天性免疫相关基因和内参照磷酸甘油醛脱氢酶(GAPDH)基因序列,运用引物设计软件Primer Premier 5.0进行引物设计(引物序列见表1)。引物由上海生工生物技术服务有限公司合成。使用前用灭菌DEPC处理水稀释至20 μmol/L。
1.2.2 家蝇幼虫的诱导
1.2.2.1 物理诱导 热刺激家蝇幼虫(RJ组),依照本课题组常楚瑞[7]方法,将家蝇幼虫置于干净平皿中,65℃放置1 min,取出后室温静置5 min;重复该过程2次;之后将其再置入65℃放置5 min,取出后将幼虫放入洁净培养皿中继续饲养6 h后提取总RNA。冷刺激家蝇幼虫(BD组),将家蝇幼虫置于洁净平皿中-20℃放置1 min,取出后室温静置5 min;重复该过程2次;之后将其再置入-20℃放置5 min,取出后将幼虫放入洁净培养皿中继续饲养6 h后提取总RNA。机械损伤诱导(PBS组),注射PBS溶液5 μL作为机械损伤对照,将诱导后幼虫放入洁净培养皿中继续饲养6 h后提取总RNA。设置正常条件饲养作为空白对照(空白组),每组试验进行生物重复3次。
1.2.2.2 微生物菌液注射诱导 分别液体培养微生物,至菌体密度达到2×107-9×107,菌液经5 000×g离心3 min后,弃上清液,PBS缓冲液重悬菌液,用微量注射器进行幼虫腹腔注射,注射量为5 μL。取出后将幼虫放入洁净培养皿中继续饲养6 h后提取总RNA。试验分为革兰氏阴性菌:大肠杆菌诱导组(DC组),绿色脓杆菌诱导组(LN组);革兰氏阳性菌:金黄色葡萄球菌诱导组(JP组),枯
草芽孢杆菌诱导组(KC组);真菌:白色念珠菌诱导组(BN组);新生隐球菌诱导组(XY组),每组试验进行生物重复3次。

表1 PCR扩增引物序列
1.2.3 家蝇总RNA提取及cDNA的合成 分别提取各试验组单只幼虫RNA,总RNA得抽提按照TaKaRa公司的RNAiso PLUS说明书进行操作。总RNA经电泳检测,GeneQuant公司核酸定量分析仪测定A260/A280比值及浓度,选取A260/A280的比值范围为1.95-2.00的样本,以1 μg总RNA为模板,按照cDNA合成试剂盒说明书合成cDNA第一链。
1.2.4 RT-PCR及产物鉴定 PCR扩增反应体系为25 μL:LA PCR buffer 2.5 μL,Taq酶(5 U/μL)0.5 μL,dNTPs Mixture(10 nmol/L)0.4 μL,上下游引物(20 nmol/L)各1.0 μL,模板cDNA(100 ng/μL)1.0 μL,双蒸水补足至25 μL。扩增条件为:94℃预变性5 min;94℃ 1 min,60℃ 30 s,72℃ 1 min,30个循环;72℃延伸10 min,扩增完毕后10℃终止反应。取5 μL扩增产物做2.0%琼脂糖凝胶电泳,溴化乙锭(EB)染色,凝胶呈现系统观察并记录(3500R型,Tanon)。
1.2.5 家蝇先天性免疫相关基因mRNA表达量的分析 凝胶成像系统对电泳图谱进行扫描记录,运用Quantity One(V4.6.2)分析电泳图,记录扩增基因片段的光密度值。计算家蝇先天性免疫相关基因与内参基因的光密度比值(Band Relative Value),衡量家蝇定量分析不同状态下先天性免疫相关基因的表达量[8]。运用PASW Statistics 18软件对数据进行统计学分析,将数据结果输入GraphPad Prism 5软件进行图像绘制。
2 结果
2.1 家蝇内参基因及先天性先天性免疫基因RTPCR扩增结果
半定量RT-PCR检测家蝇三龄幼虫不同状态下各基因表达情况。PCR扩增结果(图1)显示,均能扩增出特异性单一条带,与对应的基因片段理论值大小相符。不同状态下内参基因GAPDH条带亮度稳定,其余各基因具有差异表达。
2.2 不同诱导条件下各相关基因mRNA表达量比较
数据经统计学分析后,得到不同状态下家蝇幼虫先天性免疫相关基因表达情况结果(表2)。
2.2.1 Attacin基因表达 Attacin基因经诱导后均明显上调(图2)。各试验组中BN组诱导上调最为明显(0.848 9±0.039 6),其表达量约为空白对照组(0.137 8±0.028 3)的6倍,约为PBS对照组(0.456 0±0.163 7)的1.8倍,微生物组诱导上调幅度均强于物理诱导组。两组物理条件诱导热刺激组(0.536 2±0.039 6)表达量约为正常组的3.9倍,冷
刺激组(0.421 3±0.130 6)表达量约为正常组的3.1倍,两组诱导与PBS组的诱导上调能力相近。不同诱导方式Attacin基因表达量由高到低为BN组、XY组、JP组、KC组、DC组、LN组、RJ组、PBS组、BD组、空白组。

图1 不同诱导条件下家蝇幼虫先天性免疫相关基因PCR电泳图
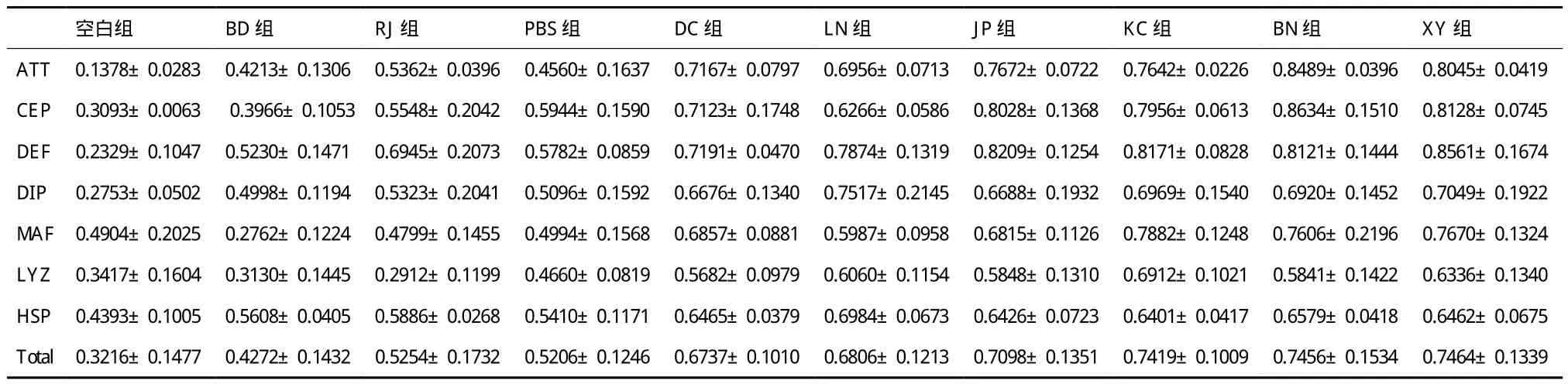
表2 不同诱导条件下家蝇幼虫各基因表达量

图2 家蝇幼虫Attacin基因表达情况
2.2.2 Cecropin基因表达 Cecropin基因经诱导后均明显上调(图3)。各试验组中BN组诱导上调最为明显(0.863 4±0.151 0),其表达量约为空白对照组(0.309 3±0.006 3)的2.8倍,约为PBS对照组(0.594 4±0.159 0)的1.5倍,微生物组诱导上调幅度均强于物理诱导组。两组物理条件诱导热刺激组(0.554 8±0.204 2)表达量约为正常组的1.8倍,冷刺激组(0.421 3±0.130 6)表达量与正常组接近,两组对Cecropin基因诱导上调能力均弱于PBS组。不同诱导方式Cecropin基因表达量由高到低为BN组、XY组、JP组、KC组、DC组、LN组、PBS组、
RJ组、BD组、空白组。
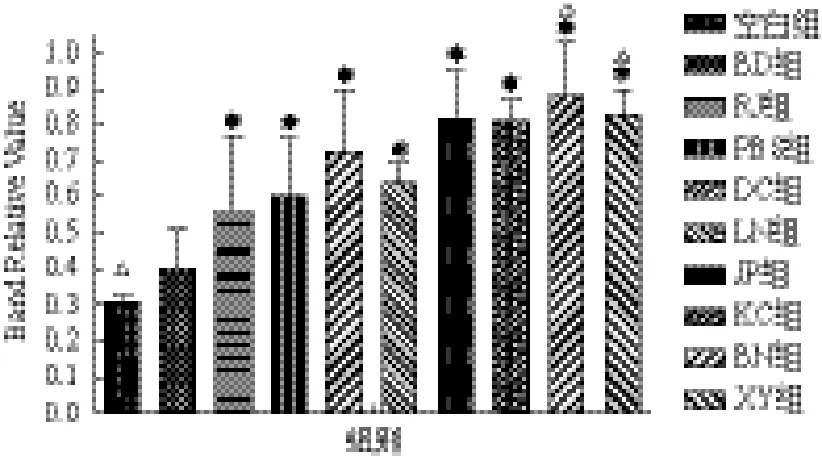
图3 家蝇幼虫Cecropin基因表达情况
2.2.3 Defensin基因表达 Defensin基因经诱导后均明显上调(图4)。各试验组中XY组诱导上调最为明显(0.856 1±0.167 4),其表达量约为空白对照组(0.232 9±0.104 7)的3.7倍,约为PBS对照组(0.578 2±0.085 9)的1.5倍,微生物组诱导上调幅度均强于物理诱导组。两组物理条件诱导热刺激组(0.694 5±0.207 3)表达量约为正常组的3倍,冷刺激组(0.523 0±0.147 1)表达量约为正常组的2.2倍,热刺激组对Defensin基因诱导上调能力略强于PBS组;冷刺激组对该基因的诱导上调能力略弱于PBS组。不同诱导方式Defensin基因表达量由高到低为XY组、JP组、BN组、KC组、LN组、DC组、RJ组、PBS组、BD组、空白组。
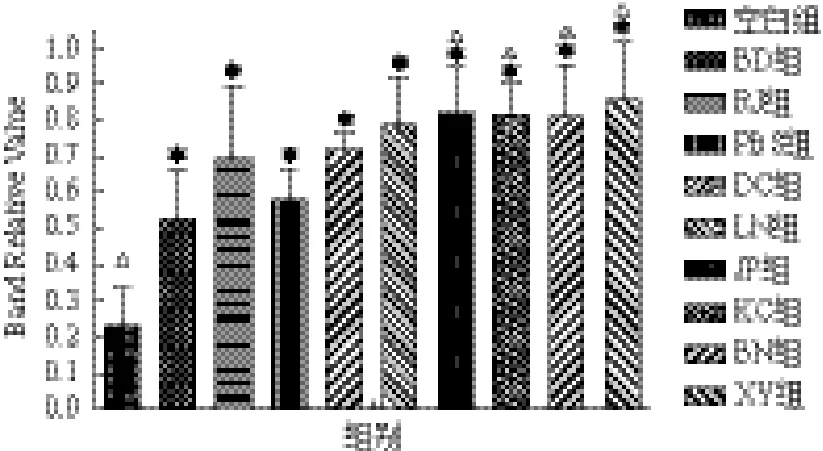
图4 家蝇幼虫Defensin基因表达情况
2.2.4 Diptericin基因表达 Diptericin基因经诱导后均明显上调(图5)。各试验组中LN组诱导上调最为明显(0.751 7±0.214 5),其表达量约为空白对照组(0.275 3±0.050 2)的2.9倍,与PBS对照组接近,微生物组诱导上调幅度均强于物理诱导组。两组物理条件诱导热刺激组(0.532 3±0.204 1)表达量约为正常组的1.9倍,冷刺激组(0.499 8± 0.119 4)表达量约为正常组的1.9倍,两个物理诱导组对Diptericin基因诱导上调能力与PBS组接近;热刺激组对该基因的诱导上调能力略强于BD组。不同诱导方式Defensin基因表达量由高到低为LN组、XY组、KC组、BN组、JP组、DC组、RJ组、PBS组、BD组、空白组。
2.2.5 MAF-1基因表达 MAF-1基因经诱导后均明显上调(图6)。各试验组中KC组诱导上调最为明显(0.788 2±0.124 8),其表达量约为空白对照组(0.490 4±0.202 5)的1.61倍,约为PBS对照组(0.499 4±0.156 8)的1.58倍,微生物组诱导上调幅度均强于物理诱导组。两组物理条件诱导热刺激组(0.479 9±0.145 5)、冷刺激组(0.276 2±0.122 0)表达量均表现出下调趋势,其中冷刺激下调显著,正常组表达量是其的1.8倍。不同诱导方式Defensin基因表达量由高到低为KC组、XY组、BN组、DC组、JP组、LN组、PBS组、空白组、RJ组、BD组。
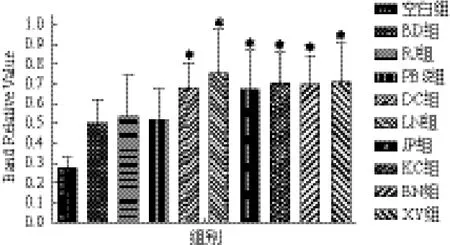
图5 家蝇幼虫Diptericin基因表达情况

图6 家蝇幼虫MAF-1基因表达情况
2.2.6 Lysozyme基因表达 Lysozyme基因经诱导后均明显上调(图7)。各试验组中KC组诱导上调最为明显(0.691 2±0.102 1),其表达量约为空白对照组(0.341 7±0.160 4)的2倍,与PBS对照组接近,微生物组诱导上调幅度均强于物理诱导组。两组物理条件诱导热刺激组(0.291 2±0.119 9)及冷刺激组(0.313 0±0.144 5)表达量较正常组略微下调。不同诱导方式Defensin基因表达量由高到低为KC组、XY组、LN组、JP组、BN组、DC组、PBS
组、BD组、RJ组、空白组。
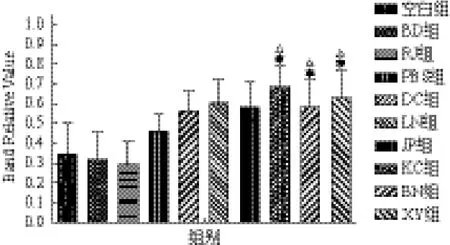
图7 家蝇幼虫Lysozyme基因表达情况
2.2.7 HSP基因表达 HSP基因经诱导后均上调(图8)。各试验组中LN组诱导上调最为明显(0.698 4±0.067 3),其表达量约为空白对照组(0.439 3±0.100 5)的1.6倍,微生物组诱导上调幅度略强于物理诱导组。两组物理条件诱导热刺激组(0.588 6±0.026 8)及冷刺激组(0.560 8±0.040 5)表达量约为正常组的1.3倍,热刺激组表达量略强于冷刺激组,两个物理诱导组对HSP基因诱导上调能力略强于PBS组。不同诱导方式Defensin基因表达量由高到低为LN组、BN组、XY组、DC组、JP组、KC组、RJ组、BD组、PBS组、空白组。

图8 家蝇幼虫HSP基因表达情况
3 讨论
生物体内的基因差异性表达是调控生命活动的重要机制,不同发育阶段、不同生理状态下基因的表达决定了整个生命过程,包括发育和分化、内环境稳定、对逆环境的反应等[9]。不同的物理化学因子及病原体侵入对昆虫机体状态造成改变,将激活昆虫的先天性免疫系统引发昆虫的免疫应激反应,诱导体内相应免疫基因表达,修复机体损伤[10-12],试验结果显示物理因子及病原物诱导后各免疫相关基因表达量均表现出上调趋势,这也说明诱导后,家蝇机体状态发生改变,产生了免疫应激反应。不同因素作用下,家蝇产生的免疫反应程度有所差别。
昆虫热刺激下,将发生机体整体性免疫应答,将增加抗菌肽,副肌球蛋白、铁蛋白、转铁蛋白、原肌球蛋白、热休克蛋白、丝氨酸蛋白等基因的转录[13,14]。本研究结果显示,热刺激下,各靶标基因表现出显著上调趋势。体壁损伤诱导也是一种常用免疫激活的方式,昆虫体壁损伤后,体液外渗,同时激活机体免疫系统,免疫相关基因大量转录,修复损伤并防御外源病原体入侵[16]。本研究结果显示在家蝇体壁损伤情况下,各免疫相关基因显现出整体动员趋势。冷刺激降低机体整体代谢水平,体内代谢相关酶的活性降低,将会引起昆虫的滞育[17]。试验结果显示,MAF-1、溶菌酶、热休克蛋白基因在冷刺激后表现出下调的趋势,推测这些基因可能与家蝇整体生理代谢水平还处于一个恢复阶段有关,可能待机体完全回复正常代谢水平时,随之趋于正常表达水平。而Attacin、Cecropin、Defensin及Diptericin等抗菌肽基因则表现出表达量升高趋势,推测在机体处于较低代谢水平时,主要由抗菌肽基因行使免疫防御功能。
昆虫体液免疫的主要特点是机体受外源微生物感染后,脂肪体细胞合成抗菌肽,抗菌肽分泌到血淋巴中杀死入侵的病原体[4]。不同的病原微生物通过激活不同的信号通路产生各自的抗菌肽。昆虫先天性免疫信号通路主要有两条,一条是由Toll受体介导的信号通路,它是由革兰氏阳性菌和真菌激活的;另一条是IMD信号通路,它是由革兰氏阴性菌诱导激活的。Toll信号通路主要调控Drosomycin基因的表达;IMD信号通路主要调控Drosocin、Diptericin基因的表达;而Attacin、Defensin、Cecropin基因则受到Toll和IMD信号通路共同调控[18-21]。在本研究中,整体水平上微生物诱导均能显著上调抗菌肽基因的转录水平。Diptericin在大肠杆菌和绿色脓杆菌这两种阴性菌诱导后上调幅度最为明显,推测家蝇Diptericin基因主要是受革兰氏阴
性菌激活IMD信号通路所调控。Attacin、Defensin、Cecropin基因均表现出阴性菌、阳性菌及真菌诱导显著上调的趋势,且真菌和革兰氏阳性菌对抗菌肽基因诱导上调能力略强于革兰氏阴性菌,推测这3种基因是受到Toll信号通路调控和IMD信号通路调控,Toll通路调控起主导作用。
MAF-1是本课题组前期从家蝇血淋巴中分离到的一种具有抗菌活性的生物多肽[22],前期研究发现MAF-1基因既是家蝇的免疫分子之一,也是家蝇幼虫发育有关的生理因子之一。本研究发现在冷刺激状态下,MAF-1基因显著下调,证实冷刺激下,机体发生滞育,MAF-1作为发育相关因子同样受到影响。而在微生物诱导下显著上调,也进一步证实MAF-1为家蝇先天性免疫系统中一个重要组成部分。
溶菌酶(Lysozyme)是一种能水解黏多糖的碱性酶,它能催化细菌细胞壁中黏多糖N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的1,4-糖苷键的水解,导致细菌细胞壁破裂、内容物溢出使细菌死亡,因此它是一种广谱的抗菌效应分子,除此之外它还可以诱导调节其他免疫分子的合成和分泌[23]。本研究中,在外源微生物没有入侵家蝇体内时,溶菌酶基因较低水平表达。当家蝇体壁受到机械性损伤和微生物入侵时,溶菌酶基因表达水平迅速上调。推测可能微生物入侵能快速激活溶菌酶基因的调控转录。在两种物理因子刺激下,与正常对照组相比,溶菌酶基因表达未表现出显著差异,推测溶解酶在机体内主要发挥清除入侵微生物,保护机体作用。
热休克蛋白(HSP)是昆虫应激代谢及免疫应答过程中产生的一类重要蛋白质,它们主要作用是协助蛋白质的跨膜运输,放置蛋白质前体积累并刺激蛋白转移,在应激情况下能起到稳定多肽链,防止其失活,起到保护机体的作用。结合本研究发现在HSP基础代谢水平较高,在物理因子刺激下,HSP表达水平上调,推测其可能在机体应激恢复中对多种功能性蛋白质、酶类发挥协同作用,帮助机体回复正常状态。在经微生物诱导后,HSP转录水平明显增高,推测其可能协助、参与机体免疫应答反应,同多种抗菌分子共同作用,保护机体,清除病原微生物。
4 结论
家蝇幼虫先天性免疫系统中,抗菌肽及其他免疫相关基因发挥重要作用。微生物及物理因子刺激均能激活家蝇的免疫系统,在不同条件刺激下,家蝇幼虫机体免疫应激反应不同。微生物诱导免疫应激反应强于物理因子诱导;各种微生物诱导条件下,革兰氏阳性菌和真菌激活免疫系统能力最强。
[1] Leclerc V, Reichhart JM. The immune response ofDrosophila melanogaster[J]. Immunol Rev, 2004, 198:59-71.
[2] 刘甜, 罗开珺.果蝇Toll和IMD信号通路中的功能结构域[J].环境昆虫学报, 2011, 33(3):388-395.
[3] Flatt T, Heyland A, Rus F, et al. Homonal regulation of the humoral innate immune response inDrosophila melanogaster[J]. Exp Biol, 2008, 211:2212-2224.
[4] 曹慧, 李宗芸, 王秋香.果蝇先天性免疫研究进展[J].昆虫知识, 2009, 46(2):196-200.
[5] 郑立, 李娟, 郭亚伟, 等.家蝇溶菌酶2(MdL2)基因的克隆及其性质研[J].四川动物, 2011, 30(5):705-710.
[6] 王林玲, 林海静, 王钰, 等.家蚕热休克蛋白70家族基因的染色体定位及表达特征[J].蚕业科学, 2012, 38(4):617-623.
[7] 常楚瑞, 吴建伟, 国果, 等.不同诱导方法诱导家蝇幼虫血淋巴中抗菌肽差异性的SDS-PAGE检测[J].时珍国医国药, 2011, 22(3):535-537.
[8] Vandersompele J, De Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3(7):3401-3411.
[9] 金小宝, 王艳, 朱家勇, 等.家蝇生长发育各阶段抗菌肽基因表达情况的研究[J].中国寄生虫学与寄生虫病杂志, 2008, 26(3):187-191.
[10] Xia Q, Cheng D, Duan J, et al. Microarray-based gene expression profiles in multiple tissues of the domesticated silkworm,Bombyx mori[J]. Genome Biol, 2007, 8(8):R162.
[11] Jiang R, Kim EH, Gong JH, et al. Three pairs of protease-serpin complexes cooperatively regulate the insect innate immune responses[J]. Biol Chem, 2009, 284:35652-35658.
[12] 胡智明, 刘清明, 邱国祥, 林忠芬.家蚕先天性免疫的研究[J].广东蚕业, 2012, 46(2):39-44.
[13] 刘红美, 张洁, 王赟, 等.热胁迫后家蝇幼虫cDNA文库构建与随机EST测序分析[J].免疫学杂志, 2010, 26(9):772-776.
[14] Mahadav A, Kontsedalov S, Kontsedalov S, et al. Thermotolerance and gene ecpression following heat stress in the whiteflyBemisia tabaciB and Q biotypes[J]. Insect Biochem Biol, 2009, 39(10):668-676.
[15] Boyer L, Magoc L, Dejardin S, et al. Pathogen-derived Effectors trigger protective immunity via activation of the Rac2 enzyme and the IMD or rip kinnase signaling pathway[J]. Cell Press, 2011, 8(15):536-549.
[16] 肖海军, 魏兆军, 薛芳森.昆虫滞育关联热休克蛋白的研究进展[J].昆虫学报, 2011, 54(9):1068-1075.
[17] Hoffmann J, Rerchhart J.Drosophilainnate immunity:an evolutionary perspective[J]. Nature Immunol, 2002, 3(2):121-126.
[18] 卢丹, 郑立, 王欣欣, 等.家蝇Denfensin-1基因的克隆、诱导表达及启动子活性分析[J].昆虫学报, 2013, 56(8):854-863.
[19] Buchon N, Poidevin M, Kwon HM. A single modular serine protease integrates signals from pattern-recognition receptors upstream of theDrosophilaToll pathway[J]. Proc Natl Acad Sci USA, 2009, 106(30):12442-12447.
[20] Gottar M, Gobert V, Michel T, et al. TheDrosophilaimmune response against Gram negative bacteria is mediated by a peptidoglycan recongnition protein[J]. Nature, 2002, 416(6881):640-644.
[21] Irving P, Troxler L, Hetru C. Is innate enough? The innate immune response inDrosophila[J].C R Biol, 2004, 327(6):557-570.
[22] Fu P, Wu J, Guo G. Purification and molecular identification of an antifugal peptide from the hemolymph ofMusca domestica[J].Cellular & Molecular Immunology, 2009, 6(4):245-253.
[23] 王赟, 龙高群.美洲大蠊i型溶菌酶基因的克隆及功能预测[J].动物医学进展, 2012, 33(9):21-27.
(责任编辑 马鑫)
Expression Analysis of Immune Genes at Different Induction Conditions of Third Instar Larvae of Musca domestica
Xiu Jiangfan Wei Chuanchuan Chen Mingming Wu Jianwei
(Guiyang Medical University,Guiyang 550004)
We studied on the innate immune gene expression at different induction conditions of third instar larvae of Musca domestica. We chose the cold, heat stimulation and gram negative bacteria, gram positive bacteria and fungi induced the third instar larvae, 12 hours after the total RNA was extracted from third instar larvae.We designed the primers according to the published GenBank glyceraldehyde phosphate dehydrogenase(GAPDH), Attacin, Cecropin, Defensin, Diptericin, Lysozyme, heat shock protein(HSP)and Musca antifungal peptide(MAF-1)gene sequences of housefly. We were using the GAPDH as reference gene. Analysed the gene expression in different inducing conditions of third instar larvae of housefly through RT-PCR reaction. Results showed that in different inducing conditions, the genes related innate immunity expression showed large differences. Microbial stimulation showed the higher levels of gene expression than physical stimulation. The gene expression induction of fungi and positive bacteria was the highest, the cold stimulation induced the lowest. The innate immune system of the housefly larvae could activate by both microbial and physical stimulation. In different conditions of stimulation, the body’s immune response to different stress.
Musca domestica Induction Innate immunity Gene expression
2013-12-10
修江帆,男,讲师,博士研究生,研究方向:昆虫分子免疫;E-mail:156735385@qq.com
吴建伟,男,教授,博士生导师,研究方向:昆虫免疫学及生物活性物质利用研究;E-mail:wjw@gmc.edu.cn
