疏肝健脾养阴方联合内分泌治疗激素依赖型乳腺癌的临床研究
2014-03-17马晔琳陈良良
马晔琳 陈良良
1.浙江医院中医内科,浙江杭州310013;2.浙江省中医院肿瘤科,浙江杭州310006
疏肝健脾养阴方联合内分泌治疗激素依赖型乳腺癌的临床研究
马晔琳1陈良良2
1.浙江医院中医内科,浙江杭州310013;2.浙江省中医院肿瘤科,浙江杭州310006
目的探讨疏肝健脾养阴方联合内分泌治疗在激素依赖型乳腺癌中的作用和价值。方法将2010年7月~2012年12月在浙江省中医院或湖州市妇幼保健院治疗的136例患者分为四组:A组(绝经前,中药联合内分泌治疗,43例),B组(绝经前,单纯内分泌治疗,30例),C组(绝经后,中药联合内分泌治疗,36例)及D组(绝经后,单纯内分泌治疗,27例),随访记录相关指标,采用SPSS 17.0进行统计分析。结果A、C组CA153、T抑制(CD3+/CD8+)、总胆固醇(CHOL)、谷氨酰转肽酶(GGT)及纤维蛋白原(FIB)均分别低于B、D组,T辅助/T抑制(CD4+/CD8+)分别高于B、D组,差异有统计学意义(P<0.05)。结论中药联合内分泌治疗激素依赖型乳腺癌,可提高临床疗效,减少毒副作用,值得临床进一步推广。
中药;内分泌治疗;激素依赖型乳腺癌;作用机制
乳腺癌是女性最常见的恶性肿瘤之一,好发于40~60岁绝经前后的妇女,在我国发病率仅次于胃癌和肺癌,居第三位[1];美国国立癌症研究所最新数据显示,乳腺癌居美国女性恶性肿瘤病死率第一位[2]。目前乳腺癌的治疗以综合治疗为主,其中内分泌治疗对于激素依赖型乳腺癌患者是有效的治疗。根据国外相关大型临床研究,ER及PR阳性者有效率可达80%,ER阳性PR阴性者40%~45%,ER阴性PR阳性者25%~ 30%,而ER及PR阴性者有效率不到10%[3]。但内分泌治疗可能造成肝功能损害、脂肪肝[4]、骨密度降低[5]等毒副作用,从而降低患者依从性。中医对乳腺癌的病因病机有独特认识,通过辨证施治,协同现代医学治疗乳腺癌,可减少并发症、减毒增效、抗复发转移等[6]。本文拟通过前瞻性临床随机对照研究,从临床疗效及毒副作用两方面探究中药联合内分泌治疗激素依赖型乳腺癌的作用机制。
1 资料与方法
1.1 一般资料
136例均为2010年7月~2012年12月在浙江省中医院或湖州市妇幼保健院治疗的女性患者,经病理学和(或)组织细胞学确诊为乳腺癌,已行乳腺癌改良根治术并完成辅助化疗(化疗方案为CEF、TEC、AC-T或TE),雌激素受体(ER)和(或)孕激素受体(PR)阳性,可行内分泌治疗,排除心、脑血管疾病等严重并发症及抑郁症、精神分裂等无法配合者。参照AJCC乳腺癌分期标准(第7版,2009年),根据原发肿瘤(T)、区域淋巴结及远处转移情况(M),将纳入病例分为Ⅰ~Ⅳ期。纳入研究对象均知情同意,并签署知情同意书。
入选病例中,绝经前患者73例,将其分为A组(43例,中药联合内分泌治疗)和B组(30例,单纯内分泌治疗);绝经后患者63例,将其分为C组(36例,中药联合内分泌治疗)和D组(27例,单纯内分泌治疗)。经检验,A组与B组间、C组与D组间患者年龄差异无统计学意义(P>0.05),四组患者间病程、临床分期、激素受体分布等比较差异均无统计学意义(P>0.05)。见表1。
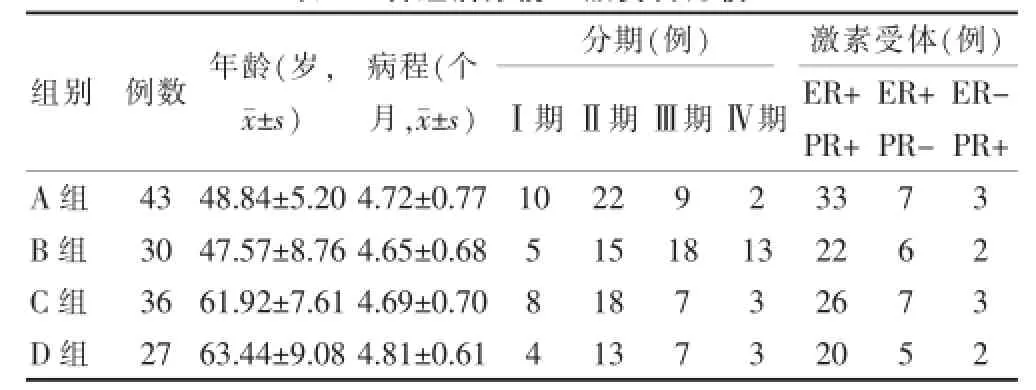
表1 各组治疗前一般资料比较
1.2 方法
1.2.1 内分泌治疗绝经前(A、B组):口服选择性雌激素受体调节剂:枸橼酸他莫昔芬片(三苯氧胺,江苏扬子江药业集团有限公司,国药准字H32021472)10mg,每日2次,或枸橼酸托瑞米芬片(法乐通,芬兰奥立安集团,注册证号H20020368)60 mg,每日1次。绝经后(C、D组):口服芳香化酶抑制剂:阿那曲唑片(瑞宁得,英国阿斯利康制药有限公司,国药准字J20100107)1 mg,每日1次,或来曲唑(弗隆,瑞士诺华制药有限公司,注册证号H20090304)2.5 mg,每日1次,或依西美坦(阿诺新,意大利辉瑞有限公司,注册证号H20100127)25mg,每日1次。连续服用3个月以上。
其中绝经标准参照乳腺癌NCCN指南(第1版,2010年):①双侧卵巢切除术后;②年龄≥60岁;③年龄<60岁,且在没有化疗和服用他莫昔芬、托瑞米芬和卵巢功能抑制治疗的情况下停经1年以上,同时血FSH及雌二醇水平符合绝经后的范围;④正在服他莫昔芬、托瑞米芬,年龄<60岁的停经患者,必须连续监测血FSH及雌二醇水平在绝经后的范围。
1.2.2 中医治疗根据临床经验及相关文献[7],肝郁脾虚为乳腺癌的主要发病机制,日久可致气阴亏虚等。故治疗组(A、C组)在内分泌治疗基础上,予自拟疏肝健脾养阴方(药用:柴胡12 g、郁金12 g、制半夏9 g、陈皮9 g、太子参12 g、白术12 g、茯苓12 g、米仁30 g、白芍12 g、萸肉12 g、麦冬12 g、枸杞子12 g)治疗;必要时随证加减(大便干结者加瓜蒌仁15 g,便溏者加木香12 g、苍术9 g,纳差者加鸡内金12 g、炒麦芽30 g,骨蒸潮热者加青蒿9 g、地骨皮12 g,虚烦不眠者加酸枣仁9 g、夜交藤30 g,口渴者加天花粉12 g、葛根15 g,汗出甚者加五味子9 g、煅牡蛎30 g);中药饮片来自浙江省中医院或湖州市妇幼保健院中药房,以上为每日1剂用量,取上述中药加自来水250 mL,浸泡半小时,煎煮至200 mL,每日上午及下午分2次温服,连续服用3个月以上。
1.3 观察指标及检测方法
入组时及治疗后3个月分别测定、记录以下指标:①肿瘤标志物:清晨空腹采臂肘静脉血2 mL,以3000 r/min离心10min后取血清,采用雅培i2000全自动化学发光免疫分析仪和配套试剂盒检测CA125及CA153水平;②免疫指标:清晨空腹采臂肘静脉血5 mL,采用FACSCantoⅡ流式细胞仪和配套试剂盒检测T辅助(CD3+/CD4+)、T抑制(CD3+/CD8+)及T辅助/T抑制(CD4+/CD8+);③生化指标:清晨空腹采臂肘静脉血3mL,以3000 r/min离心10 min后取血清,采用SIEMENS 1800全自动生化分析仪测定总胆固醇(CHOL)及谷氨酰转肽酶(GGT);④凝血指标:清晨空腹采臂肘静脉血5 m L,与枸橼酸钠9︰1体积抗凝,以3000 r/min离心10 min分离血浆,在2 h内采用Coatron 1800全自动血凝仪测定部分凝血酶时间(APTT)及纤维蛋白原(FIB)。
1.4 统计学方法
采用SPSS 17.0统计软件。计量资料结果描述用均数±标准差(±s)表示,其中两组计量资料采用t检验,多组计量资料采用方差分析(ANOV),必要时进一步采用SNK检验或LSD检验进行样本均数之间的两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤标志物分析
治疗前各组肿瘤标志物水平差异无统计学意义(P>0.05);治疗后B、D组CA153较治疗前显著升高(P<0.05),且均明显高于正常范围(CA153 0.00~28.00 U/mL);治疗后A、C组CA153分别较B、D组显著降低(P<0.05)。显示中药对患者CA153值的异常升高有抑制作用。见表2。
表2 各组CA125及CA153水平比较(U/m Ls)
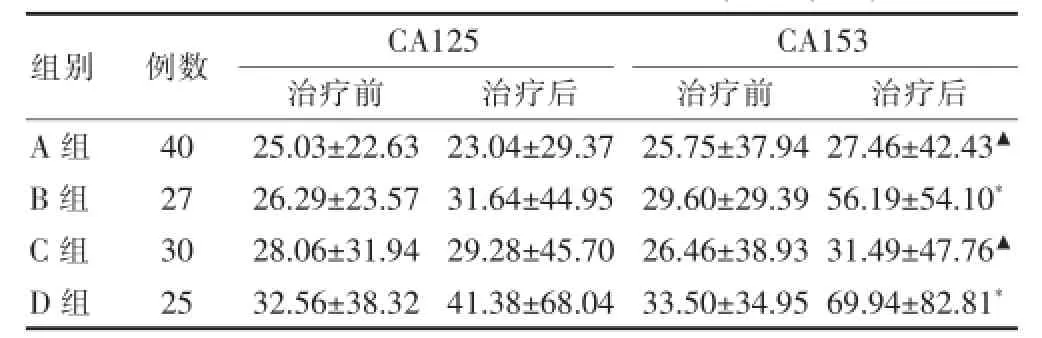
表2 各组CA125及CA153水平比较(U/m Ls)
注:与治疗前比较,*P<0.05;与B、D组比较,▲P<0.05
组别例数CA125治疗前治疗后CA153治疗前治疗后A组B组C组D组40 27 30 25 25.03±22.63 26.29±23.57 28.06±31.94 32.56±38.32 23.04±29.37 31.64±44.95 29.28±45.70 41.38±68.04 25.75±37.94 29.60±29.39 26.46±38.93 33.50±34.95 27.46±42.43▲56.19±54.10*31.49±47.76▲69.94±82.81*
2.2 免疫指标分析
治疗前各组T细胞亚群水平差异无统计学意义(P>0.05);治疗后A、C组T抑制较治疗前显著降低,T辅助/T抑制显著升高(P<0.05);治疗后A、C组T抑制分别较B、D组显著降低,T辅助/T抑制显著升高(P<0.05)。上述各指标均在正常范围(T辅助24.9%~45.6%,T抑制16.4%~33.8%)。显示中药对患者的免疫功能有调节作用。见表3。
2.3 生化指标分析
治疗前各组生化指标差异无统计学意义(P>0.05);治疗后B、D组CHOL、GGT较治疗前显著升高(P<0.05、P<0.01);治疗后A、C组CHOL、GGT分别较B、D组显著降低(P<0.05、P<0.01)。上述各指标均在正常范围(TG 0.4~1.8 mmol/L,CHOL 3.10~5.18 mmol/L,ALT 0~60 U/L,GGT 0~64 U/L)。说明中药对患者的脂代谢和肝功能有一定的调节作用。见表4。
表3 各组T辅助、T抑制及T辅助/T抑制水平比较(±s)
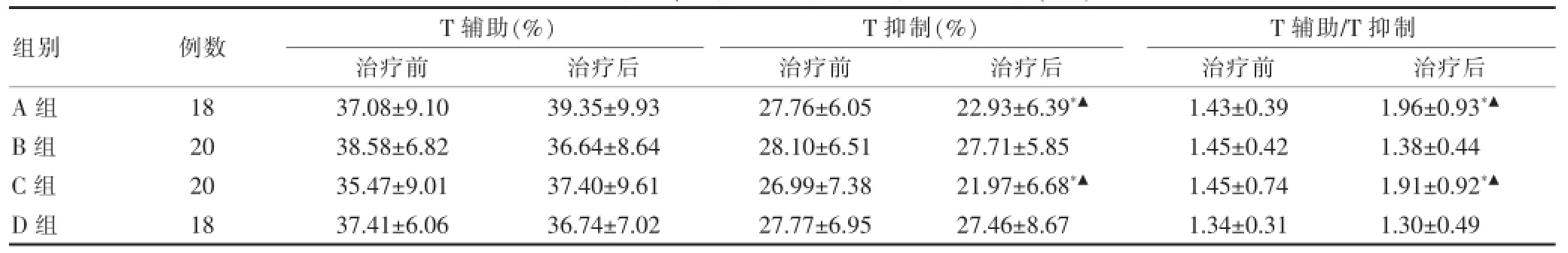
表3 各组T辅助、T抑制及T辅助/T抑制水平比较(±s)
注:与本组治疗前比较,*P<0.05;与B、D组比较,▲P<0.05
?
表4 各组总胆固醇及谷氨酰转肽酶水平比较(±s)
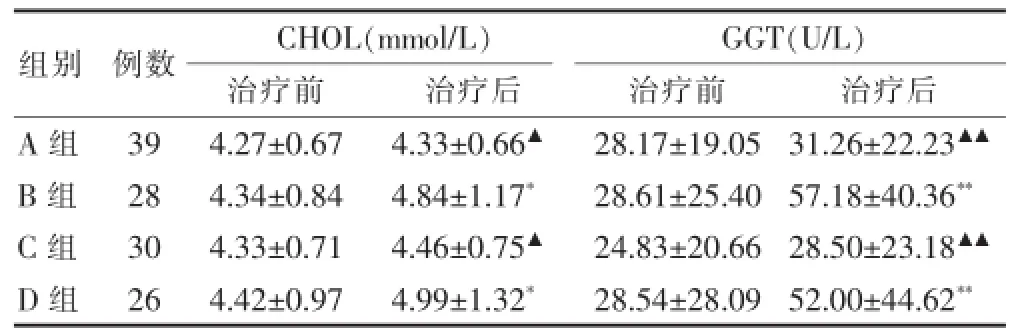
表4 各组总胆固醇及谷氨酰转肽酶水平比较(±s)
注:与本组治疗前比较,*P<0.05,**P<0.01;与B、D组比较,▲P<0.05,▲▲P<0.01;CHOL:总胆固醇;GGT:谷氨酰转肽酶
?
表5 各组部分凝血酶时间及纤维蛋白原水平(±s)
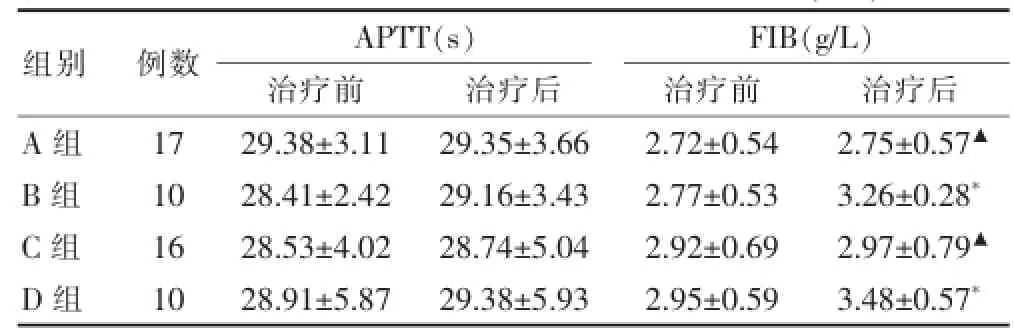
表5 各组部分凝血酶时间及纤维蛋白原水平(±s)
注:与本组治疗前比较,*P<0.05;与B、D组比较,▲P<0.05;APTT:部分凝血酶时间;FIB:纤维蛋白原
?
2.4 凝血指标分析
治疗前各组凝血指标水平差异无统计学意义(P>0.05);治疗后B、D组FIB较治疗前显著升高(P<0.05);治疗后A、C组FIB分别较B、D组显著降低(P<0.05)。上述各指标均在正常范围(APTT 23.5~36.5 s,FIB 2.00~4.00 g/L)。说明中药对患者的凝血指标有一定的调节作用。见表5。
3 讨论
目前常用的乳腺癌内分泌治疗药物有以下几类:①选择性的雌激素受体调节剂(SERM):主要有他莫西芬(Tamoxifen,TAM)、托瑞米芬(Toremifene,TOR)及氟维司群(Fulvestrant)。他莫西芬目前应用最为广泛,其作用机制为与雌二醇竞争受体,阻断核内ER生成基因的转录,绝经前、后应用均可改善预后。值得注意的是,TAM同时具有抗雌激素和弱雌激素双重作用,相关临床研究[8]证实:服用TAM的围绝经期妇女,血清FSH、LH明显低于对照组,而E2略高于对照组(P<0.01);而雌激素增高可能增加子宫内膜癌风险。此外,肝功能改变是此类药物常见不良反应,还有罕见血栓形成、精神错乱、乏力嗜睡等报道。②芳香化酶抑制剂(AI):主要包括阿那曲唑(Anastrozole)、来曲唑(Letrozle)及依西美坦(Exemestane)。其机制主要是抑制雄激素向雌激素转化过程中所必需的芳香化酶,选择性高,是绝经后乳腺癌的标准辅助治疗药物。根据JCO研究结果,阿那曲唑、来曲唑及依西美坦用于绝经后局部晚期乳腺癌患者治疗,其临床缓解率分别为69.1%、74.8%及62.9%,无显著差异[9]。不良反应方面,阿那曲唑肝功能异常及偶发房颤发生率较低,而依西美坦高脂血症、骨质疏松及阴道出血发生率较低[10]。③孕酮类药物:主要有甲地孕酮(Megace,MA)及甲孕酮(Provera,MPA),主要作用为拮抗雌激素,通过抑制垂体前叶分泌的催乳素,发挥抗乳腺癌的作用;还可改善食欲,适用于晚期特别是恶病质患者。长期应用可出现阴道流血、水钠潴留、柯兴综合征、血糖升高等副作用。④促性腺激素释放激素类似物(GnRH-a):主要包括戈舍瑞林(Goserelin)、亮丙瑞林(Leuprolide)等。此类药物可与垂体的GnRH受体结合,一方面可负反馈抑制下丘脑产生GnRH,另一方面可直接抑制垂体产生FSH和LH,使绝经前妇女的雌激素下降到绝经后水平,主要用于绝经前高危患者及复发、转移的患者,主要毒副作用类似更年期综合征。
祖国医学文献中并未记载“乳腺癌”病名,根据其临床特征可归为“乳岩”、“乳石痈”等范畴。与“肺积”、“肠蕈”等内脏恶性肿瘤相比,“乳岩”因生于体表,易于具体细致观察,故古代文献中可见颇多相关论述。最早见于《灵枢·痈疽篇》:“疽者,上皮夭以坚,上如牛领之皮。”此描述与现代医学中乳腺癌的特征性表现——橘皮样水肿相吻合。明代《外科正宗》详细论述了“乳岩”的临床表现:“经络痞涩,聚结成核,初如豆大,渐成棋子”——形象地描述其形态及动态变化;“半年一年,二载三载,不痛不痒,渐渐而大”——指其起病较隐匿,病程较长,肿块呈无痛性缓慢增大;“始生疼痛……日后肿如堆栗,或如覆碗……深者如岩穴,凸者若泛莲,疼痛连心,出血则臭”——指晚期局部溃烂疼痛出血等表现;“其时五脏俱衰,四大不救……凡犯此者,百人必百死”——此时已处于恶病质阶段,预后差。
关于“乳岩”的病因病机,祖国医学亦有其独到认识。《外证医案汇编》云“正气虚则为岩”,认为一切恶性肿瘤、包括“乳岩”的根本病因在于机体正气不足。乳岩的发生主要是由于正气不足,经虚血结,七情内伤,肝气郁结,脾失健运,冲任失调,导致经络阻塞,气滞血瘀,痰湿壅盛,痰瘀毒结,日久而发为岩。其发病过程中有三大重要环节:①肝郁:根据经络理论,乳头为足厥阴肝经所属,肝属木,喜条达而恶抑郁,若“不知调养,怒忿所遂,郁闷所遏”,可致肝气郁结,疏泄失司,气机不畅,气滞血瘀,有形之邪积聚于乳络,日久而发为“乳岩”。②脾虚:女子乳房属胃,足太阴脾经络胃上膈,脾胃纳运相助、升降相因,受盛、运化水谷精微,化生气血,与乳房的发育及乳汁的分泌关系密切。若恣食肥甘厚味,脾胃运化失司,水液运行不畅,聚湿生痰,阻滞经络气血,日久可发为“乳岩”,类似于现代医学所述高脂饮食可能产生致癌作用。③肾虚:肾主藏精,其中的精微物质“天癸”,类似于现代医学中的性激素,主司发育与生殖。若肾精不足,冲任失调,则体内性激素水平失调,易于诱发激素依赖性肿瘤。刀圭、化疗后,耗气伤津,往往以肾阴虚较为明显;病程日久或病情进展,可致阴损及阳,阴阳俱虚。上述三大病理环节并非孤立,往往相互影响,贯穿于整个病程中,且可累计他脏。根据五行理论,木为水之子,肾阴不足,水不涵木,则肝气郁结更甚,肝气乘脾,可致脾气更虚,运化无力,可见纳差;湿浊内生,可见便溏;木郁化火,木火刑金,肺阴受损,故肺为乳腺癌常见转移脏器;心肾不交,可致虚烦不寐等。故在“乳岩”治疗中,“疏肝”、“健脾”、“补肾”三治则宜贯穿始终。
近年来,相关中药单体成分或复方制剂治疗乳腺癌的基础研究表明,中药治疗乳腺癌作用机制可能如下:①抑制癌细胞增殖:双氢青蒿素[11]及益气活血中药(黄芪、苏木、蜂房、炮山甲)[12]等分别对人乳腺癌MDA-MB-231细胞及BABL/C小鼠EMT6细胞有显著抑制作用,其机制可能与下调P53蛋白的表达有关;②诱导癌细胞凋亡:透骨草提取物[13]及黄荆子乙酸乙酯提取物(EVn-50)[14]均可诱导人乳腺癌细胞株MCF-7凋亡,其机制可能与下调Bcl-2蛋白表达、上调Bax蛋白表达有关;③抑制血管新生:木犀草素[15]能下调AEG-1和MMP-2表达,有效地抑制血管新生;④抑制癌细胞侵袭:人参皂苷Rh2[16]可通过调控p-AKT等蛋白表达,降低癌细胞转移、侵袭能力;⑤抗氧化作用:灵芝乙醇提取物[17]可增加大鼠体内外SOD、CAT、GPx水平,从而发挥抗氧化作用。
但是,目前关于中药对性激素水平影响以及雌激素类似作用中药的作用机制等研究至今尚未达成共识。植物雌激素是植物中一类结构与功效类似于动物雌激素的天然杂环多酚类化合物,主要包括黄酮类(flavones)、香豆素类(coumarins)、木脂素类(lignans)及二苯乙烯类(stilbenes),广泛存在于菟丝子、淫羊藿、补骨脂、人参、枸杞子、虫草等补益药及丹参、红花、川牛膝等活血药中,此外葛根、大黄、柴胡等也含有植物雌激素。其作用机制可能是通过直接与ER结合,或激活ER或调节内源性雌激素分泌与代谢而实现的[18]。
对于乳腺癌、子宫内膜癌、前列腺癌等激素依赖型肿瘤,明确中药(尤其是一些激素类似作用中药,如补骨脂、菟丝子、淫羊藿、黑升麻等)对性激素水平的影响并阐明其机制尤为重要。尽管此类动物实验造模难度可能较大,若条件允许的情况下仍建议开展相关基础研究,深入探究此类药物的有效成分、体内代谢、有效剂量、不良反应及各药物间相互作用机制等,以筛选出选择性高、安全性强的治疗各类激素依赖型肿瘤最有效的中药,从而建立规范化的治疗体系,并有效地应用于临床。
本研究主要从临床疗效及毒副作用两方面探究中药联合内分泌治疗激素依赖型乳腺癌的作用机制。临床疗效方面,中药可控制相关肿瘤标志物水平,从而防止疾病进展,CA153及CA125等均在乳腺癌诊断、病情监控及预测复发、转移方面起重要作用,且CA153较CA125更为敏感,与以往相关研究报道一致[19-26];中药可调节T细胞亚群的比例,从而提高机体免疫功能,增强对肿瘤细胞的防御功能,减少复发转移风险,其机制主要是通过降低T抑制细胞水平,即在一定程度上解除机体免疫抑制状态,而并非以提高T辅助细胞为主。毒副作用方面,单纯内分泌治疗可能造成血脂升高、肝功能损害及血栓等潜在风险;而中药可在正常范围内有效降低血脂(CHOL)、肝酶(GGT)及血浆纤维蛋白原(FIB)水平,从而减轻潜在的毒副作用风险,且在降纤同时并未显著增加出血风险。
研究结果显示,治疗组与对照组间部分生化、凝血及免疫指标虽存在统计学差异(P<0.05),但均处于正常范围,故研究结果仅反映中药联合内分泌具有减少毒副作用(高脂血症、肝功能损害及血栓形成风险)及提高临床疗效(改善免疫功能)的倾向性,为临床应用提供依据的可靠性尚有待进一步提高。而单纯内分泌治疗及中药联合内分泌治疗对激素依赖型肿瘤患者性激素水平的影响,也有待进一步临床研究。今后开展此类研究时,一方面可通过增加样本量以减少误差;另一方面可通过合理设计(增设空白对照组)、严格执行(同一医疗机构、月经周期中同一时间测定等)以期得到更为客观、准确的结果。
[1]吴艾平,章永红.乳腺癌的中医药研究概况[J].临床医学,2010,23(2):542-544.
[2]Jemal A,Sieqel R,Xu J,et al.Cancer statistics[J].CA Cancer JClin,2010,60(5):277-300.
[3]陈琳,武正炎.NSABP乳腺癌临床试验的最新成果和应用前景[J].实用临床医药杂志,2006,10(2):12-17.
[4]袁彬,张灵小,李纲.乳腺癌患者应用内分泌药物治疗后合并脂肪肝的临床分析[J].现代肿瘤医学,2012,20(5):980-981.
[5]徐小玉,朱海波,王玲.内分泌治疗对乳腺癌患者骨密度影响的研究进展[J].中国骨质疏松杂志,2013,19(10):1104-1107.
[6]郭艳静,刘丽芳.中医中药治疗乳腺癌临床研究进展[J].中华中医药学刊,2012,30(8):1774-1777.
[7]石镇东,张尊祥.中医辨证论治乳腺癌经验总结[J].中医学报,2013,28(11):1610-1611.
[8]杨新明,吴绍阳,陈莉丽,等.三苯氧胺对乳腺癌围绝经期患者性激素水平的影响[J].药物与临床,2011,8(30):74-75.
[9]Ellis MJ,Suman VJ,Hoog J,et al.Randomized phaseⅡneoadjuvant comparison between letrozole,anastrozole and exemestane for postmenopausal women with estrogen receptor-rich stage 2-3 breast cancer:clinical and biomarker outcomes and predictive value of the baseline PAM50-based intrinsic subtype-ACOSOG Z1031[J].JClin Oncol,2011,29(17):2342-2349.
[10]Goss PE,Ingle JN,Pritchard KI,et al.Exemestane versus anastrozole in postmenopausal women with early breast cancer:NCIC CTG MA.27-A randomized controlled phaseⅢtrial[J].JClin Oncol,2013,31(11):1398-1404. [11]李静,陈永顺,贾晓栋,等.双氢青蒿素抗乳腺癌MDAMB-231细胞裸鼠移植瘤作用实验研究[J].安徽医药,2013,17(12):2031-2033.
[12]王辉,杜欣颖,花宝金,等.益气活血法抗乳腺癌EMT6细胞增值的荷瘤小鼠体内筛方研究[J].世界中医药,2013,8(11):1329-1332.
[13]孙峥,敖再勇,于甜甜,等.透骨草提取物通过Bcl-2和Bax蛋白诱导人乳腺癌细胞株MCF-7凋亡[J].中国药物与临床,2013,13(12):1536-1538.
[14]方呈祥,孙海燕,姜浩,等.黄荆子乙酸乙酯提取物对人乳腺癌MCF-7细胞凋亡的影响[J].中国临床药理学杂志,2013,29(11):847-849.
[15]姜英,谢鲲鹏,霍洪楠,等.木犀草素下调AEG-1和MMP-2的表达对血管生成和乳腺癌细胞侵袭性的抑制作用[J].生理学报,2013,65(5):513-518.
[16]朴丽花,蔡英兰,张默函,等.人参皂苷Rh2与PI3K/ AKT信号通路抑制剂LY294002对乳腺癌细胞转移和侵袭的影响[J].中国药房,2013,24(43):4050-4052.
[17]Deepalakshmi K,Mirunalini S,Krishnaveni M,et al.In vitro and in vivo antioxidant potentials of an ethanolic extract of Ganoderma lucidum in rat mammary carcinogenesis[J].Chinese Journal of Natural Medicines,2013,11(6):621-627.
[18]朱迪娜,王磊,王思彤,等.植物雌激素的研究进展[J].中草药,2012,43(7):1422-1429.
[19]贾华,于祥林.血清CA153、CEA和CA125水平与乳腺癌病情转归的关系分析[J].中国实验诊断学,2013,17(12):2218-2220.
[20]杨清默.血清CA153、CA125及CEA在乳腺癌诊断中的应用探讨[J].中国普通外科杂志,2011,11(11):1265-1267.
[21]邵明永,丁庆莉,高纯,等.CA125和CA153联合检测对乳腺癌的诊治价值[J].东南国防医药,2013,15(5):433-434.
[22]张孟仁.中西医结合治疗乳腺癌的优势[J].环球中医药,2012,5(12):937-939.
[23]王兵,侯炜,赵彪,等.朴炳奎教授辨治乳腺癌临床经验探析[J].环球中医药,2013,6(8):627-629.
[24]卢雯平,徐兵和,姜翠红,等.中药对中晚期三阴乳腺癌的生存影响及中医治疗策略探讨[J].世界中医药,2013,8(1):53-55.
[25]王斌,谢广茹,潘战宇,等.解毒祛瘀方联合化疗对MCF-7人乳腺癌细胞凋亡和Bcl-2/Bax表达的影响[J].中国实验方剂学杂志,2013,19(21):236-240.
[26]赵晶丽,史琳.银杏叶提取物对乳腺癌MCF-7细胞增殖、凋亡及Caspase-3表达的影响[J].中国实验方剂学杂志,2013,19(17):262-265.
Clinical study of Soothing Liver and Strengthening Spleen and Tonifying Yin Herb p lus endocrine-therapy for hormone-dependent breast cancer
MA Yelin1CHEN Liangliang2
1.Department of TCM,Zhejiang Hospital,Zhejiang Province,Hangzhou 310013,China;2.Department of Medical Oncology,Zhejiang Hospital of TCM,Zhejiang Province,Hangzhou 310006,China
Objective To explore the action of Soothing Liver and Strengthening Spleen and Tonifying Yin Herb plus endocrine-therapy and the significance in treatment of hormone-dependent breast cancer.Methods 136 patients who were treated in Zhejiang Hospital of TCM or Huzhou Maternity&Child Care Hospital from July 2010 to December 2012 were divided into 4 groups:group A(premenopausal,herbs plus endocrine-therapy,n=43),group B(premenopausal,endocrine-therapy,n=30),group C(postmenopausal,herbs plus endocrine-therapy,n=36)and group D (postmenopausal,endocrine-therapy,n=27).Data was registered and analyzed by SPSS 17.0.Resu lts CA153,CD3+/ CD8+,CHOL,GGT and FIB of group A and group C were significantly reduced,while CD4+/CD8+was improved,compared with group B and group D(P<0.05).Conclusion Herbs plus endocrine-therapy can significantly improve the clinical effects and alleviate side-effects,which isworth of promotion in clinic.
Herbs;Endocrine-therapy;Hormone-dependent breast cancer;Mechanism
R737.9
A
1673-7210(2014)08(a)-0094-06
2014-04-23本文编辑:张瑜杰)
浙江省中医药科技计划项目(编号2009CB019)。
陈良良(1957-),男,汉族,浙江杭州人,硕士,主任医师,主要从事肿瘤的中西医结合诊断及治疗等。
