依诺肝素钠原料药细菌内毒素检查方法的研究
2014-03-17张射兵陆晓和段艳冰
张射兵 陆晓和 曲 清 段艳冰,
1.南京健友生化制药股份有限公司,江苏南京210061;2.南京军区南京总医院,江苏南京210012
依诺肝素钠原料药细菌内毒素检查方法的研究
张射兵1陆晓和2曲 清1段艳冰1,2
1.南京健友生化制药股份有限公司,江苏南京210061;2.南京军区南京总医院,江苏南京210012
目的建立依诺肝素钠原料药的细菌内毒素检查方法。方法按照《中国药典》2010年版二部,确定合理的依诺肝素钠细菌内毒素限值,并研究依诺肝素钠对细菌内毒素与鲎试剂反应的干扰情况,以确定其不干扰试验浓度。结果确定依诺肝素钠的细菌内毒素限值为0.01 EU/U,使用2个厂家生产的鲎试剂试验,本品配制成3 U/mL浓度对反应均无干扰作用。结论细菌内毒素检查法可用于依诺肝素钠细菌内毒素的检查。
依诺肝素钠;细菌内毒素;干扰试验
肝素(heparin)是经猪小肠提取的黏多糖类生化药物,是临床经典的胃肠外系统应用的抗凝剂,其主要作用机制是抑制凝血X因子和通过与抗凝血酶的相互作用间接抑制凝血酶。肝素与1916年被发现,并与1973年成功地应用于临床,肝素临床上的应用是医学史上划时代意义的事件,肝素的问世也推动了临床介入工作的发展。目前肝素在临床上仍广泛地应用于血栓栓塞性疾病、体外循环、血液透析、经皮冠状动脉介入治疗等领域。但是肝素由于其分子量大,而且只能通过注射给药,会有一定比例的不良反应发生。为了克服肝素的不足,临床上有开发出一系列的低分子肝素(low-molecular-weight heparin,LMWH)品种,同肝素相比,低分子肝素具有疗效明显、半衰期长、出血不良反应发生率小等优点[1]。低分子肝素可皮下注射,不需要持续的静脉滴注,其引起血小板减少的发生率相对较低[2]。
低分子肝素是由肝素经过化学或者酶解的方法得到的分子量相对较低的肝素片段。其中依诺肝素是目前临床使用最为广泛的低分子肝素。依诺肝素钠是肝素钠的苄酯衍生物,经碱裂解而得的低分子量肝素钠盐,其平均分子量在3800~5000之间[3]。由于依诺肝素为生物源性的产品,其粗品中带有很多的生物源性的物质,而且其注射液为无菌分装产品,因此对于依诺肝素原料进行细菌内毒素的控制,十分有必要。本文参《中国药典》2010年二部附录中收载的“细菌内毒素检查法”和相关文献资料建立依诺肝素原料中细菌内毒素检查方法,并对方法可行性进行了研究。
1 仪器与试药
XW-80A型漩涡混合器(上海精科实业有限公司);TZL-5004恒温水浴锅(苏州珀西瓦尔实验设备有限公司);XS205型电子天平(瑞士Meltler公司);DHG-9240A电热鼓风干燥箱(上海一恒科学仪器有限公司);无热原吸头及封口膜(均购自江苏康华医药科技实业中心)。
依诺肝素钠:规格为原料药,南京健友生化制药股份有限公司生产,批号分别为50211202、50211203、50211301,以干燥品计抗Xa效价分别为102、101、101 U/mg。
鲎试剂(TAL):灵敏度(λ)为0.03 EU/mL,批号为0903130(湛江安度斯生物有限公司产品),批号为09110712(福州新北生化工业有限公司)。细菌内毒素工作标准品(CSE):中国药品生物制品检定所,批号为150601-200861,150 EU/支。细菌内毒素检查用水(BET用水):湛江安度斯生物有限公司产品,批号为10012210,细菌内毒素含量小于0.003 EU/mL,规格为50 mL/支。
2 方法与结果
2.1 鲎试剂(TAL)灵敏度(λ)复核试验
参照《中国药典》2010年版二部附录细菌内毒素检查法[4]相关规定进行TAL灵敏度复核试验,结果见表1。结果显示,所用的鲎试剂灵敏度均在0.5λ~2.0λ范围内,表明两个厂家TAL的灵敏度均符合规定。

表1 鲎试剂灵敏度复核试验
2.2 供试品细菌内毒素限值(L)的确定
参照《中国药典》2010年版二部附录细菌内毒素检查法项下内毒素限值的计算公式:L=K/M,式中L为供试品的细菌内毒素限值以EU/mg表示;K为按规定的给药途径,人用每公斤体重每小时的最大供试品剂量,以EU/(kg·h)表示;M为人用每千克每小时最大剂量,以mg/(kg·h)表示。依诺肝素钠应用于临床为注射剂皮下或者静脉给药,K值规定为5 EU/(kg·h);查阅依诺肝素钠注射液说明书[5]得知,人用每千克每小时的最大依诺肝素钠剂量M为150 U/(kg·h),计算其细菌内毒素限值L为0.03 EU/U。《美国药典》35版[6]规定依诺肝素原料及注射液的细菌内毒素限值均为0.01 EU/U。结合生产实际,为了严格控制产品质量,并参照国内报道的注射用细菌内毒素的限值,本试验最终拟定依诺肝素钠原料药细菌内毒素的限值为0.01 EU/U。
2.3 供试品的最小有效稀释浓度
最小有效稀释浓度C=λ/L,其中:λ为鲎试剂的灵敏度(EU/U);L为依诺肝素原料药的细菌内毒素限值(EU/mg)。本品为原料药,确定最小有效稀释倍数(MVC),当L=0.01 EU/U,取灵敏度(λ)0.03 EU/mL的鲎试剂,由公式C=λ/L计算出供试品的最小有效稀释浓度为3 U/mL。
2.4 干扰预试验[7]
取依诺肝素钠(批号:50211202、50211203、50211 301),分别精密称取适量,精密加BET用水依次制成浓度为24、12、6、3 U/mL的溶液,记为NPC系列;另制备含有2λ(0.06 EU/mL)细菌内毒素的同一样品浓度系列,记为PPC系列。用λ为0.03 EU/mL的2个厂家的TAL分别与上述NPC和PPC系列溶液进行反应[7],每个浓度重复2管,并设阴性对照(NC)和阳性对照(PC)各2管。结果见表2。由干扰预试验结果可初步了解,供试品溶液稀释至24、12、6、3 U/mL浓度时,对2个厂家的TAL与细菌内毒素的反应均不存在干扰作用。其中鲎试剂灵敏度λ=0.03 EU/mL。
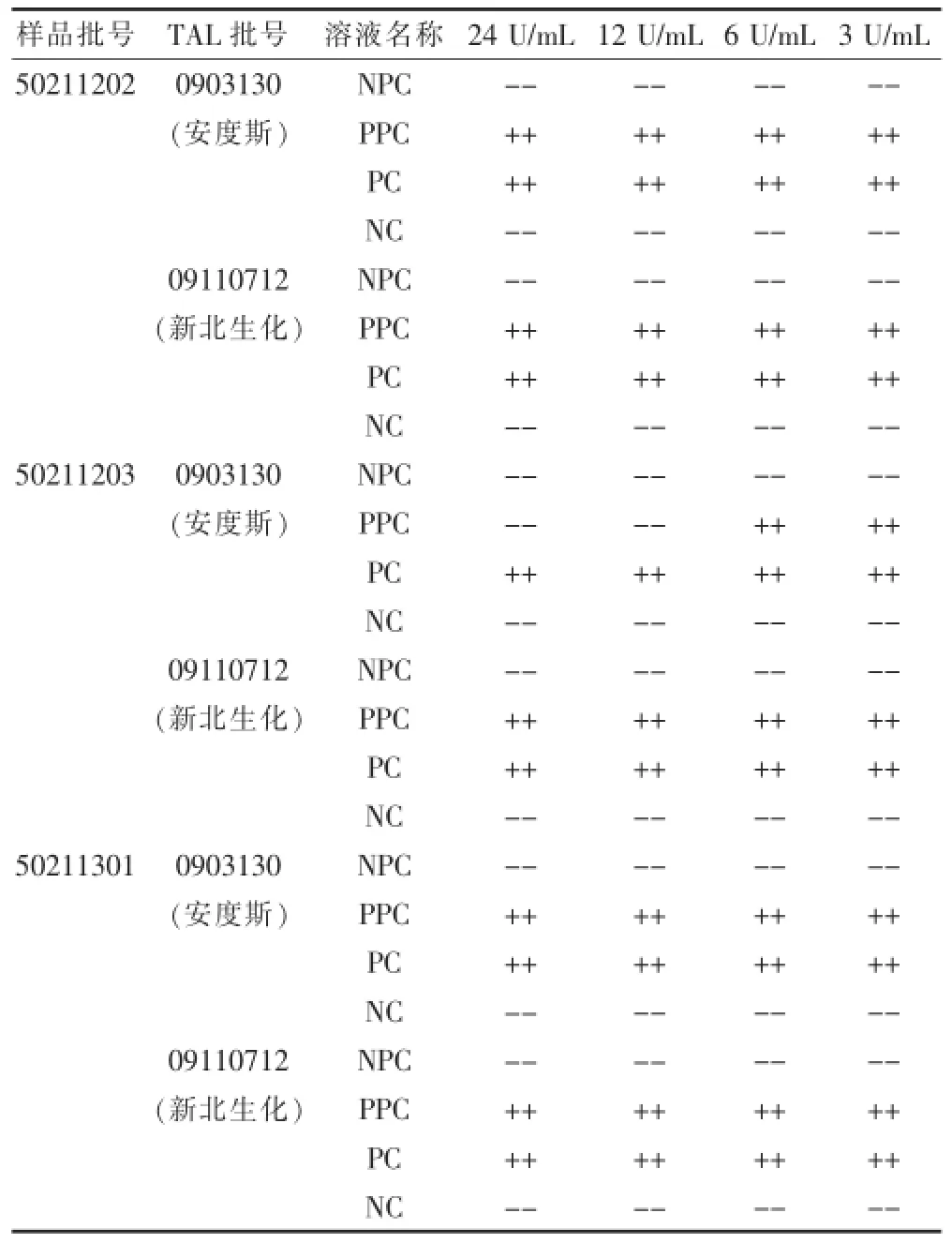
表2 干扰预试验
2.5 正式干扰试验(鲎试剂:灵敏度λ=0.03 EU/mL)
按限值L<0.01 EU/U计算,用灵敏度λ=0.03 EU/mL的鲎试剂,最小有效稀释浓度为3 U/mL。故选择3 U/mL作为供试品溶液的配制浓度。为了进一步确认供试品溶液对λ=0.03 EU/mL的鲎试剂是否存在干扰作用,分别用BET水和浓度为3 U/mL的供试品溶液进行实验,将洗净内毒素工作标准品配制成1λ、2λ、0.5λ、0.25λ浓度的系列内毒素溶液。精密称取依诺肝素钠(批号:50211202、50211203、50211301)适量,分别用BET用水制成最终浓度为3 U/mL的溶液,用该溶液和BET用水分别将CSE稀释成含内毒素0.06(2λ)、0.03(1λ)、0.015(0.5λ)、0.0075(0.25λ)EU/mL的系列溶液,用2个厂家λ为0.03 EU/mL的TAL,按《中国药典》2010年版二部细菌内毒素检查法进行干扰试验,结果见表3。
按公式E=antilg(∑X/4)计算并比较系列间的效价值(Es和Et)[8]。0.5λ≤Es(Es′)≤2λ,且0.5 Es(Es′)≤Et(Et′)≤2Es(Es′)。表明在此试验条件下,依诺肝素钠的细菌内毒素限值为0.01 EU/U,供试品在浓度为3 U/mL下不干扰细菌内毒素检测试验。

表3 干扰试验
2.6 供试品的细菌内毒素检查
将3个批号的供试品,用BET水配制成浓度为3 U/mL供试品溶液,然后用λ为0.03 EU/mL的两个厂家的TAL各8支实验。参照《中国药典》2010年版二部附录[4]进行细菌内毒素检查,均符合规定。结果见表4。

表4 干扰试验
3 讨论
依诺肝素钠为生化类抗凝药物,其起始原料为主小肠的提取物肝素,因此此类生化药物中多含有较多的蛋白等杂质,在产品生产过程中除蛋白是关键的步骤之一[9]。而依诺肝素钠制剂是预充针的无菌分装品种,制剂生产过程中往往不能再增加除热原的步骤,因此在原料中指定细菌内毒素的限量是十分必要的。为提高药品质量标准,更有效地控制药品质量,依据《中国药典》2010年版二部凡例二十二条“同一原料药用于不同制剂时,需根据临床用药要求制订相应的质量控制项目”的要求,制订该原料药的安全性检查项目是非常必需的[10]。
将依诺肝素钠原料药细菌内毒素限值定在0.01 EU/U与其注射剂限值[11]相同,这个限度可以很好地保证注射剂的生产和临床使用上的安全性。采用2个厂家的TAL对3批样品进行干扰试验及用不同厂家、不同灵敏度的TAL对3批样品进行方法学验证试验,结果表明,当样品稀释至3 U/mL浓度时对TAL与细菌内毒素的反应无干扰作用,方法学验证结果也符合细菌内毒素检查法有效性的规定。因此,依诺肝素钠原料药采用内毒素检查法(鲎试剂法)是可行的,具体检查方法:取本品,依照《中国药典》2010年版二部附录ⅪE方法[3],每单位依诺肝素钠中含内毒素的量应小于0.01 EU。因样品获取困难,本试验仅使用了1家厂家的3批样品,考虑到细菌内毒素检查法是一项复杂的酶促反应过程[12],影响因素多,如要真正将该品种的细菌内毒素检查法载入国家标准,还有待于积累更多的试验数据。该方法目前可先在厂内中间体的质量控制中予以运用。
[1]Weitz JI,Hirsh J,Samama MM.New antithrombotic drugs:American College of Chest Physicians evidence-based clinical practice guidelines(8th edition)[J].Chest,2008,133(6):234-256.
[2]黄震华.抗凝剂治疗新进展[J].中国新药与临床杂志,2012,31(2):64-68.
[3]TheEuropeanPharmacopoeiaCommission.TheEuropeanPh armacopoeia[S].7th.Strasbourg:EDQM,2008:1097.
[4]国家药典委员会.中国药典[S].二部.北京:中国医药科技出版社,2010:附录99-101.
[5]依诺肝素钠注射液说明书.Bridgewater:NJ 08807 USA.
[6]United States Pharmacopeia Commission.United States Ph armacopeia[S].30th.USA:American Pharmacopeia,2007,USP30-NF25:3040-3042.
[7]中国药品生物制品检定所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2010:310-320.
[8]张德波.布洛芬细菌内毒素检查法研究[J].中国现代应用药学,2012,3(29):261-264.
[9]李京,范慧红,徐康森.低分子肝素药用现状及质量标准概况[J].中国生化药物杂志,2004,25(1):53-55.
[10]余立,赵慧玲,陆益红,等.依诺肝素钠药学研究资料基本要求[EB/OL].国家药审中心电子刊物,http://www.cde. org.cn/d2kw.do?method=largepage&id=311935.htm. 2010-11-15.
[11]肖贵南,刘振龙,谢艳康.采用鲎试剂检查低分子量肝素钙注射液中细菌内毒素的可行性研究[J].中国药房,2006,17(11):856-858.
[12]许雷鸣,武谷,顾倩.门冬氨酸鸟氨酸注射液细菌内毒素检查法的研究[J].中国医药导报,2013,10(6):100-102.
Study on bacterial endotoxiin test method for Enoxaparin Sodium
ZHANG Shebing1LU Xiaohe2QU Qing1DUAN Yanbing1,2
1.Nanjing King-friend Biochemical Pharmaceutical Co.,LTD.,Jiangsu Province,Nanjing210061,China;2.Nanjing General Hospital of Nanjing Military Command of PLA,Jiangsu Province,Nanjing210012,China
ObjectiveTo establish a method of examining bacterial endotoxin for Enoxapain sodium.MethodsThe reasonable limit of endotoxin was determined by using Chinese Pharmacopoeia(2010 edition,2 volume),and study on testing for bacterial endotoxin to determine the noninterference concentration for Enoxaparin Sodium.ResultsThe most suitable limit of bacterial endotoxin in preparation for Enoxaparin Sodium was 0.01 EU/U and the TAL of two manufacturers was used to test,and it was proved that the best noninterference concentration was 3 U/mL.ConclusionIt is showed that,the method is suitable for the Enoxaparin Sodium of bacterial endotoxin test.
Enoxaparin Sodium;Bacterial endotoxin test;Interference test
R331
A
1673-7210(2014)04(c)-0092-04
2013-11-14本文编辑:卫轲)
江苏省科技成果转化专项资金项目(编号BA20 12033)。
张射兵(1985-),男,江苏盐城人,南京中医药大学2009级药学专业在读硕士研究生;研究方向:化药研究和药品注册工作。
段艳冰(1978-),男,博士,副主任药师;研究方向:创新药的研究和管理工作。
