吉布斯吸附等温式的应用—电解质溶液活度测定新方法
2014-03-17陈辉煌陈启元刘常青张平民胡久刚
陈辉煌,陈启元,刘常青,张平民,胡久刚
(中南大学 化学化工学院 有色金属资源化学教育部重点实验室,长沙 410083)
电解质溶液热力学是溶液理论的一个重要组成部分,在化工、冶金、地质、生物、环境和能源等领域具有广泛应用[1]。电解质溶液活度因子是溶液热力学研究的重要参数,它集中反映了指定溶剂中离子之间及离子与溶剂分子之间的相互作用,对离子溶剂化、离子缔合及溶液结构理论的研究具有重要意义。活度因子可通过理论计算和实验测定得到。活度因子理论计算模型有 Debye-Hückel、Bromley、Pitzer和 Chen等模型[2]。实验测定方法主要电导法、电动势法、凝固点降低法、等压法、溶解度法和扩散法和电动势法[3],其中较常采用的是等压法和电动势法,这两种方法均能获得精确的活度因子。等压法具有适应性广、灵活性大、数据可靠等特点而被广泛采用,但繁琐耗时、难以准确测定浓度小于0.1 mol/kg H2O的溶液;电动势法通常采用逐点称取质量配置溶液来改变电解质的浓度,需要消耗大量的测量时间[4],另外,电动势法一般要求组成的电池中无液体接界电势差存在,不易选择适合测量体系的参比电极,从而限制了电动势法的扩展应用[5]。
界面化学是研究物质在多相体系中表面(界面)的特征和表面发生的物理化学过程及其规律的学科,界面行为与自然界中发生的绝大部分过程有关。Gibbs基于化学热力学原理推导得出的Gibbs吸附等温式在表面科学理论中占有重要地位,方程式如下

式中:Γ、aB、σ和T分别表示吸附量、活度、表面张力和温度;R表示摩尔气体常量。
从式(1)可以看出,恒温下吸附量与活度和表面张力有关,而活度和表面张力均与浓度有关,因此可以应用Gibbs吸附等温式,依据溶液表面张力和浓度的实验测定数据求算其活度,从而建立一种测算溶液活度的新方法。相比等压法和电动势法,利用Gibbs吸附等温式通过表面张力数据测算电解质溶液活度的方法更为简便、易于操作。目前,尚无关于表面张力法求算活度因子的文献报道。
1 理论推导
通过变换Gibbs吸附等温方程式可得

根据溶液表面吸附理论可得到溶液表面吸附经验公式为

式中:k1和k2为参数。
将式(3)代入式(2)可以得微分方程式:

对于某一确定的体系,当温度一定时,对式⑷求不定积分可得

式中:C为积分常数,其值为溶质活度为零时纯溶剂的表面张力,对于以水为溶剂的体系,C=72.14 mN/m[6]。若令 K1=-(k1RT/k2),K2=k2,式(5)可改写为

式中:K1、K2是利用Gibbs吸附公式和溶液表面经验吸附公式推导得出的参数,与体系性质和温度有关。
众多学者先后提出计算活度因子的理论公式、半理论半经验公式和经验公式,这些计算公式大大扩展了原有活度因子计算公式的浓度、温度、压强和电解质种类适用范围[7-12]。本文作者在前人电解质溶液活度研究工作的基础上提出了一个含5个待定参数的活度因子半经验公式,即

式中:γ±和b分别为离子平均活度因子和平均质量摩尔浓度;A、B、C、D、E为待拟合参数。
式(7)右边第一项为Debye-Hückel扩展项,体现了静电作用,其值为负表明该项以吸引力为主;后面的多项体现了离子水化作用和溶剂化作用对离子间相互作用的影响以及溶液浓度对溶剂相对介电常数的影响。离子平均活度与离子平均活度因子的关系为

联立式(6)~(8)便可以得到求算活度因子半经验公式待定参数的数学模型
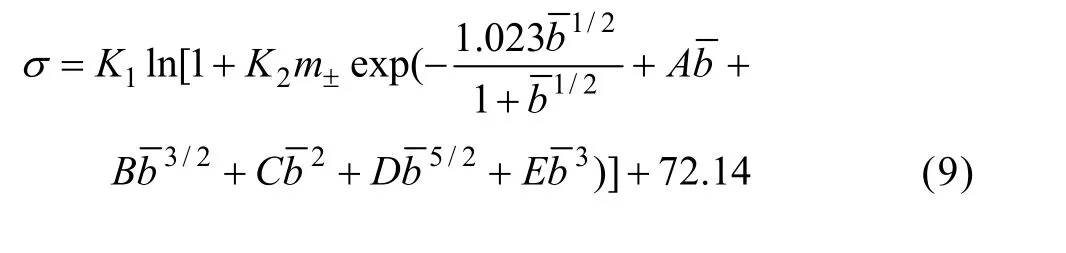
2 实验
2.1 试剂和设备
六水合氯化钴和乙二胺四乙酸二钠均为分析纯(国药集团化学试剂有限公司),实验用水均为二次蒸馏水。精密数字压力计为DP-A型(南京桑力电子设备厂生产,精度为±1 Pa),恒温水浴系统为TE-10D型(英国TECHNE公司生产,精度为±0.05 K),电子天平为PB-203N 型(Mettle-Tolede Group生产,精度为±1 mg)。
2.2 实验方法
配置 12组不同浓度的氯化钴水溶液,参照文献[13]的方法准确测定氯化钴溶液的体积摩尔浓度c(mol/L3),通过计量单位转换和计算得到了与氯化钴体积摩尔浓度对应的质量摩尔浓度b(mol/kg)和离子平均质量摩尔浓度b(mol/kg)。
表面张力实验测定前先将带支管试管和毛细管用高锰酸钾洗液清洗干净,以防止表面活性剂等有机物质对表面张力的实验测定带来影响,再依次用二次蒸馏水冲洗干净,烘干后按实验装置图组装仪器,如图1所示。调节和控制恒温水浴的温度为25 ℃,并检查测试系统是否漏气,一切符合要求后进行实验测试。
实验测定时控制每个气泡从毛细管尖端逸出时间在5~25 s之间,记录每次鼓气泡所需要的最大压差。每个气泡逸出速度下记录的压力计最大压差记为一组,每组至少读取20个数据,计算用最大气泡压力差为多个数据的平均值;调节气泡逸出速度,每一浓度下反复测定3组实验数据,测定时按照浓度从低到高的顺序依次进行。
最大气泡压力法测定溶液表面张力的公式为

式中:r和Δp分别为毛细管半径(仪器常数)和气泡最大内外压差。测定毛细管半径的方法如下:按照上述实验方法记录在常温、常压下测定纯水时压力计显示的鼓气泡所需要的最大内外压差,根据此条件下纯水的表面张力数据由式(10)即可计算出毛细管半径。利用实验测得的最大内外压差便可由式(10)计算出不同浓度氯化钴水溶液的表面张力。

图1 氯化钠水溶液表面张力测定实验装置示意图Fig. 1 Schematic diagram of experimental set-up for measuring surface tension of cobalt chloride aqueous solution
3 结果与分析
3.1 氯化钴水溶液体系的表面张力
用上述实验方法测定了298.15 K、常压条件下不同离子强度的氯化钴水溶液体系的表面张力,实验数据见表1。
众所周知,一定温度下体系的表面张力与物质浓度有关,但目前尚没有表面张力与浓度的理论关系模型。本文作者利用表1数据绘制出氯化钴水溶液在常温常压下表面张力与离子平均质量摩尔浓度关系图,如图2所示。鉴于图形在低浓度线性上升、高浓度凹型上升的特点,采用三次多项式对表面张力与离子平均质量摩尔浓度关系进行拟合,当浓度为零时固定表面张力值为常温常压下纯水的表面张力值,拟合得到的表面张力与浓度的经验公式为式(11)(R2=0.99999),拟合结果较好。

表1 不同浓度下氯化钴水溶液表面张力Table 1 Surface tension of cobalt chloride aqueous solutions at different concentrations
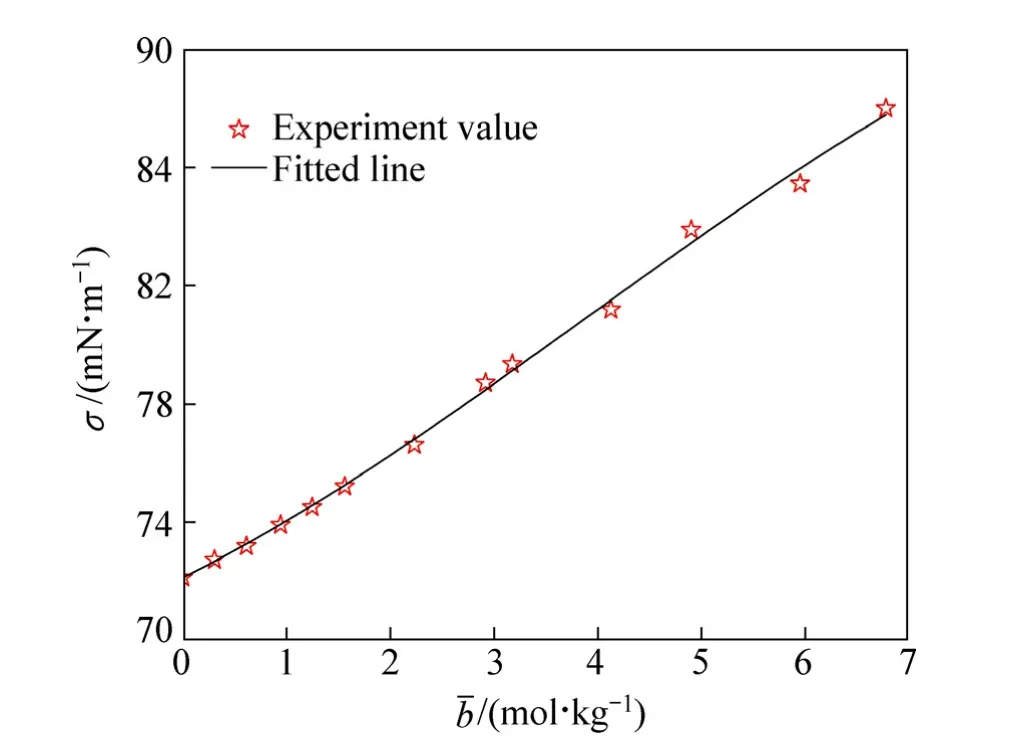
图 2 氯化钴水溶液表面张力与离子平均质量摩尔浓度的关系Fig. 2 Relationship between surface tension and mean molality of ions of cobalt chloride aqueous solutions
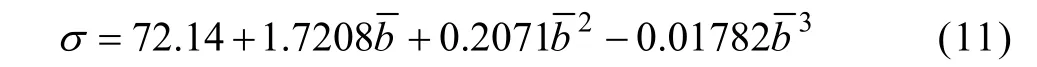
从图2可以看出,氯化钴水溶液表面张力大于纯水表面张力,这是由于静电力、离子水化、色散力和溶剂浓度综合作用的结果,其作用大小取决于溶液中阴、阳离子的种类和浓度[14-15]。
图2中低浓度区(0~1.4 mol/kg)的表面张力与浓度呈线性关系,表明此范围内浓度对表面张力的升高贡献具有一致性;浓度继续升高,图形呈凹型上升趋势,原因可能是高浓度时溶剂水不能再看作具有恒定介电常数的连续介质。另外随着浓度增大,物质间静电作用力增强,离子与极性水分子发生强烈作用,使离子水化形成复杂的水化离子簇,进而改变了溶液界面组成,最终导致表面张力的增长不再与浓度呈线性关系。
3.2 活度因子半经验公式参数的求算
从理论分析与比较可知,式(6)和式(9)在本质上是相同的,都是表示表面张力与活度的关系;式(9)和式(11)在数学表达式上虽然差异很大,但函数关系中的变量(表面张力、离子平均质量摩尔浓度)及其相应的数值是完全相同的。因此, 以式(9)为基础,利用实验数据,采用Origin 8.5软件可以回归得到活度因子计算新模型中的待定系数,即K1、K2和A、B、C、D、E两组参数,拟合结果列于表2。

表2 方程(9)的拟合结果Table 2 Fitting results of Eq. (9)
ROBINSON等[16]使用等压法测定了 298.15 K、0.1~4.0 mol/kg氯化钴水溶液的活度因子(本文作者以其实测值为标准值,以本研究中活度因子计算模型计算值作为待比较数据);KIM 等[17]根据相关文献数据回归得到了氯化钴水溶液的Pitzer方程的离子相互作用参数,利用此相互作用参数计算得到相应浓度下的氯化钴水溶液的活度因子,也将此计算结果作为待比较数据。两组待比较数据的标准偏差(SD)分别为0.0632和0.0406。不同浓度下氯化钴水溶液的活度因子见表3,令氯化钴水溶液浓度为0时溶液的活度因子为1,绘制的活度因子与浓度关系图如图3所示。由标准偏差和图3可以看出,在整个浓度范围内采用新方法和新模型计算所获得活度因子具有较高的准确性,特别在1.4~3.0 mol/kg浓度范围内,新方法和新模型活度因子计算值比Pitzer模型计算值更接近实验测定值,因此可以通过采用此方法简便快速地测算氯化钴水溶液的活度。
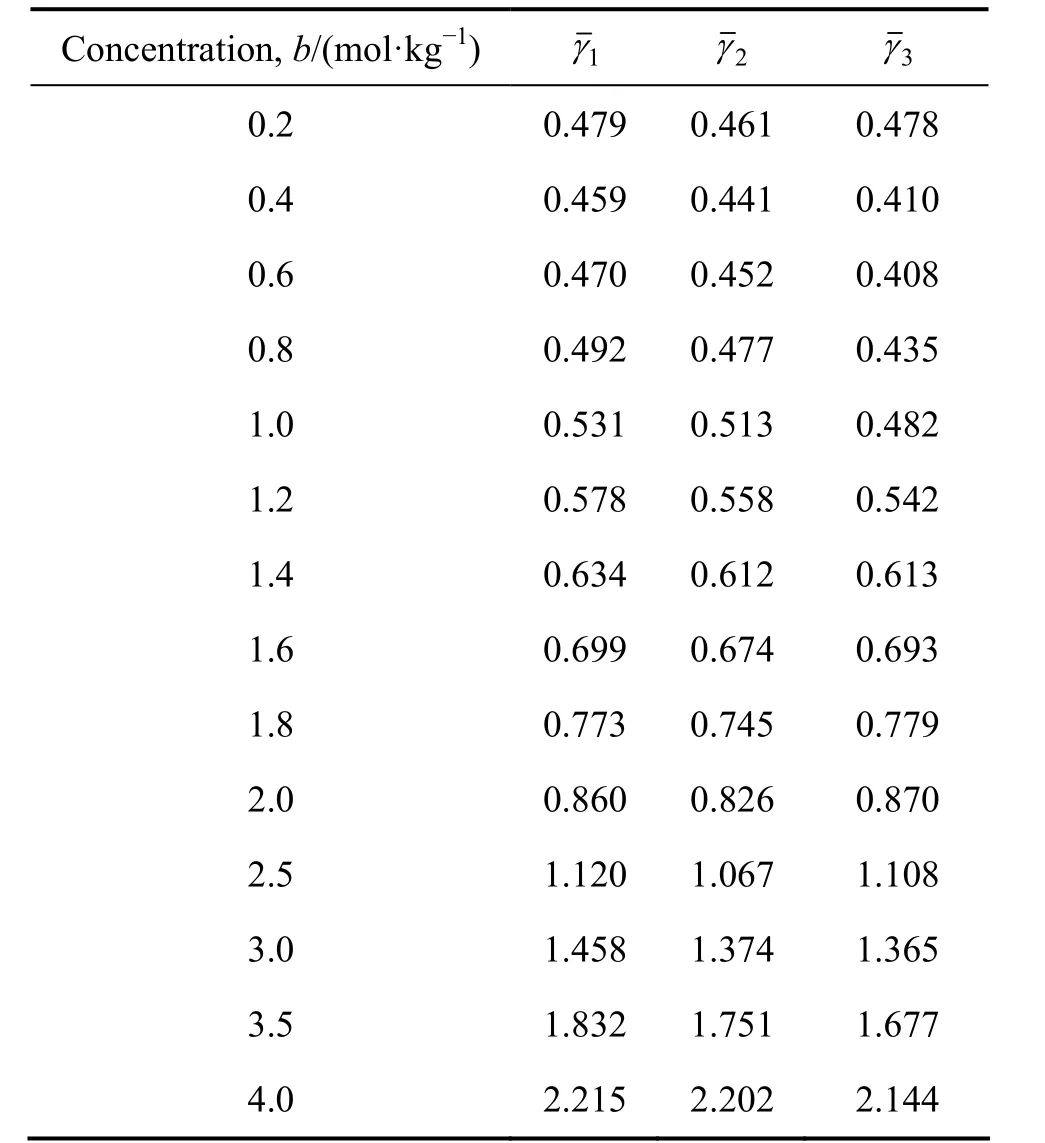
表3 氯化钴水溶液活度因子文献值与计算值Table 3 Literature values[16] and calculated activity coefficients of cobalt chloride aqueous solutions
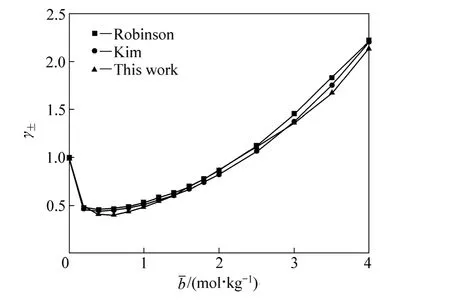
图3 氯化钴水溶液活度因子与质量摩尔浓度的关系Fig. 3 Relationship between activity coefficients and molality of cobalt chloride aqueous solutions
4 结论
1) 采用最大气泡压力法测定了298.15 K、常压、离子强度0.57~12.81 mol/kg的氯化钴水溶液的表面张力,研究表面张力与浓度的关系,求得表面张力与浓度的经验公式。
2) 基于Gibbs吸附等温式,利用气液界面经验吸附公式,推导出表面张力与活度的关系式,并在此基础上建立计算溶液活度因子的新模型。
3) 基于表面张力和活度关系式、活度与活度因子关系式和活度因子计算新模型,利用实验数据回归得到了新模型的待定参数数值。通过比较分析可知,本研究的活度因子计算新模型具有较高的精度,采用此模型测定电解质水溶液表面张力的方法测算其活度是可行的。
[1] ZEMAITIS Jr J F, CLARK D M, RAFAL M, SCRIVNER N C.Handbook of aqueous electrolyte thermodynamics: Theory &application[M]. New York: John Wiley & Sons, 1986.
[2] 李以圭, 陆九芳. 电解质溶液理论[M]. 北京: 清华大学, 2005.LI Yi-gui, LU Jiu-fang. Theory of electrolyte solutions[M].Beijing: Tsinghua University, 2005.
[3] 王卫东. 电解质溶液活度系数的测定方法[J]. 湖北师范学院学报: 自然科学版, 2005, 25(1): 104-106.WANG Wei-dong. Measurement methods of activity coefficients of electrolyte solution[J]. Journal of Hubei Normal University: Natural Science, 2005, 25(1): 104-106.
[4] 裘 端. 电解质水溶液相平衡的热力学研究[D]. 天津: 河北工业大学, 2002.QIU Rui. Thermodynamics research on phase equilibrium of electrolyte aqueous solution[D]. Tianjin: Hebei University of Technology, 2002.
[5] 阎秉峰. 离子选择性电极的工作原理[J]. 内蒙古科技与经济,2005, 3: 106-109.YAN Bing-feng. Operating principle of ion selective electrode(ISE)[J]. Inner Mongolia Science & Technology and Economy,2005, 3: 106-109.
[6] SPEIGHT J G. Lange’s handbook of chemistry[M]. New York:McGraw-Hill, 2005.
[7] GE X, WANG X, ZHANG M, SEETHARAMAN S. Correlation and prediction of activity and osmotic coefficients of aqueous electrolytes at 298.15 K by the modified TCPC model[J]. Journal of Chemical & Engineering Data, 2007, 52(2): 538-547.
[8] PITZER K S. Thermodynamics of electrolytes. Ⅰ. Theoretical basis and general equations[J]. The Journal of Physical Chemistry, 1973, 77(2): 268-277.
[9] BROMLEY L A. Thermodynamic properties of strong electrolytes in aqueous solutions[J]. AIChE Journal, 1973, 19(2):313-320.
[10] 彭小奇, 宋国辉, 宋彦坡, 张建智, 刘振国.NaOH-NaAl(OH)4-Na2CO3-H2O 体系活度因子的计算模型[J].中国有色金属学报, 2009, 19(7): 1332-1337.PENG Xiao-qi, SONG Guo-hui, SONG Yan-po, ZHANG Jian-zhi, LIU Zhen-guo. Calculation model of activity coefficient for NaOH-NaAl(OH)4-Na2CO3-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(7): 1332-1337.[11] CHEN C C, BRITT H I, BOSTION J F, EVANS L B. Local composition model for excess Gibbs energy of electrolyte systems. Part I: Single solvent, single completely dissociated electrolyte systems[J]. AIChE Journal, 1982, 28(4): 588-596.
[12] HOVARTH A L. Handbook of aqueous electrolyte solutions:physical properties, estimation, and correlation methods[J]. New York: Ellis Horwood, 1985.
[13] GB/T 1270-1996. 化学试剂六水合氯化钴(氯化钴)[S].GB/T 1270-1996. Chemical reagent cobalt chloride hexahydrate(cobalt chloride)[S].
[14] BOSTROM M, KUNZ W, NINHAM B W. Hofmeister effects in surface tension of aqueous electrolyte solution[J]. Langmuir,2005, 21(6): 2619-2623.
[15] 欧阳跃军. 无机盐溶液表面张力的影响研究[J]. 中国科技信息, 2009(22): 42-43.OUYANG Yue-jun. Study on effect of surface tension of the inorganic saline solution[J]. China Science and Technology Information, 2009(22): 42-43.
[16] ROBINSON R A, BROWN J B. The constitution of cobalt chloride in aqueous solution[J]. Transaction of the Royal Society of New Zealand, 1948, 49(77): 1-9.
[17] KIM H T, FREDERICK W J Jr. Evaluation of Pitzer ion interaction parameters of aqueous electrolytes at 25 ℃ .1. Single salt parameters[J]. Journal of Chemical and Engineering Data,1988, 33(2): 177-184.
