脾气虚证大鼠小肠兴奋性肠神经的形态学变化
2014-03-17谢明征齐清会
马 宾,谢明征,李 禄,齐清会
实验研究
脾气虚证大鼠小肠兴奋性肠神经的形态学变化
马 宾,谢明征,李 禄,齐清会
目的:观察脾气虚证大鼠小肠兴奋性神经乙酰胆碱神经和P物质神经的形态学变化。方法:清洁级成年Wistar大鼠40只,随机分为2组,脾气虚组用体质筛选、苦寒泻下和耗气破气相结合方法。建立大鼠模型,取存活大鼠上段小肠制作肠肌层全厚标本,利用免疫荧光方法标记乙酰胆碱神经和P物质神经兴奋性神经纤维,用激光扫描共聚焦显微镜检测、分析。结果:与对照组相比,脾气虚组大鼠小肠P物质、乙酰胆碱神经纤维数量明显减少(P<0.05),荧光强度值明显降低(P<0.05),神经结构紊乱,相互间的连接不连续,完整的网络状结构被破坏。结论:脾气虚时大鼠小肠运动功能障碍的发生可能与兴奋性神经纤维的减少密切相关。
脾气虚证;乙酰胆碱神经;P物质神经;胃肠运动障碍
脾气不足的症候主要表现为纳少腹胀、便溏、胃肠运动功能障碍,改善消化道运动功能是纠正其功能损害最初和最重要的步骤。兴奋性肠神经相互间彼此连接形成网络状结构,广泛分布在胃肠道肌层,与胃肠运动密切相关。本研究旨在以脾气虚大鼠模型为研究对象,观察脾气虚大鼠小肠乙酰胆碱和P物质神经纤维的形态学变化,探讨脾气虚证致胃肠运动障碍的产生机制。
1 材料和方法
1.1 仪器 TCS-SP5Ⅱ激光扫描共聚焦显微镜(LEICA,GERMANY),Image-Pro Plus 6.0图象分析软件(Media Cybernetics,USA)。
1.2 试剂 山羊抗大鼠VAChT多克隆抗体(Santa cruz,Biotech,USA),山羊抗大鼠SP多克隆抗体(Santa cruz,Biotech,USA),FITC-驴抗山羊IgG抗体(vector,USA),Triton X-100(Amresco,USA),牛血清白蛋白(BSA)(sigma,USA)。
1.3 方法 选取清洁级成年Wistar大鼠40只,雌雄各半,体质量180~220 g。由大连医科大学动物实验中心提供,合格证号:SCXK(辽)2008-0002。随机分为对照组和脾气虚组各20只。
1.3.1 建立脾气虚模型 参考陈小野[1]的方法,用体质筛选、苦寒泻下和耗气破气相结合方法,建立脾气虚证大鼠动物模型。采用游泳时间法测定体质,游泳时间短者(体质弱者)用于实验。筛选剩余15只。选用:⑴生大黄、厚朴、枳实(2∶1∶1)制成200%浓度煎剂;⑵广豆根、旋覆花、槟榔(3∶1∶1)制成250%浓度煎剂。脾气虚造模用药购自大连同仁堂。⑴和⑵交替灌胃,造模期的前18 d,3次/d,造模期的后12 d,4次/d。造模时间为30 d。动物表现出精神萎糜,倦愈懒动,拱背清瘦,乏力畏寒,毛色无光或行走歪斜,腹泻,体重下降等表现,说明脾气虚证造模成功。对照组灌服生理盐水30 d。取存活大鼠上段小肠制作小肠肌层全厚标本。
1.3.2 小肠肌层全厚标本的制备 造模成功后,取脾气虚组、对照组大鼠予脱颈处死,迅速取出距幽门10 cm的上段小肠置于4℃PBS液中。沿小肠系膜剖开肠管,取出肠内容物,PBS液冲洗后将小肠切成1 cm长短,置于4%多聚甲醛中固定,4℃冰箱内存放过夜。在解剖显微镜下,剥离黏膜和黏膜下层,制作小肠肌层全厚标本[2]。
1.3.3 免疫荧光标记 参照Axel Brehmer等[3]的方法,进行免疫荧光染色:⑴将标本置于0.5%TritonX-100的0.05 M Tris-HCL缓冲液(pH7.6)中,37℃下孵育4 h;⑵0.01M PBS漂洗3次,滴加1% BSA,室温下孵育1 h,封闭非特异性抗体;⑶弃去BSA,0.01M PBS漂洗,分别滴加山羊抗大鼠VAChT多克隆抗体,山羊抗大鼠SP多克隆抗体,4℃孵育48 h;⑷0.01M PBS漂洗后,分别滴加FITC-驴抗山羊IgG抗体,室温下避光孵育2 h;⑸0.01M PBS漂洗,将标本置于0.1%多聚赖氨酸包被的载玻片上,荧光封片剂封片后用于激光扫描共聚焦显微镜观测。对照组在步骤⑶中不添加一抗,只用抗体稀释液,余操作步骤同上。
1.4 激光扫描共聚焦显微镜观测 进行囊泡装乙酰胆碱转运体(VAChT)抗体、P物质(SP)抗体免疫荧光标记。利用LEICA TCS-SP5Ⅱ激光扫描共聚焦显微镜观测结果并采集图像,以适于FITC(484 nm)的激发波长观测并采集图像。VAChT、SP阳性荧光为绿色。全部标本用于检测,每一标本随机选取2个高倍视野,用Image-Pro Plus 6.0进行半定量分析。
1.5 数据处理 采用SPSS13.0软件对数据进行统计学处理,计量资料均采用(±s)表示,采用Student t检验。以P<0.05表示有显著差异。
2 结果
2.1 胃肠大体标本肉眼所见 对照组:大鼠胃肠形态正常,肠管呈粉红色,胃肠蠕动正常。脾气虚组:胃肠扩张,浆膜充血肿胀,腹腔内见渗出液,胃肠蠕动明显减弱。
2.2 激光扫描共聚焦显微镜检测
2.2.1 小肠肌层乙酰胆碱神经的变化 对照组:乙酰胆碱神经纤维在肌层间分布连续,密度均匀,彼此相接形成网状结构,形态规整,结构完整。脾气虚组:较之于对照组,乙酰胆碱神经纤维数量明显减少(P<0.05),分布稀疏,密度不均,彼此间的连接减少,乙酰胆碱神经结构受到损坏,荧光IOD值明显降低(P<0.05)。见表1,图1。
表1 大鼠小肠肌层乙酰胆碱(ACh)神经纤维表达分析±s)
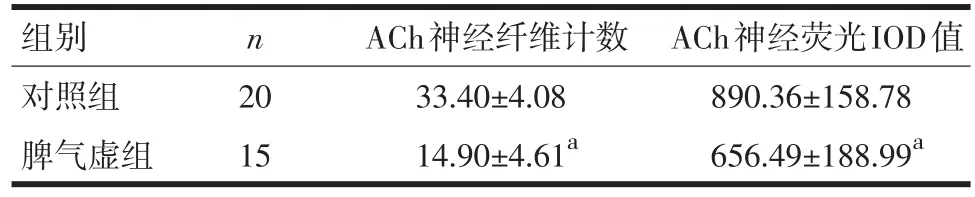
表1 大鼠小肠肌层乙酰胆碱(ACh)神经纤维表达分析±s)
注:与对照组比较,aP<0.05
组别对照组脾气虚组n 20 15 ACh神经纤维计数33.40±4.08 14.90±4.61aACh神经荧光IOD值890.36±158.78 656.49±188.99a
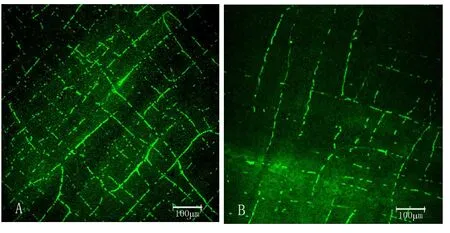
图1 两组大鼠小肠肌层ACh神经的密度
2.2.2 小肠肌层SP神经的变化 对照组:SP神经纤维在肌层间形态规整,分布连续,密度均匀,彼此相接形成网状结构。脾气虚组:SP神经纤维数量明显减少(P<0.05),彼此间的连接明显减少,SP神经网结构受到明显损坏,荧光IOD值明显降低(P<0.05)。见表2,图2。
3 讨论
脾气虚证时脾气不足,运化水谷精微功能减弱,临床以腹胀、便溏、疲乏为主要表现。常见于泄泻、胃脘痛、腹痛、脘腹胀满,食后为甚,口不知味,甚至不思饮食,大便溏薄,精神不振,形体消瘦,肢体倦怠。脾主运化,脾气主升,故脾气虚证以食欲不振,腹胀便溏为特点。中西医结合临床观察结果显示,脾气虚患者存在明显的胃肠运动功能障碍。
肠神经系统(enteric nervous system,ENS)主要是通过兴奋性和抑制性神经元调节胃肠道平滑肌的运动。功能性胃肠动力障碍病,与兴奋性胃肠神经系统密切相关。兴奋性胃肠运动神经肽等经典递质,一起调控胃肠运动的收缩与舒张,对胃肠道运动功能也起到重要作用[4]。兴奋性胃肠神经系统由存在于胃肠壁内的神经节、神经丛网络和神经递质共同组成。兴奋性神经的细胞体散布在黏膜下和肌间神经丛中,神经末梢支配胃肠纵肌和环肌,或与神经丛内其他神经元形成突触联系。所释放的神经递质,激动平滑肌上的神经受体,引起胃肠肌兴奋效应,参与胃肠蠕动反射。兴奋性肠神经递质包括乙酰胆碱(acetylcholine,ACh),P物质(substance P,SP)等[4]。有研究显示,胆碱能神经是ENS中数量最多的[5],主要分布在肠肌层,有刺激胃肠道的蠕动和吸收功能。SP神经则存在于肌层神经丛,其突触延伸至胃肠壁各层。SP神经也可以促进胃肠道蠕动。ENS神经元及神经纤维在消化道全程壁内广泛分布[6]。
表2 大鼠小肠肌层SP神经纤维表达分析(±s)

表2 大鼠小肠肌层SP神经纤维表达分析(±s)
注:与对照组比较,aP<0.05
组别对照组脾气虚组n 20 15 SP神经纤维计数24.50±2.42 14.40±2.22aSP神经荧光IOD值911.05±354.04 314.82±101.48a
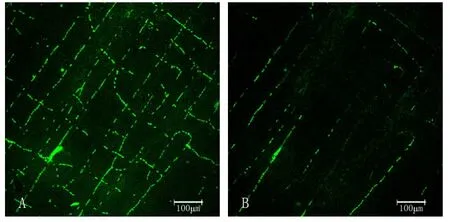
图2 大鼠小肠肌层SP神经的密度
为进一步探讨脾气虚证胃肠运动功能障碍的机制,我们进行免疫荧光兴奋性肠神经乙酰胆碱神经和P物质神经纤维染色,共聚焦显微镜下观测形态学变化。结果显示,对照组大鼠小肠兴奋性肠神经形态完整,结构连续,分布均匀,网络样结构明显。脾气虚证大鼠小肠兴奋性神经结构受到损伤,数量减少,彼此间连接减少,密度不均,肠神经网络遭到明显破坏。肠道高度扩张,小肠蠕动显著减弱,加重小肠功能障碍。本研究提示,脾气虚证可破坏兴奋性肠神经网络结构的完整性。兴奋性神经的传导通路的损伤导致兴奋性动力不足,胃肠道平滑肌松弛,收缩性下降,蠕动减弱,从而导致胃肠运动功能障碍[7]。
脾气虚证胃肠动力障碍对兴奋性运动神经损伤的具体病理生理改变尚不完全清楚,另外,其他肠神经及介质等在胃肠动力学中的确切作用及机制还需要继续深入研究。
[1]陈小野.脾气虚证动物模型初步规范化的造模方法和思路[J].中国中医基础医学杂志,2003,9:3-5.
[2]Iino S,Hotiguchi K,and Nojyo Y.Interstitial cells of Cajal are innervated by nitrergic nerves and express nitric oxide-sensitive guanylate cyclase in the guinea-pig gastrointestinal tract[J].Neuroscience,2008,152(2):437-448.
[3]Brehmer A,Rupprecht H,Neuhuber W.Two submucosal nerve plexus in human intestines[J].Histochem Cell Biol,2010,133(2): 149-161.
[4]Mitolo-Chieppa D,Mansi G,Rinaldi R,et al.Cholinergic stimulation and nonadrenergic,noncholinergic relaxation of human colonic circular muscle in idiopathic chronic constipation[J].Dig Dis Sci,1998,43(12):2719-2726.
[5]Porter AJ,Wattchow DA,Brookes SJ,et al.Cholinergic and nitrergic interneurones in the myenteric plexus of the human colon[J]. Gut,2002,51(1):70-75.
[6]Laranjeira C,Pachnis V.Enteric nervous system development:recent progress and future challenges[J].Autou Neurousci,2009, 151:61-69.
[7]刘凯,齐清会.脾气虚证平滑肌细胞的胃动素信号传导障碍[J].中国中西医结合外科杂志,2004,10(4):300-302.
(收稿:2013-12-16 修回:2014-04-12)
(责任编辑 王 丰 屈振亮)
Morphological Changes of Excitatory Enteric Nerve System in Rats with Deficiency of Spleen-Qi Syn-drome Decoction
MA Bin,XIE Ming-zheng,LI Lu,et al. The First Affiliated Hospital of Dalian Medical University,Dalian(116011),China
ObjectiveTo observe the morphological changes of fibers of acetyl choline and P substance (excitatory enteric nerve)fibers in rats with deficiency of Spleen-Qi syndrome(DSQS).MethodsForty Wistar rats were randomly divided into control group and DSQS group.The morphological changes of the excitatory enteric nerve fibers were observed by using immunohistochemical staining with whole-amount preparation technique and confocal laser scanning microscopy.ResultsThe feature of the excitatory enteric nerve fibers in control group was normal.The fluorescence of the excitatory enteric nerve fibers was distributed continuously. Compared with those in control group,the distributions and IOD of excitatory enteric nerve fibers in DSQS group were significantly decreased(P<0.05).The network of the excitatory enteric nerve fibers was significantly disrupted.ConclusionThe mechanism of intestinal motility dysfunction in rats in DSQS group may be closely related to the decrease of excitatory enteric nerves.
Syndrome of deficiency of spleen-qi;acetyl choline nerve;substance-P nerve;gastrointestinal motility dysfunction
Q95-33;R656.6
A
1007-6948(2014)03-0267-03
10.3969/j.issn.1007-6948.2014.03.015
国家自然科学基金资助项目(81273920)
大连医科大学附属第一医院腹部急症一科(大连 116023)
齐清会,E-mail:qiqh@medmail.com.cn
