天然斜发沸石吸附特性与改性吸附研究
2014-03-16许冉冉张新颖
许冉冉,张新颖,李 杰
(福州大学环境与资源学院,福建福州 350108)
沸石是含水多孔性碱或碱土金属硅铝酸盐矿物的总称[1],其主要晶体构造为硅氧四面体,其中部分Si4+被Al3+替代而导致负电荷过剩,因此,结构中有碱金属(或碱土金属)等平衡电荷的离子。同时沸石构架中有一定孔径的空腔和孔道,使其具有离子交换和吸附等性质[2,3]。
天然沸石具有较高的含水量和硅铝比,同时含有杂质颗粒,使其阳离子交换容量偏低,限制了其开发利用,而人工合成分子筛虽然纯度高,但成本也高。因此,近年来国内外许多学者对天然沸石进行改性,并取得了较好的效果[4-6]。目前最常用的沸石改性方法是离子交换改性法[7],可将天然沸石转变成单一阳离子形式,同时疏通孔道,有助于离子交换量的提高。
本研究以天然斜发沸石粉末为研究对象,针对等温吸附过程和吸附动力学试验过程中的和金属阳离子浓度变化进行监测,通过定量分析来明确沸石物理吸附和离子交换在氨氮去除过程中的作用[8]。采用阳离子交换改性法,分别用NaCl、KCl、CaCl2对沸石进行浸泡改性,对吸附效果及改性沸石的元素组成、比表面积、表面形貌进行研究,确定最佳的改性方法及盐改性机理。通过吸附与改性研究,为沸石粉在含氨氮废水处理中的应用提供理论依据。
1 试验材料与方法
1.1 试验材料
试验所用斜发沸石来自浙江省缙云神石矿业有限公司,粒径为200目,试验药品NH4Cl、NaCl、KCl、CaCl2均为分析纯。试验用水:含废水(配水,在超纯水中加入NH4Cl配制而成)。
主要仪器与设备:HJ-6型磁力搅拌器、S4 EXPLORER型X射线荧光光谱仪(XRF)、Mastersizer 3000型激光衍射粒度分析仪、Optima 7000DV电感耦合等离子体发射光谱仪(ICP-OES)、BK122/BK112型比表面及粒径分析仪等。
1.2 试验方法
(1)等温吸附试验:采用去离子水配置浓度(以N 计)为 100、200、300、400、500、600、700、800 mg /L的NH4Cl溶液,分别按500 mL分配于8个500 mL的烧杯中,置于恒温磁力搅拌器上,反应温度为25 ℃,沸石投加浓度为 10 g/L,以 180 r/min的转速振荡反应24 h后取样,离心分离后进行分析。
(2)吸附动力学试验:采用去离子水配置浓度(以 N 计) 为 50、100、150、200、250、300 mg /L 的NH4Cl溶液,沸石粉投加浓度、试验方法同等温吸附试验。取样时间为反应开始后 1、3、5、15、30、45、60、90、120、180 min。
1.2.2 天然沸石的改性吸附试验
(1)盐改性效果的比较试验
采用去离子水配制1 mol/LNaCl溶液、1 mol/LKCl溶液及 0.5 mol/LCaCl2 溶液,天然沸石投加浓度为100 g/L,将其置于恒温磁力搅拌器上,反应温度25℃,改性时间24 h。静置沉淀用去离子洗涤3~5次,将制得的改性沸石放入电热烘箱中在105℃烘干,研磨,过200目筛,放在干燥器中备用。采用100 mg/L NH4Cl溶液,反应3 h测定吸附量。
(2)NaCl浓度对改性效果影响试验
采用去离子水配制 0.2、0.4、0.6、0.8、1、2 mol/LNaCl溶液,天然沸石投加浓度为100 g/L。其他步骤同 1.2.2(1)。
(3)温度对NaCl改性效果影响试验
采用去离子水配制0.5 mol/LNaCl溶液,天然沸石投加浓度为100 g/L,将其置于恒温磁力搅拌器上,反应温度分别 20、30、40、50 ℃,改性时间 24 h。其他步骤同 1.2.2(1)。
2 结果与讨论
2.1 天然沸石的吸特性

关于Langmuir线性模型的一个重要无限小常量是分离系数RL:

式中:Kf——Freundlich常数,表示吸附剂的吸附能力,mg/g;
1/n——异质因子,与吸附强度和表面异质性有关。


图1 天然沸石对的吸附等温线Fig.1 Linear Plot of Langmuir and Freundlich Isotherm of Ion Adsorption on Zeolite
表1 不同初始浓度条件下的反应动力学参数Tab.1 Kinetic Parameters for Ammonia Removal Using Pseudo-Second-Order Kinetic Model

表1 不同初始浓度条件下的反应动力学参数Tab.1 Kinetic Parameters for Ammonia Removal Using Pseudo-Second-Order Kinetic Model
NH+4初始浓度C0/(mg·L-1)线性关系式qe/(mg·g-1)/(g·mg-1·min-1)R2 k2 50 100 150 200 250 300 y=0.233x+0.177 3 y=0.134x+0.199 2 y=0.105 5x+0.171 6 y=0.096 3x+0.204 9 y=0.081 7x+0.207 4 y=0.069 7x+0.185 6 4.292 7.463 9.479 10.384 12.240 14.347 0.306 0.090 0.065 0.045 0.032 0.026 0.999 9 0.999 8 0.999 8 0.999 7 0.998 9 0.998 6
2.1.3 吸附过程阳离子交换特性
(1)等温吸附终点的阳离子交换特征
等温吸附试验终点时溶液中金属阳离子的浓度变化情况如图2所示。由图可见,天然沸石对的吸附过程中,伴随着明显的离子交换过程。其中,以Ca2+和Na+为主,两者交换当量分别占42.82%~65.9%和 32.2%~52.72%,K+和 Mg2+交换当量之和约占2%~5%。此外,随着起始浓度C0由100 mg /L 增加至 800 mg /L,Na+所占比例由 65.9%降至 42.82%,Ca2+所占比例由 32.2%增加至 52.72%,并在C0=400 mg/L左右,超过了Na+。
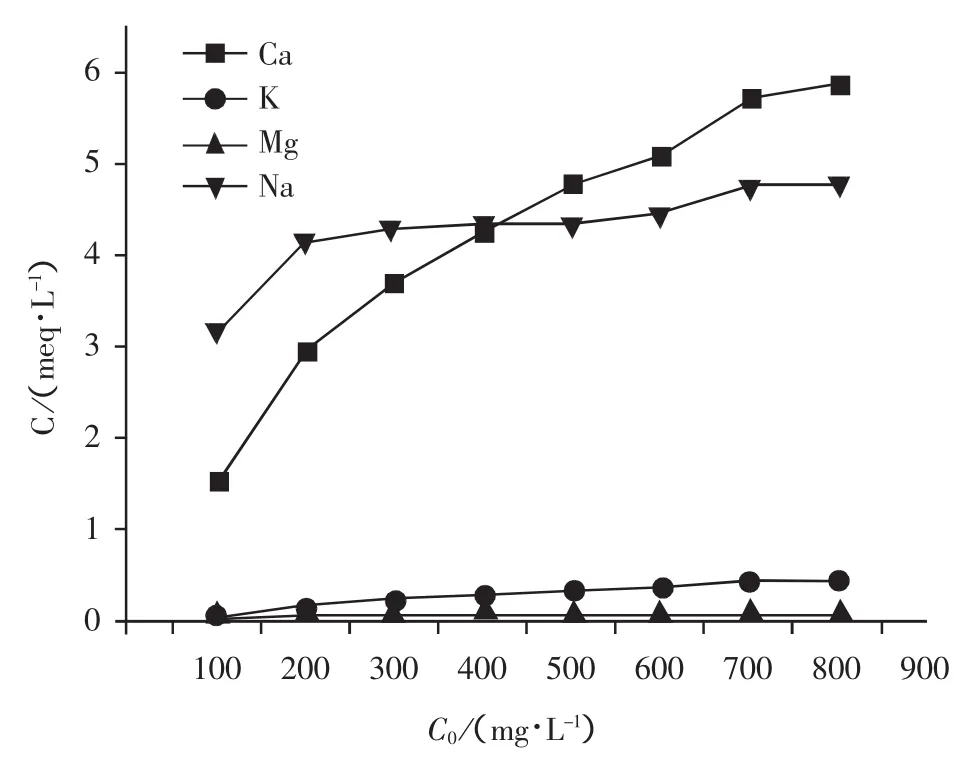
图2 试验终点溶液中金属阳离子浓度Fig.2 Liquid Concentrations of Cations after Isothermal Adsorption Experiment
斜发沸石对离子的选择交换顺序由大到小以此为[3]:Cs+>Rb+>K+>>Pb2+>Ag+>Ba2+>Na+>Sr2+>Ca2+>Li+>Cd2+>Cu2+>Zn2+,即沸石与离子间的吸引力可以预测,当沸石内部各金属阳离子与溶液中的发生交换时,交换顺序为Ca2+>Na+。可以预见的是,与Na+相比,Ca2+更容易被交换,这与试验现象不完全符合,原因可能是,Na+的离子半径小且性质活泼,因此比较容易克服沸石内部的扩散阻力,迅速游离到溶液中,就会出现Na+交换量更高的现象[15-17]。但随着溶液浓度提高,浓差压力增大,且Ca2+本身极易与溶液中的发生交换,Ca2+交换量逐渐与Na+持平,并超过Na+交换量。
沸石对氨氮的吸附分为物理吸附和化学吸附[17,18],阳离子交换量反映了化学交换吸附对氨氮去除的贡献。定义阳离子交换比见(5)式:


表2 等温吸附试验终点阳离子交换比Tab.2 Proportions of Cationic Exchange after Isothermal Adsorption Experiment
由表2可知,阳离子交换对氨氮的去除贡献率均在85%以上,氨氮浓度800 mg/L时,阳离子交换比达到了95.37%,沸石对氨氮的除去主要依靠阳离子的交换吸附,物理吸附起辅助作用。
(2)吸附动力学过程中的阳离子交换特性

图3 各金属阳离子浓度在吸附过程中间的变化曲线Fig.3 Variations of Metal Cation Concentrations in Liquid-Phase with Time
2.2 天然沸石的改性吸附
沸石因其晶格孔穴中分布有阳离子而具有强大的离子交换性能,无机盐改性属于沸石的内部结构改性,沸石经NaCl处理后变为钠型沸石。Na+置换了沸石孔穴中原有的Ca2+和Mg2+等半径较大的阳离子,使沸石Na+所占组分增加,有效孔径变大,空间位阻变小,内扩散速度加快,交换容量增大,提高了沸石去除氨氮的能力和反应速率[19-22]。
2.2.1 盐改性效果的比较
沸石经3种无机盐改性后分别成为Na-沸石、K-沸石、Ca-沸石,对氨氮的吸附量发生变化,究其原因可能是改型后的沸石的阳离子交换顺序和交换容量不同。

图4 天然沸石与无机盐改性沸石吸铵特性对比Fig.4 Comparison of Ammonium Absorption Characteristics of Natural and Inorganic Modified Clinoptilolite
由图4,在阳离子当量浓度相同时,3种无机盐改性的沸石对氨氮吸附效果最好的是NaCl改性沸石,较天然沸石的吸附量提升了近20%;CaCl2改性沸石较天然沸石吸附性能影响不大,甚至稍微降低;KCl改性导致沸石的吸附效果变差。
经X射线荧光光谱法测定,天然沸石粉和3中无机盐改性沸石的主要化学成份如下表:

表3 天然沸石与无机盐改性沸石主要化学成分(单位:%)Tab.3 The Main Chemical Compositions of Natural and Modified Clinoptilolite
Na-沸石中钠含量由原来的1.81%增长到3.68%,K-沸石中钾含量由原来1.15%增长到5.55%,Ca-沸石中钙含量由原来1.64%增长到1.97%,这与沸石天然斜发沸石对离子的选择交换顺序有关[3]。NaCl改性处理使得沸石的Na+交换容量增加,吸附量提升。但Ca-沸石吸附量并未显著提升,不仅与改性沸石Ca2+交换容量有关,还与离子半径和离子活性有关。虽然K+与沸石结构间作用力更大,KCl改性沸石K+将Na+和Ca2+置换处理,导致吸附性能变差。
2.2.2 NaCl浓度对改性效果的影响
随着NaCl溶液浓度的升高,改性沸石对氨氮的吸附量显著增加(图5)。当NaCl浓度为1 mol/L时,沸石对的吸附量已经达到8.426 mg/g,较天然沸石提升了近20%。随着NaCl浓度继续增加,吸附量几乎不再增长。天然沸石对氨氮吸附最佳的无机盐改性方法是用NaCl溶液进行改性,最佳浓度为 1 mol/L。

图5 NaCl浓度对改性沸石吸铵特性的影响Fig.5 The Influence of NaCl Concentration on Modified Zeolite Absorption Characteristics of Ammonium
天然斜发沸石吸铵特性试验中,金属阳离子变化规律表明,沸石对的吸附主要是靠离子交换,而Na+对表现出了较好的离子交换能力。对天然斜发沸石和1 mol/LNaCl改性沸石的进行表征。天然沸石的平均孔径及比表面积分别为9.80 nm和 21.64 m2/g,Na-型沸石的平均孔径及比表面积分别为 10.63 nm 和 22.64 m2/g。两者的扫描电镜图如图6所示:
Na-型沸石较天然沸石的平均孔径和比表面积都略微增加,但增幅较小。试验所用的天然为片状叠加结构,Na-型沸石的结构经过盐溶液的浸泡和洗涤变得比较松散。天然沸石的盐改性属于离子交换改性法,其晶体结构的变化不大对吸附的影响较小,金属阳离子的交换容量变化是影响氨氮吸附的主要原因。

图6 扫描电镜(SEM)图Fig.6 SEM Photograph of the Natural and Modified Clinoptilolite
3 结论
(4)天然沸石对氨氮吸附最佳的无机盐改性方法是用NaCl溶液进行改性,最佳浓度为1 mol/L。天然沸石的盐改性属于离子交换改性法,其晶体结构的变化不大对吸附的影响较小,金属阳离子的交换容量变化是影响氨氮吸附的主要原因。
[1]岳秀萍,员建.水处理滤料与填料[M].北京:化学工业出版社,2011:57-63.
[2] Zorpas A A,Constantinides T,Vlyssides A G,et al.Heavy metal uptake by natural zeolite and metals partitioning in sewage sludge compost[J].Bioresource Technology,2000,72(2):113-119.
[3] Tsitsishvili G V,Andronikashvili T G.Natural zeolites[M].Chichester,England:Ellis Horwood Limited,1992.
[4]张瑛洁,陈雷,马军,等.微波强化NaCl改性沸石的除氨氮效果研究[J].中国给水排水,2009,25(1):72-74.
[5] Lei L,Li X,Zhang X.Ammonium removal from aqueous solutions using microwave-treated natural Chinese zeolite[J].Separation and purification Technology,2008,58(3):359-366.
[6]佟小薇,朱义年.沸石改性及其去除水中氨氮的实验研究[J].环境工程学报,2009,3(4):635-638.
[7] Leakovic S,Mijatovic I,Cerjan-Stefanovic S,et al.Nitrogen removal from fertilizer wastewater by ion exchange[J].Water research,2000,34(1):185-190.
[8]张新颖,吴志超,王志伟,等.天然斜发沸石粉对溶液中的吸附机理研究[J].中国环境科学,2010(5):609-614.
[9] Zheng H,Han L,Ma H,et al.Adsorption characteristics of ammonium ion by zeolite 13X.Journal of Hazardous Materials,2008,Vol.158(2/3):577-584.
[10]近藤精一,石川达雄,安部郁夫.吸附科学[M],第二版.北京:化学工业出版社,2006.
[11]王萌,房春生,颜昌宙,等.沸石的改性及其对氨氮吸附特征[J].环境科学研究,2012,25(9):1024-1029.
[12] Widiastuti N,Wu H,Ang H M,et al.Removal of ammonium from greywater using natural zeolite[J].Desalination,2011,277(1):15-23.
[13] Malekian R,Abedi-Koupai J,Eslamian S S,et al.Ion-exchange process for ammonium removal and release using natural Iranian zeolite[J].Applied Clay Science,2011,51(3):323-329.
[14] Moussavi G,Talebi S,Farrokhi M,et al.The investigation of mechanism,kinetic and isotherm of ammonia and humic acid coadsorption onto natural zeolite[J].Chemical Engineering Journal,2011,171(3):1159-1169.
[15] Mall I D,Srivastava V C,Agarwal N K.Removal of Orange-G and Methyl Violet dyes by adsorption onto bagasse fly ash—kinetic study and equilibrium isotherm analyses[J].Dyes and pigments,2006,69(3):210-223.
[16] Wang S,Li L,Wu H,et al.Unburned carbon as a low-cost adsorbent for treatment of methylene blue-containing wastewater[J].Journal of colloid and interface science,2005,292(2):336-343.
[17]温东辉,唐孝炎.天然斜发沸石对溶液中的物化作用机理[J].中国环境科学,2003,23(5):509-514.
[18] Davis M E.Zeolites and molecular sieves:not just ordinary catalysts[J].Industrial and Engineering Chemistry Research,1991,30(8):1675-1683.
[19] Davis M E,Lobo R F.Zeolite and molecular sieve synthesis[J].Chemistry of Materials,1992,(4):756-768
[20]温东辉.天然沸石吸附:生物再生技术及其在滇池流域暴雨径流污染控制中的试验与机理研究[M].北京:中国环境科学出版社,2003.
[21]戴双林,王荣昌,赵建夫.改性沸石去除废水中氮和磷的机理与应用[J].净水技术,2011,30(6):58-62.
[22]李效红,朱琨.改性沸石去除水中有机污染物的研究进展[J].净水技术,2008,27(3):8-11,27.
