细胞制备实验室沉降菌检测分析
2014-03-16马学斌袁红霞
马学斌,马 聪,邱 伟,袁红霞
细胞制备实验室沉降菌检测分析
马学斌,马 聪,邱 伟,袁红霞
目的:系统开展细胞制备实验室沉降菌动态监测,保障实验室环境安全,为类似实验室消毒监测提供资料。方法:根据《药品生产质量管理规范(2010年修订)》的要求,对万级洁净区的空气用平皿沉降菌法检测菌落并计数,对洁净服及操作人员的手用涂布平皿法检测菌落并计数,将2012年9月至2013年10月间的检测结果进行统计分析。结果:共进行空气沉降菌检测52次,平均菌落数为:百级超净台和4℃冰箱为0.01 cfu/皿,CO2培养箱为0 cfu/皿,万级洁净区为0.04~0.12 cfu/皿;洁净服及操作人员的手检测14次,实验前检测结果均为阴性,实验后偶有菌落检出,所有检测结果全部低于标准要求。结论:生物治疗实验室的沉降菌检测结果远低于药品生产质量管理规范的要求,可以为生物治疗用细胞制备提供安全的环境。
细胞制备实验室;沉降菌;监测
0 引言
近年来,过继免疫细胞治疗在恶性肿瘤治疗方面取得的显著效果和展示的巨大潜力得到了全球科学界的认同,已经成为肿瘤治疗的重要研究方向。个体化免疫细胞的成功制备是免疫治疗的重要基础。如何保证细胞制备实验室的安全和细胞制品的安全是该项研究的重中之重。目前,对于细胞制备实验室尚无针对性的标准化管理规范,如何做好细胞制备实验室的无菌工作,是所有研究者都在关注的问题。笔者将所在实验室的清洁消毒程序和沉降菌检测工作进行汇总分析,希望能为相关实验室的无菌工作和实验室管理提供依据。
1 材料和方法
1.1 仪器和试剂
37℃恒温CO2培养箱(Thermo公司3100恒温CO2培养箱),直径90mm一次性无菌空气培养皿(本院检验科细菌室自制,无菌检测后发放),海尔4℃冷藏箱。
1.2 方法
1.2.1 检测对象
细胞制备实验室百级洁净工作台、CO2细胞培养箱、万级洁净细胞培养间、万级洁净内走廊、万级二更衣区、洁净服上衣、洁净服裤子、操作人员的手内弯侧。
1.2.2 检测依据
参照《药品生产质量管理规范(2010年修订)》、GB/T 16249—1996《医药工业洁净室(区)沉降菌的测试方法》[1]和《中国人民解放军医疗机构制剂规范》[2]的具体方法和要求进行检测。
1.2.3 洁净区域空气沉降菌的采样检测沉降菌的具体检测标准见表1。
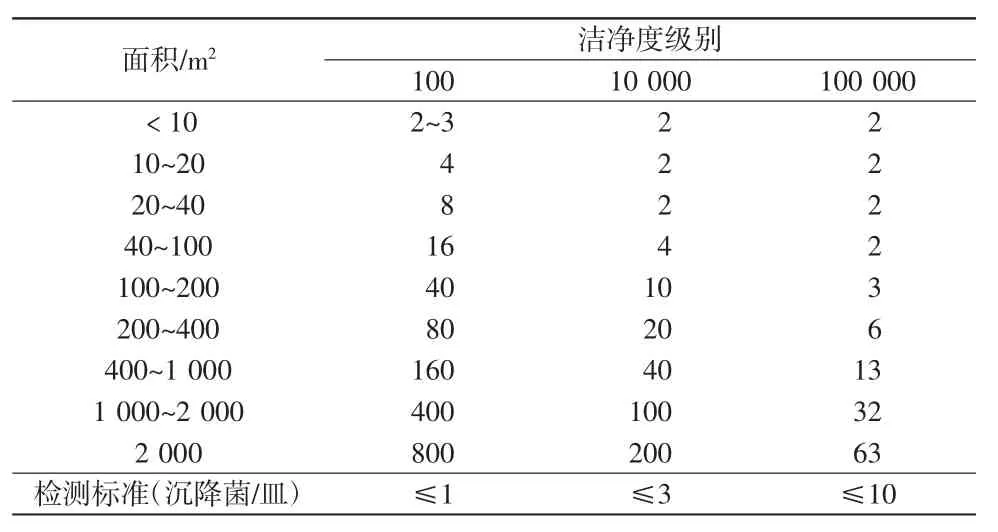
表1 洁净区沉降菌检测标准(平均菌落数:cfu/皿)
生物治疗实验室各区域分布及面积分别为:万级细胞制备室4间,其中A1房间20m2,A2房间25.7m2,A3房间25.8m2,A4房间47.2m2;内走廊33.7m2;二更衣室5.3m2。根据上述标准,设置实际采样点位置及数目见表2。

表2 空气沉降菌采样点及沉降碟数
生物治疗实验室按照管理规定进行清洁灭菌:每班工作前后用75%酒精清洁工作台面并紫外线照射30min,当天工作结束后用 500 mg/L健之素溶液拖擦地面;每周大清洁一次,用灭菌水和酒精擦拭仪器内外表面、墙面、天花板,用500mg/L健之素溶液拖擦地面,之后用臭氧(5~15 g/m3)消毒60min;每个月用过氧乙酸(1.8 g/m3)熏蒸2 h。沉降菌检测在每周大清洁之后第二天进行。
1.2.4 洁净服及操作人员手的采样检测
洁净服的细菌检测和工作人员手的细菌检测每月进行一次抽检。抽取消毒灭菌的洁净服2套,取手臂和裤腿部位在空气培养皿的表面轻轻按压后,盖上培养皿的盖子放入37℃培养箱中进行培养。工作人员的手的检测,在工作人员按流程更换刷手衣裤和洁净服,穿戴口罩、手套并消毒后进入细胞培养间开始常规工作前和工作中分别进行2次采样检测,用手弯侧内指面在培养皿上按压后,盖上培养皿的盖子放入37℃培养箱中进行培养。
2 结果
2012年9月至2013年10月间空气沉降菌每周检测一次,洁净服和操作人员的手每月检测一次。其中,检测超净工作台52次,CO2培养箱52次,洁净区各区域空气培养52次,洁净服检测14次,工作人员的手在工作前和工作中各检测14次。
2.1 洁净区空气沉降菌检测结果
所有空气沉降菌检测的温度和湿度在规定范围内,每次检测人数不超过2人,布点位置离地0.8~1.5m,按照规定位置单线路从内到外依次放置,打开培养皿盖暴露在空气中30min,再按反方向将培养皿盖全部盖上,放入37℃恒温培养箱中培养,48 h后观察菌落的生长情况。菌落计数:用肉眼仔细观察,然后计算平均菌落数/皿。计算公式为:平均菌落数/皿=单个培养皿菌落数之和/培养皿总数。
每次检测结果全部合格,所有检测结果统计见表3。本实验室的万级洁净区域沉降菌检测结果完全满足GMP标准要求的<2 cfu/皿(30min,90mm),百级超净工作台检测结果满足药品生产管理规范(goodmanufacturing practice,GMP)要求的<1 cfu/皿(30 min,90 mm),可以用于免疫细胞的培养。
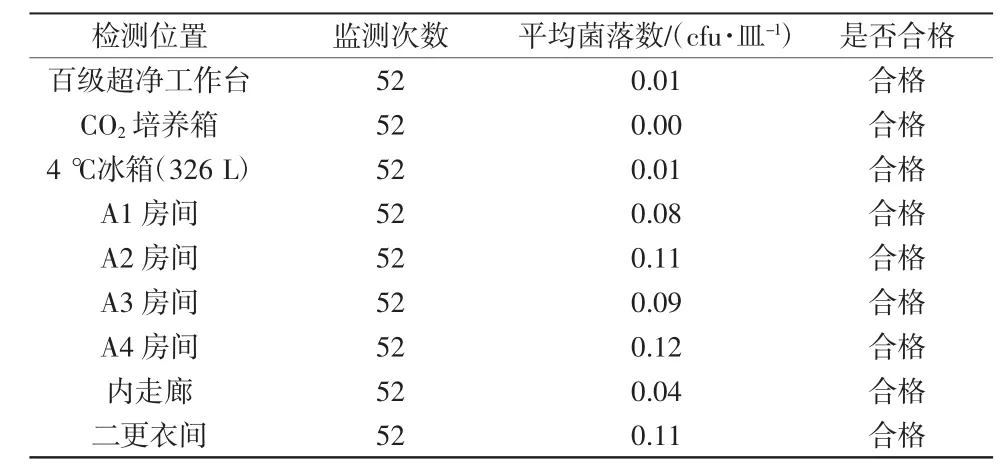
表3 2012年9月至2013年10月空气沉降菌检测结果
2.2 洁净服及操作人员手内侧的检测结果
洁净服和刷手衣是本院消毒供应室统一高压消毒灭菌后领取使用的。工作人员在洗手和手消毒后进入一更衣室更换刷手衣,进入二更衣室再次手消毒,然后按顺序穿戴无菌口罩、洁净服、无菌手套,再次手消毒后,通过2个缓冲区和内走廊进入细胞制备间。洁净服的检测是在打开包装时取上衣和下衣分别在空气培养皿上轻按,尽量布满整个培养皿,然后盖上盖子,放入37℃培养箱检测。工作人员手的检测是在工作前和工作中,用戴手套的手内弯侧在培养皿表面轻按,尽量布满整个培养皿,然后盖上盖子,放入37℃培养箱检测,48 h后观察结果。
工作前所有检测结果均为阴性,工作中偶有细菌检出。该结果远远低于GMP标准要求的<1 cfu/皿,完全满足GMP实验室的要求,见表4。
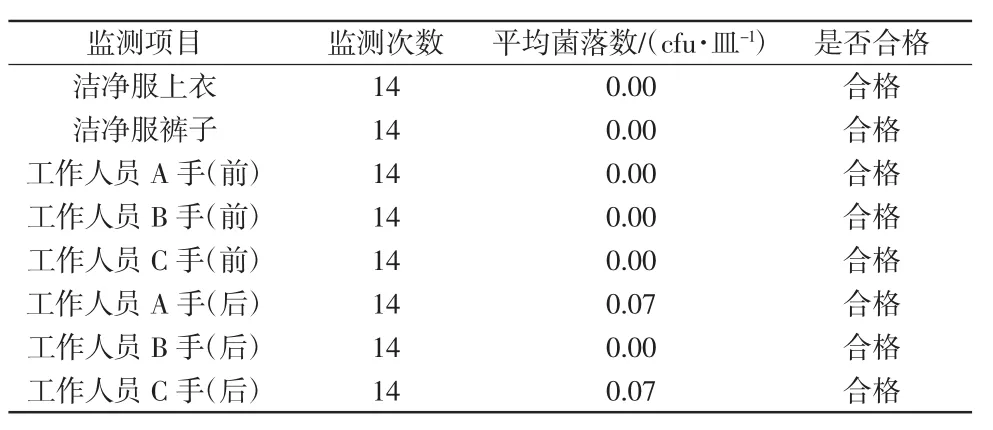
表4 2012年9月至2013年10月洁净服及手检测结果
3 讨论
随着我国药品GMP制度的发展,对药品生产中洁净室的控制要求越来越高。生物治疗用细胞属于特殊药品的范围,它取材于患者自身的外周血,通过实验室一段时间的诱导激活而使细胞活力和数量有一个显著扩增,然后回输到患者体内达到疾病治疗的目的。一般药品可以大批量规模化生产,单一批次和生产结束后车间可以进行清洁消毒;而免疫细胞的制备由于个体化多批次进行,很难停止细胞的制备来进行清洁消毒。同时,相对于批量化的药品生产方式,这种个体化的细胞制备方式因为取材于患者,具有原料来源的不可替代性和重复生产的不可复制性,一旦培养失败或者细胞污染将会造成很严重的后果,不仅不能完成细胞制品的成功制备,还会使患者后续的治疗受到严重影响。因此,细胞制备实验室的无菌要求比一般的洁净生产车间更高、更严苛,如何持续保证其无菌状态是一个重要的问题。
目前,在细胞制备实验室的设计、建设和管理方面,由于没有专门针对细胞制备实验室的设计规范,只能参照现行的《医药工业洁净厂房设计规范》和《药品生产质量管理规范》进行设计,并套用相关的规则。然而,由于细胞制品的特殊性,所有细胞制备的细胞均来源于患者的血液或者骨髓等组织,这些前体细胞均可能携带潜在的生物危害(如肝炎病毒等),因此,在严格遵循上述规范基本原则的前提下,需要充分考虑细胞制备个体化、防止交叉污染、保护操作人员安全性等核心环节[3]。在这个前提下,本实验室研究制定了严格的人员、物品进出实验室的流程和严格的人员、物品和环境清洁消毒管理制度及及时的检测规定,保证了细胞制品和人员的双重安全。
细胞制备实验室的洁净安全性包括很多因素,基本前提是空调净化系统的建立。整个系统的尘粒90%来源于新风,而尘粒是很多细菌的携带者,所以,新风处理是关键的环节[4]。本实验室新风机组采用袋式初效过滤器和袋式中效过滤器2套过滤装置,分别可以过滤掉40%~80%的直径大于5μm的颗粒和70%的直径大于1μm的颗粒;过滤后的新风进入循环机组,通过板式初效过滤器再次过滤掉40%~80%的直径大于5μm的颗粒,此时新风与机组循环风共同通过循环机组中的袋式中效过滤器,在此过滤掉大约70%的直径大于1μm的颗粒。最后,新风和循环风共同到达位于房间顶部的高效过滤器,在此过滤掉直径大于0.5μm的颗粒,过滤效率可以达到99.999 5%。这样经过2级的新风过滤和3级的循环机组空气过滤,最后到达细胞制备间的是洁净度相对较高的空气。
在细胞制备实验室洁净度不同的区域,应当保持一定的静压差,保证洁净度较高的区域的室内压力高于洁净度相对较低的区域。按照GMP最新版的要求,静压差不能低于10 Pa。这样可以保证气流的流向,从而保证细胞制备实验室核心区域的洁净度[5]。静压差的维持主要是通过各级空气过滤器和对换气次数的控制来实现的,如果过滤器阻力变大,则会使压差减小。因此,对压差的监测和对过滤器的日常维护保养也是一个重要的内容[6]。
过滤不等于消毒。据统计,一个静止不动的人每分钟能够散发出100 000个带有细菌的粒子[7],这些粒子的平均直径在2~10μm之间,由于重力原因这些粒子很容易降落在室内物品的表面上。因此,本实验室对于工作人员的着装具有严格的要求:内着刷手衣,外着连帽连袜的洁净服,戴无菌口罩和手套,尽量减少身体部位的暴露。在操作中,每次手移出超净工作台百级洁净区域后,再次进入都需要喷洒酒精消毒。同时严格执行每次实验后对操作台面、实验桌面进行酒精擦拭消毒,每日工作完成后用500mg/L的含氯消毒液拖擦地面。本项研究统计发现,工作前的洁净服和手的检测都是全部无菌的,而工作中会有菌落的检出,这说明工作的过程就是一个发尘污染的过程。因此,工作过程中的手消毒是非常必要和不可或缺的,工作后的清洁是保证次日工作质量的重要程序。
空气消毒灭菌有多种方法[8]。紫外线灭菌属于电磁波辐射,其穿透能力差,杀菌能力随使用时间的增加而减少,但较易穿透清洁空气,故广泛应用于空气灭菌和表面消毒,使用方法简便易行,是目前实验室常规使用的方法。臭氧是一种广谱杀菌剂,具有强烈的杀菌消毒作用,且可以弥散到各个角落,使杀菌没有死角,与微生物细胞中多种成分产生反应,形成不可逆的变化而死亡,有效杀菌浓度为20mg/m3,30min对自然菌的杀灭率达到90%以上。臭氧容易分解,一般30min可以完全分解为氧气,对空气污染小。过氧乙酸的杀菌作用是基于强大的氧化能力,对细菌繁殖体、芽孢、真菌、病毒都有高效的杀灭作用,用于洁净实验室消毒的熏蒸浓度为1.8 g/m3,但是对金属器皿具有一定的腐蚀性。以上消毒灭菌方法各有优缺点,本实验室使用多种消毒灭菌方法可以起到互补的作用,在1 a多的检测中始终保持了较低的沉降菌检出结果。
本实验室在加强管理和消毒制度规范下,严格按照流程进行细胞制备实验室的清洁消毒、维护和记录,这1 a来的记录结果显示灭菌效果良好,所有检测结果均远远低于相关标准,无一例细胞污染等不良事件的发生,为生物治疗用细胞的制备提供了安全的环境。希望本实验的经验可以为类似的实验室在工作中提供借鉴。
(►►►►)(◄◄◄◄)
[1]GB/T 16249—1996 医药工业洁净室(区)沉降菌的测试方法[S].北京:中国标准出版社,1996.
[2]中国人民解放军总后勤部卫生部.中国人民解放军医疗机构制剂规范[M].北京:人民军医出版社,2002.
[3]马东初,于卉影,陈伟,等.自体CIK治疗技术细胞制品制备面临的问题与持续改进的思考[J].医学争鸣,2013,4(3):27-30.
[4]李在秋,郭亚东,苑庆忠,等.某动物房洁净空调系统气流组织研究[J].医疗卫生装备,2013,34(6):23-25.
[5]CrimiP,ArgellatiF,Macrina G,etal.Micro biolog icalsur veillance of hospital ventilation systems in depart mentsathigh risk of nosocomial infections[J].JPrevMed Hyg,2006,47(3):105-109.
[6]张宗兴,赵明,衣颖,等.生物安全实验室效率检漏型高效空气过滤装置的研制[J].医疗卫生装备,2013,34(7):18-20.
[7]孙亚楠,王威.洁净手术室建设与运行管理[J].中国医院建筑与装备,2011(10):78-81.
[8]AlbrechtM,Gauthier R L,BelaniK,etal.Forced-airwarming blowers:an evaluation of filtration adequacy and airborne contamination emissions in the operating room[J].Am J Infect Control,2011,39(4):321-328.
(收稿:2013-11-12 修回:2014-01-06)
Settlement bacteriamonitoring and analysis in cell preparation lab
MA Xue-bin1,MA Cong2,QIUWei1,YUAN Hong-xia1
(1.Center for Tumor Diagnosis and Treatment,Naval General Hospital,Beijing 100048,China; 2.Departmentof Clinical Laboratory,Naval General Hospital,Beijing 100048,China)
Objective To carry out dynamic monitoring of the settlement bacteria in the cell preparation lab to ensure lab environment safety,and to provide references to other likely labs.Methods Based on Good Manufacturing Practice(edited in 2010),plate settlement bacteriamethod was used to detect and calculate the bacterial colony in the air of 10,000 grade clean area,and spread plate settlement bacteria method was applied to the detection and calculation of the bacterial colony in the clean clothing and hands of the operator.Then statistical analysis was performed for the detection results from September 2012 to October 2013.Results Totally 52 times of air settlement bacteria detection were implemented, which counted themean bacteria colony as 0.01 cfu per plate in 100 grade super clean bench and 4℃refrigerator,0 cfu per plate in CO2incubator and 0.04 to 0.12 cfu per plate in 10,000 grade clean area.There were 14 times of detection for clean clothing and the hands of the operator occurred,which all had negative results before detection.Bacteria could be found occasionally in the clean clothing and the hands of the operator,with all the detection results lower than the desired requirements of the standard.Conclusion The settlement bacteria results in the cell preparation lab are far low from the request of Good Manufacturing Practice (edited in 2010),which can provide qualified environment in cell preparation for the biological treatment.[Chinese Medical Equipment Journal,2014,35(7):21-23,30]
cell preparation lab;settlementbacteria;monitoring
R318;TU411
A
1003-8868(2014)07-0021-04
10.7687/J.ISSN1003-8868.2014.07.021
马学斌(1971—),女,硕士,主管技师,主要从事肿瘤生物治疗方面的研究工作,E-mail:1965394316@qq.com。
100048北京,海军总医院肿瘤诊疗中心(马学斌,邱 伟,袁红霞),检验科(马 聪)
马 聪,E-mail:macong66958166@163.com
