荧光光谱法研究尼麦角林与牛血清白蛋白的相互作用
2014-03-16陈佰灵仇丽颖李婧刘晖郭芷含赵志刚
陈佰灵, 仇丽颖, 李婧, 刘晖, 郭芷含, 赵志刚
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
荧光光谱法研究尼麦角林与牛血清白蛋白的相互作用
陈佰灵, 仇丽颖, 李婧, 刘晖, 郭芷含, 赵志刚
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
目的: 模拟正常人体生理条件下, 采用荧光光谱技术研究尼麦角林与牛血清白蛋白(BSA)相互作用的机制. 方法: 通过荧光光谱法确定尼麦角林对BSA荧光淬灭的机制, 采用Stern-volmer方程和Lineweaver-Burk双倒数方程计算反应的猝灭常数和形成常数, 采用双对数方程计算两者结合常数和结合位点数, 热力学公式计算反应前后焓变和熵变确定两者结合的主要作用力类型. 结果: 尼麦角林在0.25×l0-4~2.25×l0-4mol·L-1浓度范围内, 对BSA的内源荧光有较强的淬灭作用, 淬灭类型属于静态荧光淬灭. 在温度25℃和37℃时, 尼麦角林与BSA的结合常数分别为3.499×104L·mol-1和5.213×104L·mol-1, 结合位点数分别为1.21和1.25. 由热力学参数焓变(ΔH=11.05 KJ·mol-1)大于零和熵变(ΔS=74.87 J·mol-1·K-1)大于零, 确定尼麦角林与BSA之间的作用力以疏水作用力为主. 结论: 尼麦角林与BSA通过疏水作用形成复合物, 经静态猝灭机制引起BSA内源性荧光猝灭.
尼麦角林; 牛血清白蛋白; 荧光光谱法
尼麦角林(Nicergoline), 化学名为10α-甲氧基-1, 6-二甲基麦角林-8β-甲醇基-5-溴烟酸酯, 具有较强的α受体阻滞作用、扩张血管、抑制血小板聚集和抗血栓作用, 能加强脑部新陈代谢和神经递质转化, 增加血氧和葡萄糖的摄取及利用, 临床上已成为阿尔茨海默症、血管性痴呆、脑血管疾病、周围血管疾病以及前庭中枢性平衡障碍等多种疾病的经典用药[1-3]. 血浆中的白蛋白具有转运功能, 药物与白蛋白结合后不能跨膜转运, 起到药物储库作用, 因此药物与白蛋白结合能力的高低, 直接影响其临床疗效, 但尼麦角林是否能与白蛋白相互作用的研究尚未见报道. 本文选择了与人血白蛋白具有高度同源性的牛血清白蛋白(BSA), 采用荧光光谱法研究尼麦角林与BSA相互作用的特征, 该结果可为探讨尼麦角林在体内的转运、分配和代谢过程提供部分实验数据和理论依据, 也为临床合理用药提供一定的参考.
1 实验部分
1.1 仪器与试剂
CARY Eclipse荧光分光光度仪(美国, Varian公司), Unicam UV500紫外分光光度仪(美国, Thermo公司), PHS-3D型PH计(上海智光仪器仪表有限公司 ). HH-2数显恒温水浴锅(国华电器有限公司). 三羟甲基氨基甲烷(Tris)(美国, Bio-Rad公司), 牛血清白蛋白 (瑞士, Roche公司, 含量98%), 尼麦角林(四川大学华西药学院天然药化教研室, 含量99.5%), 除Tris为生化试剂外, 其余试剂均为分析纯, 实验用水为二次去离子水.
1.2 试验方法
1.2.1 溶液配制
BSA溶液: 用Tris-HCl缓冲溶液(0.1 mol·L-1, 盐酸调节pH 7.4, 内含0.1 mol·L-1NaCl维持离子强度)配成4.0×10-5mol·L-1储备溶液. 尼麦角林溶液: 精密称取尼麦角林适量, 用甲醇溶解配制成浓度为2.5×10-3mol·L-1的工作溶液, 4 ℃保存备用.
1.2.2 荧光光谱测定
分别在一系列容量瓶中各精密加入l mL 4.0×l0-5mol·L-1的BSA溶液, 依次加入0, 100, 200, 300, 400, 500, 600, 700, 800, 900 μL的2.5×10-3mol·L-1的尼麦角林溶液, 再分别加入0.1 mol·L-1Tris-HCl(pH7.4, 内含0.1 mol·L-1NaCl)缓冲溶液定容至10 mL, 摇匀, 臵于恒温水浴锅中在规定温度下(25℃或37℃)孵育20min, 测定荧光光谱. 固定激发波长为278nm, 激发, 发射狭缝均为5nm, 扫描荧光光谱并测量荧光强度. 测定温度为25 ℃或37 ℃.
2 结果与讨论
2.1 尼麦角林与BSA荧光光谱对比
BSA分子中的色氨酸、酪氨酸和苯丙氨酸残基能够发射荧光, 因而BSA是内源性荧光物质. 当激发波长在278 nm时, BSA荧光发射峰在350 nm附近, 而尼麦角林荧光强度很弱, 因此不会对BSA的荧光产生干扰.
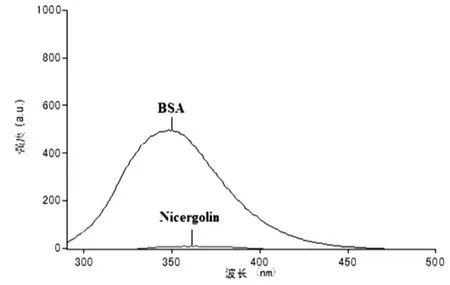
图1 激发波长在278nm时BSA和尼麦角林的荧光光谱Fig.1 The fluorescence spectra of the BSA and Nicergoline at 278nm excitation
2.2 尼麦角林对BSA荧光光谱的影响
固定BSA的溶液浓度不变, 向其中加入不同体积的尼麦角林溶液, 结果随着尼麦角林浓度的增加(终浓度依次为0, 0.25, 0.5, 0.75, 1.0, 1.25, 1.5, 1.75, 2.0, 2.25×10-4mol·L-1), BSA最大荧光发射峰强度逐渐降低(见图2). 实验结果说明尼麦角林通过某种机制导致BSA的荧光被淬灭.

图2 尼麦角林对BSA荧光发射光谱的影响Fig.2 Effect of Nicergoline on fluorescence emission spectra of BSA
2.3 尼麦角林对BSA的荧光猝灭机理
荧光猝灭作用可分为动态猝灭和静态猝灭等[4-5]. 本文首先按照动态荧猝灭规律, 测定了常温下(25 ℃)和正常生理条件下(37 ℃), 尼麦角林对BSA的荧光猝灭情况. 在动态猝灭过程中, 可利用Stern-volmer方程[5-6]:

方程中F0和F分别表示猝灭剂不存在和存在时BSA的荧光强度, [Q]是猝灭剂的浓度, 即本实验中尼麦角林的浓度, Ksv为动态猝灭常数(单位L·mol-1), Kq为双分子表观猝灭速率常数(单位L·mol-1·s-1), τo是无猝灭剂时荧光分子平均寿命, 文献[7-8]报道约为10-8s. 将F0/F对[Q]作图进行曲线拟合(图3), 由直线的斜率可以求算出KSV, 进一步求算出Kq(表1):

图3 不同温度条件下尼麦角林对BSA荧光猝灭Stern-Volmer方程曲线Fig.3 Stern-Volmer piots of BSA fluorescence quenched by nicergoline at different temperatures

表1 不同温度条件下尼麦角林对BSA荧光猝灭常数Tab.1 quenching parameters of BSA reaction with nicergoline at different temperatures
由计算结果可知, 尼麦角林对BSA的猝灭过程速率常数Kq远大于猝灭剂对生物大分子的动态荧光猝灭速率常数最大值2.0×1010mol-1·L·s-1, 说明动态猝灭不是引起BSA荧光猝灭的主要原因[8].
静态猝灭可用Lineweaver-Burk双倒数方程[6,8]进行描述:

其中, F0、F 和[Q]意义同前, KLB为静态猝灭过程中复合物的形成常数(单位L·mol-1). 应用( F0- F)-1对[Q]-1作图并进行线性拟合(见图4), 由直线的斜率和截距求算KLB

图4 不同温度条件下尼麦角林对BSA荧光猝灭Lineweaver-Burk方程曲线Fig.4 Lineweaver-Burk piots of BSA fluorescence quenched by nicergoline at different temperatures

表2 不同温度条件下尼麦角林与BSA相互作用的结合常数和结合位点数Tab.2 Binding constants and binding numbers for BSA reaction with nicergoline at different temperatures
2.4 尼麦角林与BSA的结合常数和结合位点数
引用文献报道[7-9]的公式(方程3)作图并计算静态猝灭过程蛋白质与小分子的结合位点数n和结合常数KA. 结果见图5和表2.


图5 不同温度条件下尼麦角林对BSA荧光猝灭的双倒数方程曲线Fig. 5 The double logarithmic plots of BSA fluorescence quenched by Nicergoline at different temperatures
2.5 尼麦角林与BSA的作用力类型
有机小分子和蛋白质生物大分子之间的结合力主要有疏水作用力、范德华力、静电作用力和氢键作用等. 由热力学参数关系式(方程式4~6), 可以计算出尼麦角林与 BSA 相互作用的热力学函数值, 结果见表3.


表3 不同温度条件下热力学参数Tab.3 The thermodynamic parameters at different temperatures
文献报道判断生物大分子与小分子的结合性质有一定的热力学规律[10-11], 若ΔH>0, ΔS>0, 则表现为疏水作用力; 若ΔH<0, ΔS>0, 则表现为静电作用力; 若ΔH<0, ΔS<0, 则表现为氢键和范德华力. 由于尼麦角林与BSA反应前后的ΔH>0, ΔS>0, 表明两者之间的作用力以疏水作用为主.
3 结论
本研究结果表明, 尼麦角林对BSA的荧光猝灭作用属于静态猝灭, 是由于两者间通过分子间疏水作用力形成了无荧光的大分子复合物而产生的, 两者的结合位点约为1. BSA通过与尼麦角林结合形成复合物, 能够影响其在体内的转运和代谢, 进而影响其药理作用, 因此尼麦角林和BSA的相互作用结果对临床用药具有重要意义.但是尼麦角林结合在BSA哪个结构域, 是否会对BSA构象产生影响, 以及多药并服时是否会影响两者之间的结合等问题还需要更加深入的研究.
[1] 刘玲, 熊念, 王涛. 尼麦角林的临床研究进展及应用[J]. 卒中与神经疾病, 2013, 20(2): 118-120.
[2] 张晓景. 尼麦角林的药理作用及临床应用[J]. 西北药学杂志, 2006, 21(6): 286-287.
[3] 仇丽颖, 张丹. 尼麦角林在大鼠体内的药代动力学研究[J]. 药物分析杂志, 2007, 27(3): 328-331.
[4] 孟丽艳, 屈凌波, 杨冉, 等. 紫外吸收光谱和荧光光谱法研究大黄酚与牛血清白蛋白相互作用机制[J]. 理化检验-化学分册, 2009, 45(10): 1169-1173.
[5] NAN WANG, LING YE , FANGFEI YAN, et al. Spectroscopic studies on the interaction of azelnidipine with bovine serum albumin [J]. International Journal of Pharmaceutics, 2008,351:55-60.
[6] 陈国珍, 黄贤智, 郑朱梓, 等. 荧光分析法[M ]. 北京: 科学出版社, 1990: 201- 212.
[7] 王丽娟, 李晓蓉, 李宇航, 等. 曲克芦丁与牛血清白蛋白的相互作用研究[J]. 中国药理学通报, 2009, 25(12): 1584-1588.
[8] 黄芸, 崔力剑, 窦玉红, 等. 阿司匹林与人血清白蛋白的相互作用研究[J]. 中国药理学通报, 2008, 24(9): 1192-1195.
[9] 胡威, 付彩霞, 黄玉玲. 荧光光谱法研究左氧氟沙星、拉米夫定同时与牛血清白蛋白的相互作用[J]. 化学与生物工程, 2014, 31(4): 29-31.
[10] PHILIP D R, SUBRAM ANIAN S. Thermodynamics of protein association reactions: forces contributing to stability [J]. Biochemistry, 1981, 20(11): 3096-3102.
[11] 高平章, 吴洪, 郭婧, 等. 荧光光谱法研究灯盏花素与牛血清白蛋白相互作用[J]. 中国现代应用药学, 2012, 29(2): 106-109.
Study on interaction between nicergoline and bovine serum albumin by fluorescence spectroscopy
CHEN Bai-ling, QIU Li-ying, LI Jing, LIU Hui, GUO Zhi-han , ZHAO Zhi-gang
(School of Chemistry and Environmental Protection Engineering, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
Objective:Under simulative physiological conditions, mechanism of interaction of bovine serum albumin (BSA) and Nicergoline was studied by fluorescence spectroscopy.Method:Fluorescence spectroscopy was used to determine the fluorescence quenching mechanism of BSA caused by Nicergoline. Stern-volmer equation and Lineweaver-Burk double reciprocal equation were applied to determine the dynamic and static quenching constants. Double logarithmic equation was used to calculate the number of binding sites and binding constants. The main binding force was discussed by thermodynamic equation.Results:Fluorescence quenching of BSA by Nicergoline was strong in 0.25×l0-4~2.25×l0-4mol·L range, and belonged to static quenching type. At 25℃ and 37℃, the binding constants (KA) between Nicergoline and BSA were 3.499×104L·mol-1and 5.213×104L·mol-1, and the binding sites were 1.21 and 1.25, respectively. According to the thermodynamic parameters, enthalpy change (ΔH=11.05 KJ·mol-1) and entropy change (ΔS=74.87 J·mol-1·K-1), the interaction between Nicergoline and BSA was driven mainly by hydrophobic force.Conclusion:Nicergoline quenchs the intrinsic fluorescence of BSA via static quenching mechanism, and the binding is mainly driven by hydrophobic interaction.
Nicergoline; bovine serum albumin; fluorescence spectrometry
R917
A
1003-4271(2014)04-0509-05
10.3969/j.issn.1003-4271.2014.04.07
2014-04-08
仇丽颖(1980-), 女, 汉族, 沈阳人, 讲师, 博士, 研究方向: 生物药物分析; E-mail:qiu7992@sina.com.
