血清肿瘤标记物联合检测鉴别肝内胆管癌和肝细胞癌
2014-03-16曹梦晗王民宪
赵 琳,曹梦晗,王民宪
血清肿瘤标记物联合检测鉴别肝内胆管癌和肝细胞癌
赵 琳,曹梦晗,王民宪
目的:研究评价肝内胆管癌(ICC)和肝细胞癌(HCC)患者血清胸苷激酶1(TK1)、甲胎蛋白(AFP)、糖类抗原19-9 (CA19-9)和癌胚抗原(CEA)的表达。方法:应用化学增强发光点印迹法定量检测48例HCC患者和17例ICC患者血清TK1浓度,直接化学发光法检测血清AFP、CA19-9和CEA浓度;50例健康志愿者作为对照组。结果:血清TK1、AFP、CAl9-9和CEA浓度在HCC组和ICC组均明显升高(P<0.05)。血清CA19-9对ICC诊断敏感性最高(76.5%),CEA其次(64.7%)。结论:血清TK1、AFP、CA19-9和CEA联合检测对HCC和ICC的鉴别诊断具有一定临床意义。
肿瘤标志物;定量检测;肝内胆管癌;肝细胞癌
肝内型胆管细胞性肝癌简称肝内胆管癌(intrahepatic cholangiocarcinoma ICC),与肝细胞癌(hepatocellular carcinoma,HCC)在病因、发病机制、临床表现和治疗方案上均有所不同,近年来在全球范围内发病率呈上升趋势。虽然随着影像学发展,ICC的诊断率明显提高[1],但难与HCC相鉴别。2009年1月—2012年12月,我们对本院HCC和ICC患者血清胸苷激酶1(TK1)、甲胎蛋白(AFP)、糖类抗原19-9 (CA19-9)和癌胚抗原(CEA)水平进行联合检测,探讨其在鉴别诊断方面的价值。
1 资料与方法
1.1 一般资料 本组共65例,其中HCC48例,男29例,女19例;年龄39岁~77岁,中位年龄57.2岁。ICC 17例,男11例,女6例;年龄35~80岁,中位年龄59.3岁。以上病例为我院2009年1月—2012年12月住院患者。正常对照组为体检中心健康人群50例,男27例、女23例;年龄28~73岁,中位年龄52.4岁,均为排除贫血、女性月经期等处于细胞增殖状态之外的健康人。3组性别和年龄等差异无统计学意义(P>0.05),具有可比性。
1.2 试剂和仪器 TK1诊断试剂盒:抗TK1抗体( anti-TK1 Ab),硝酸纤维素薄膜,TK1校准品(2.2、6.6、20 pmol/L),ECL试剂,生物素化二抗,辣根过氧化物酶标记亲和素,封闭剂,抗体稀释液,抗体洗涤液。CIS-I型化学发光数字成像分析仪。试剂及仪器均由深圳华瑞同康公司提供。AFP测定试剂盒(直接化学发光法)。糖抗原19-9测定试剂盒(直接化学发光法)。CEA测定试剂盒(直接化学发光法)。ADVIA Centaur XP全自动化学发光免疫分析仪。均由西门子医药公司提供。
1.3 方法和步骤 (1)标本收集:3组空腹采集2份静脉血各2 mL,分别用干燥管收集血液(禁抗凝剂和促凝剂)待血液自然凝固,1份行血清AFP、 CA19-9和CEA检测,1份行TK1检测。3500 r/min,离心10 min,取上清直接点样或取100~200 μL血清,分装于两个洁净的EP管中并编号(1管用于检测、另1管用于复检),保存在-20℃以下。(2)TK1检测步骤:根据试剂盒说明书,配制pH为7.6的抗体稀释液、洗液和封闭剂。根据样本量选择模板的大小,将校准品1、校准品2、和校准品3顺序点样至A1、A2、A3膜孔,待测样品按顺序依次点样至后续膜孔上,室温下自然晾干20~30 min。取出硝酸纤维素薄膜,在反应盒内用稀释液振摇洗膜2次,每次5 min。弃去洗液,倒入封闭液,振摇封闭1 h。弃去封闭液,按1∶500稀释度配置一抗稀释液并加入反应盒内,25℃下振摇反应2 h。先用洗液快速漂洗2次后,振摇洗3次,每次5 min。加入生物素化二抗,室温下振摇精确反应40 min。反应结束后洗涤,并按1∶1500稀释链酶亲核素-酶复合物,室温精确反应1 h,洗涤。加入ECL发光剂,过膜浸湿并精确反应1 min,将膜片用吸水纸吸干,放人塑料膜内挤干剩余的溶液。将膜放入CIS-1型化学发光成像分析系统内进行分析。
AFP、CA19-9和CEA检测:直接化学发光法,在西门子ADVIA Centaur XP全自动化学发光免疫分析仪上测定。
1.4 评价指标 TK1≥2 pmol/L、AFP≥8.1 ng/mL、CA199≥37 U/mL、CEA≥2.5 ng/mL判断为阳性结果。1.5 统计学方法 采用SPSS 13.0软件进行统计学处理。计量资料以(±s)表示,组间比较采用one way ANOVA检验;率的比较用χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。敏感性(SE)=[真阳性样本数/(真阳性样本数+假阴性样本数)]×100%;特异性(SP)=[真阴性样本数/(真阴性样本数+假阳性样本数)]×100%。
2 结果
2.1 血清TK1、AFP、CA19-9和CEA表达水平 HCC组和ICC组四项肿瘤标记物水平均明显升高,与正常对照组比较,差异均有统计学意义(P<0.05)。 ICC组TK1、AFP水平明显低于HCC组,CA19-9和CEA水平则明显高于HCC组(P<0.05)。见表1。
表1 3组血清各项肿瘤标记物表达水平±s)
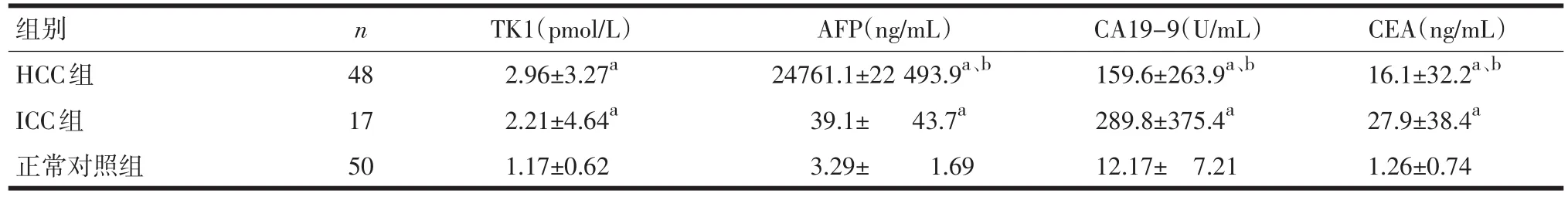
表1 3组血清各项肿瘤标记物表达水平±s)
注:与正常对照组比较,aP<0.05;与ICC组比较,bP<0.05
组别HCC组ICC组正常对照组n 48 17 50 TK1(pmol/L)2.96±3.27a2.21±4.64a1.17±0.62 AFP(ng/mL)24761.1±22 493.9a、b39.1± 43.7a3.29± 1.69 CA19-9(U/mL)159.6±263.9a、b289.8±375.4a12.17± 7.21 CEA(ng/mL)16.1±32.2a、b27.9±38.4a1.26±0.74
2.2 血清TK1、AFP、CA19-9和CEA阳性率 HCC组AFP阳性率最高(72.9%),TK1其次(50%);ICC组CA19-9阳性率最高(76.5%),CEA其次(64.7%)。见表2。
2.3 四项指标联合诊断HCC和ICC的敏感性、特异性 AFP诊断HCC的敏感性最高(72.9%),TK1其次(50.0%),CA19-9最差(29.1%)。CA19-9诊断ICC的敏感性最高(76.5%),CEA其次(64.7%),AFP最差(11.8%)。AFP诊断HCC特异性最高(86.6%),CA19-9诊断ICC特异性最高(74.5%)。四项指标联合诊断HCC和ICC的敏感性均有所提高。见表3。
3 讨论
目前ICC的诊断多依赖于影像学检查,但常误诊为HCC,且发现时多数已达中晚期。ICC和HCC的治疗有许多不同之处,尤其是手术方式,ICC为规则性肝切除,HCC主要进行局部切除[2],因此明确术前诊断对于确定有效治疗方案至关重要。本研究分析了术前两组患者血清学肿瘤标志物的差异,以期提高ICC的诊断率。
AFP是目前诊断HCC最常用的血清学指标,在ICC患者中升高不明显。近年来,AFP在鉴别HCC和ICC的应用中受到越来越多的关注[3-4]。本研究中,17例ICC患者中只有2例(11.8%)升高,与HCC组(72.9%)相比差异有统计学意义(P<0.05)。且AFP诊断ICC的特异性仅为19.4%,提示AFP是鉴别ICC和HCC的重要血清学指标之一。
CAl9-9是一种低聚糖类肿瘤相关抗原,分子量>50万,主要存在于胃肠或胰腺癌患者的组织中,正常人血清中含量甚微。研究表明,许多癌细胞都能分泌CAl9-9,包括胆管癌和结肠癌,目前临床上多用于胰腺癌和胆管癌的血清学诊断。恶性胆管组织中,CAl9-9抗原的表达与腺癌的分化程度成反比,在低分化胆管癌腺癌中的表达远高于高分化者[5]。CA19-9被认为是胆管癌最重要的血清学指标,本研究中,ICC组血清CAl9-9阳性率可达76.5%,特异性可达74.5%,CA19-9诊断ICC的敏感性和特异性均优于AFP对ICC的诊断。因此,CAl9-9对ICC的诊断具有一定价值。
CEA是一种细胞膜相关糖蛋白,分子结构非常复杂,且有多个抗原决定簇,除恶性肿瘤决定簇外,还有非特异性的交叉反应抗原(NCA)及胆汁糖蛋白-l(BGP-1)。故在正常人及非肿瘤患者体内也可检出CEA,可有假阳性,如酒精后肝硬化、溃疡性结肠炎、胆囊炎、胆结石、急性胰腺炎,甚至大量吸烟者,也可致浓度升高。CEA通常不表达于正常胆管组织中,且在恶性胆管组织中多表达于腺癌,而在腺鳞癌中表达量较低。高浓度CEA则主要见于结直肠癌[6]。本研究中,ICC组和HCC组血清CEA水平均明显升高,与正常对照组比较,差异具有统计学意义(P<0.05)。ICC组的血清CEA阳性率为64.7%,HCC组阳性率只有39.6%,提示CEA对于ICC和HCC的鉴别诊断具有辅助意义。
TK1和线粒体胸苷激酶(TK2)为同工酶,是胸苷激酶在细胞内存在的两种形式。TK1为四聚体,相对分子质量为96 000,是DNA合成中的关键酶之一,是嘧啶合成的补救酶,它催化胸苷(Tdr)磷酸化为胸苷-磷酸(TMP),进而形成的胸苷三磷酸(TTP-DNA合成中的4种必须脱氧核苷酸之一),参与DNA合成。并且这种磷酸化作用是DNA代谢中的惟一途径。TK1水平的升高和DNA的合成成正相关。在细胞周期中,TK1在G1期和S期交界处开始升高,直至S期达到高峰,至G2期开始下降。由于TK1与细胞周期S期的特殊相关性,又被称为S期关键酶。TK1水平取决于细胞的增殖度,与细胞增殖密切相关,是细胞周期依赖性标志物。在肿瘤细胞中,这种高TK1水平从S晚期可持续到M早期,其浓度将伴随着肿瘤细胞的急剧增殖而升高。一旦癌变,TK1的活性和含量都将升高,可超过正常水平的2100倍,正常成人细胞中含量极低。TK2的活性只有TK1的5%,在增殖细胞中含量很低。在乳腺癌和肺癌患者的研究中发现,TK1是用于监测肿瘤治疗效果的有价值的标记物,已经作为肿瘤细胞的血清学标志物,在乳腺癌、肺癌等恶性肿瘤中已有相关研究[7]。本研究中,我们首次使用TK1作为HCC和ICC的肿瘤标志物,检测HCC患者48例,TK1浓度为(2.96±3.27)pmol/L;ICC患者17例,TK1浓度为(2.21±4.64)pmol/L;健康人50例,TK1浓度为(1.17±0.62)pmol/L。HCC和ICC患者均明显高于健康人群,两者比较有统计学意义(P<0.05)。TK1诊断HCC的敏感度可达50%,特异性可达62.7%,仅次于AFP,表明TK1对HCC的诊断具有一定的意义。TK1在ICC组患者中阳性率明显低于HCC组,且TK1与AFP、CA19-9和CEA联合检测诊断ICC的敏感度可达78.2%,说明联合检测血清TK1、AFP、CA19-9和CEA对于HCC和ICC的鉴别诊断具有较高的价值。

表2 3组血清各项肿瘤标记物阳性率结果(n,%)
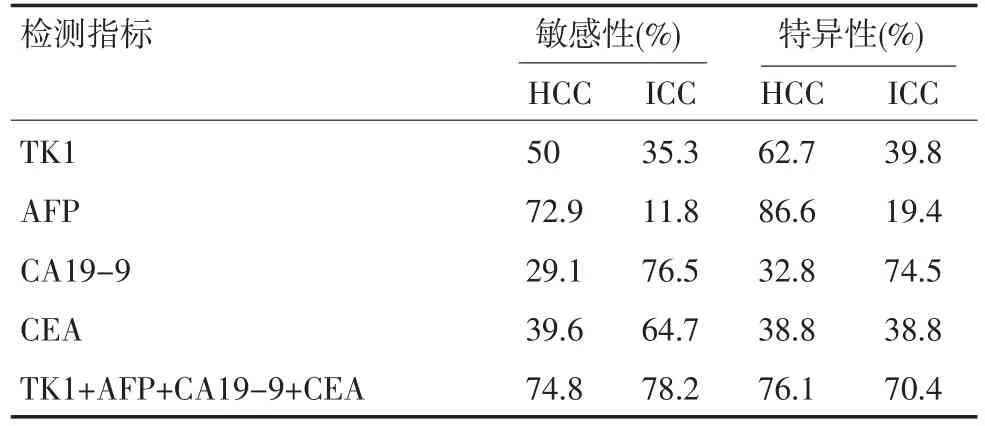
表3 四项肿瘤标记物诊断HCC和ICC的敏感性、特异性比较(%)
ICC的诊断需要综合多方面因素,如临床表现、实验室及影像学检查等。血清肿瘤标记物具有成本低,取样和检测简便等优势。但目前国内外尚未发现能够早期检测ICC的敏感性和特异性均令人满意的肿瘤标记物,而多项肿瘤标记物的联合检测可明显提高诊断ICC的敏感性和特异性,有助于ICC的诊断及与HCC的鉴别诊断。对于右上腹疼痛不适且影像学出现肝脏实性占位影像的患者,如出现血清AFP正常而TK1、CA19-9、CEA增高,应考虑到ICC的可能,进而选择正确合理的治疗,提高ICC患者的治疗效果及预后。
[1]Yachimski P,Pratt DS.Cholangiocarcinoma:natural history,treatment,and strategies for surveillance in high-risk patients[J].J Clin Gastroenterol,2008,42(2):178-190.
[2]周学平,杨广顺,卢军华,等.原发性肝癌切肝量的前瞻性研究[J].中华外科杂志,2005,43(21):1370-1374.
[3]Zhou YM,Yang JM,Li B,et a1.Clinicopathologic characteristics of intrahepatic cholangiocarcinoma in patients with positive serum a-fetoprotein[J].World J Gastroenterol,2008,14(14):2251-2254.
[4]Ishikawa K,Sasaki A,Haraguchi N,et a1.A case of an alpha-fetoprotein-producing intrahepatic cholangiocarcinoma suggests probable cancer stem cell origin[J].Oncologist,2007,12(3):320-324.
[5]Atkins CD.CA 19-9 and Lewis antigens in pancreatic cancer[J].J Clin Oncol,2009,27(15):2572-2573.
[6]胡敏华,陈燕,黄建英.肝癌患者癌胚抗原检测的临床意义[J].国际检验医学杂志,2006,27(1):10-11.
[7]Li HX,Lei DS,Wang XQ,et a1.Serum thymidine kinase 1 is a prognostic and monitoring factor in patients with non-small cell lung cancer[J].Oncol Rep,2005,13(1):145-149.
(收稿:2013-10-22 修回:2014-03-02)
(责任编辑 孔 棣)
Clinical Significance of Combined Detection of Serum Tumor Markers for Differential Diagnosis of In-trahepatic Cholangiocarcinoma and Hepatocellular Carcinoma
ZHAO Lin,CAO Meng-han,WANG Min-xian Department of Nuclear Medicine,Tianjin NanKai Hospital,Tianjin(300100),China
Objective To evaluate the expression of serum tumor marker TK1,AFP,CAl9-9 and CEA in intrahepatic cholangiocarcinoma(ICC)patients and hepatocellular carcinoma(HCC)patients to discuss the clinical significance of combined detection of these four markers.MethodsThe serum concentrations of AFP, CA19-9 and CEA were measured by automatic chemiluminescence immunoassay.That of TK1 was measured byenhanced chemiluminescence(ECL)and immunoblotting assay.ResultsSerum TK1,AFP,CAl9-9 and CEA in the HCC group were 2.96 pmol/L,24761.1 ng/mL,159.6 U/mL and 16.1 ng/mL respectively,while those in the ICC group were 2.21 pmol/L,39.1 ng/ml,289.8 U/mL and 27.9 ng/mL respectively.The serum concentrations of these four tumor markers were both higher in ICC and HCC groups compared with the control group (1.17 pmol/L,3.29 ng/ml,12.17 U/mL and 1.26 ng/mL).The diagnostic sensitivity of AFP for HCC was highest (72.9%),followed by TK1(50%).The diagnostic sensitivity of CA19-9 for ICC was highest(76.5%),followed by CEA(64.7%).ConclusionIt is practically valuable to assay TK1,AFP,CA19-9 and CEA in serum for differential diagnosis of ICC and HCC.
Tumor marker;quantitative detection;intrahepatic cholangiocarcinoma;hepatocellular carcinoma
R446.62
A
1007-6948(2014)02-0123-04
10.3969/j.issn.1007-6948.2014.02.005
天津市南开医院核医学科(天津 300100)
赵 琳,E-mail:linda800202@sina.com
