钙敏感受体通过ERK信号通路参与低氧诱导的人气道上皮细胞黏液高分泌
2014-03-15杨红菊尤列皮尔曼维克多科罗索夫周向东
杨红菊,尤列·皮尔曼,维克多·科罗索夫,周向东*
(1.重庆医科大学附属第二医院呼吸内科,重庆400010;2.俄罗斯医学科学院远东呼吸生理与病理研究所,俄罗斯布拉戈维申斯克675000)
气道黏液高分泌是慢性阻塞性肺疾病、支气管哮喘等慢性气道炎性反应疾病的重要临床表现和病理特征之一,亦是影响慢性气道炎性反应疾病患者病情变化及预后的独立危险因素[1-2]。气道的慢性炎性反应常致机体处于低氧状态,而低氧在黏蛋白(mucin,MUC)的过度分泌中有着重要作用。钙敏感受体(calcium-sensing receptor,CaSR)是G 蛋白偶联受体C 家族的Ⅱ型受体,在人气道上皮细胞亦有表达[3]。低氧条件下CaSR可被诱导活化,活化后可经细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路介导机体发生一系列重要的病理生理反应[4-5],而MEK/ERK1/2 信号通路是介导气道黏液高分泌的重要通路[6-7],由此设想CaSR 可否通过MEK/ERK1/2 信号通路介导气道黏液高分泌?实验中经低氧条件孵育16HBE 细胞,并转染CaSR-siRNA及给予ERK 通路特异性抑制剂U0126 预处理细胞,探讨CaSR/MEK/ ERK1/2 信号通路在低氧诱导的气道黏液高分泌中的作用,以进一步明确气道黏液高分泌的发生机制。
1 材料与方法
1.1 材料与试剂
正常人气道上皮细胞16HBE(广州呼吸病研究所提供);DMEM/ F12 培养基和胎牛血清(Hyclone 公司);小鼠抗p-ERK、ERK、CaSR 多克隆抗体和辣根过氧化物酶-羊抗小鼠抗体(Santa Cruz 公司);小鼠抗MUC5AC 45MI 单克隆抗体(Neomarke公司);Lipofectamine 2000、阴性对照siRNA 和CaSR-siRNA(Invitrogen 公司);ERK 信号通路特异性抑制剂U0126(Calbiochem 公司);第一链cDNA合成试剂盒(Tarkra 公司);MUC5AC ELISA 试剂盒(R&D 公司)。
1.2 方法
1.2.1 细胞培养、处理及分组:16HBE 细胞于6 孔板中培养,细胞约接种4 ×105个/孔,加入2 mL 含10%胎牛血清的DMEM/F12 培养液,置于37 ℃、5% CO2、95%空气的细胞培养箱内孵育,隔天换液,待细胞汇合达80%时传代并分组,每组均设置5 个复孔:A 组(对照组):在不含胎牛血清的基础DMEM/F12 培养液中培养24 h 后,常氧下培养24 h;B 组(低氧组):在无血清的培养液中培养24 h后,低氧培养箱(37 ℃,94% N2-1% O2-5% CO2)内培养24 h;C 组(CaCl2组+ 低氧组):无血清培养24 h,加入2.5 mmol/L CaCl2预处理细胞30 min 后置于低氧箱内培养24 h;D 组(对照siRNA + 低氧组):无血清培养24 h,对照siRNA 转染细胞后置于低氧箱内培养24 h;E 组(CaSR-siRNA 组+ 低氧组):无血清培养24 h,CaSR-siRNA 转染细胞后置于低氧箱内培养24 h;F 组(ERK1/2 抑制剂+ 低氧组):无血清培养24 h,加入10 μmol/L U0126 预处理细胞30 min 后置于低氧箱内培养24 h;培养结束后分别收集每组的细胞和上清液行相关检测,每组实验重复3 次。
1.2.2 细胞转染:调整细胞浓度为1 × 105~2 ×105/L,正常条件下孵育12 h,待细胞生长汇合至70% ~80%进行转染,操作步骤按照Lipofectamine 2000 说明书进行。
1.2.3 MTT 法检细胞活力:在96 孔板中按照每孔细胞浓度为1 ×104/mL 加入细胞悬液200 μL,培养24 h 后将细胞置于低氧培养箱内培养,分别于0、6、12、24 和48 h 时间点对细胞进行MTT 测定。在每孔中加入20 μLMTT 液(5 g/L),继续培养4 h 后吸弃上清液,于每孔中加入150 μL 二甲基亚砜,低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪490 nm 波长处测量各孔的吸光度值(A),每组实验重复3 次。
1.2.4 RT-PCR 检测MUC5AC mRNA:各实验组均采用Trizol 法提取细胞内总RNA,以两步法行RTPCR。MUC5AC 上游引物为5'-TGTTCTATGAGGGC TGCGTCT-3',下游引物为5'-ATGTCGTGGGACGC ACAGA-3';GAPDH 上游引物为5'-CTCAACTACATG GTCTACATG-3',下游引物为5'-TGGCATGGACTG TGGTCATGAG-3'。在灭菌离心管中依次加入下列试剂:氯化镁(2 5 mmol/L)4.0 μL、5 ×PrimeSTARTM缓冲液4.0 μL、dNTP(10 mmol/L)4.0 μL、上下游引物各引物1.0 μL、cDNA 2.0 μL、Taq 酶(5 ×106U/L)0.5 μL,定容至50.0 μL,轻轻混匀后行PCR 扩增。94 ℃预变性3 min,后随35 个循环,循环参数:94 ℃变性45 s,54 ℃退火30 s,70 ℃延伸60 s,72℃最后延伸5 min 补齐末端。PCR 扩增产物经2%琼脂糖凝胶电泳鉴定,并与GAPDH 条带吸光度的比值作为目的基因mRNA 的相对含量。
1.2.5 ELISA 法检测MUC5A 分泌水平:吸取各组细胞培养上清液100 μL,于40 ℃包被96 孔酶标反应板,干燥,PBS 液清洗酶标板3 次,2%小牛血清室温封闭1 h;再次PBS 洗板3 次,加入小鼠抗MUC5AC 45MI 单克隆抗体(1 ∶100,用含0.05%Tween-20 的PBS 稀释至50 μL)孵育1 h;洗板3 次,加入辣根过氧化物酶-羊抗小鼠IgG(1∶10 000)孵育1 h,洗板后扣干,四甲基联苯胺过氧化物酶显色,终止反应后在波长450 nm 处测各孔A 值,与标准品比较计算MUC5AC 的相对含量。
1.2.6 Western blot 检测CaSR、ERK、p-ERK 的蛋白相对含量:提取各组细胞总蛋白,使用细胞裂解液,置冰上吹打20 min,于4 ℃12 000 r/min 离心15 min(离心半径13.5 cm),上清液经含8%聚丙烯酰胺的SDS-PAGE 电泳分离,恒流250 mA 转膜240 min至硝酸纤维膜,脱脂奶粉封闭1 h,再分别与小鼠抗CaSR 多克隆抗体、小鼠抗ERK 多克隆抗体、小鼠抗p-ERK 多克隆抗体(均为1∶1 000,1 mg/L)室温孵育2 h、洗膜后加入辣根过氧化物酶标记的二抗(1∶10 000)孵育2 h,洗膜后用增敏化学发光法显色,分析目的条带与内参照β-actin 条带的积分吸光度值及其比值。
1.3 统计学分析
2 结果
2.1 细胞存活率测定
短时间低氧处理对16HBE 细胞无明显损伤,随着低氧处理时间的延长,细胞贴壁能力逐渐降低,细胞凋亡逐渐增加,细胞存活率降低(图1)。

图1 MTT 法测定低氧对细胞存活率的影响Fig 1 MTT assay measured the influence of hypoxia on cell survival rate(±s,%,n=3)
2.2 CaSR 在16HBE 细胞的表达
经CaSR-siRNA 转染后CaSR 的蛋白水平较对照siRNA 组显著降低,提示CaSR-siRNA 转染成功(图2)。

图2 Western blot 检测CaSR 蛋白的表达水平Fig 2 The protein levels of CaSR detected by Western blot
2.3 ERK 及p-ERK 蛋白的表达
与对照组相比,低氧组p-ERK 的蛋白相对含量明显增加(P<0.05);CaSR 的激动剂CaCl2可进一步上调低氧引起的p-ERK 蛋白相对含量的增加(P<0.05);转染CaSR-siRNA 及施加ERK1/2 抑制剂明显抑制低氧引起的p-ERK 蛋白相对含量的增加(P<0.05),而ERK1/2 的蛋白相对含量在各组未见明显变化(图3,表1)。

图3 各组细胞ERK1/2 及p-ERK1/2 的蛋白相对含量Fig 3 Relative protein expression of ERK and p-ERK in each group
表1 各组细胞ERK1/2 及p-ERK1/2 蛋白水平的比较Table 1 The protein levels of ERK and p-ERK in each group(±s,n=5)

表1 各组细胞ERK1/2 及p-ERK1/2 蛋白水平的比较Table 1 The protein levels of ERK and p-ERK in each group(±s,n=5)
#P<0.05 compared with control group;*P<0.05 Compared with hypoxia group.
groupERK1/2p-ERK1/2 control0.33 ±0.090.27 ±0.04 hypoxia0.36 ±0.050.63 ±0.11#CaCl2 +hypoxia0.38 ±0.120.89 ±0.06*negative-siRNA +hypoxia0.35 ±0.030.61 ±0.03 CaSR-siRNA + hypoxia0.37 ±0.080.36 ±0.07*U0126 + hypoxia0.34 ±0.060.33 ±0.05*
2.4 CaSR 对MUC5AC mRNA 表达及蛋白分泌水平的影响
与对照组相比,低氧组MUC5AC 转录水平及蛋白分泌水平明显增加(P<0.01),CaSR 的激动剂CaCl2可进一步增加低氧引起的上述作用(P<0.01),转染CaSR siRNA 及施加ERK1/2 抑制剂明显抑制低氧引起的上述效应(P<0.05)(图4,表2)。
3 讨论
CaSR 是G 蛋白耦联受体超家族的成员之一,其是由1 078 个氨基酸组成的多肽,主要包括氨基胞外端、7 次跨膜区、胞内羧基端3 个结构区域[8]。1993年首次在牛甲状旁腺中克隆出CaSR[9],随后发现其在肺主要表达于人气道上皮细胞,此外肺静脉、肺动脉平滑肌细胞、肺腺癌细胞、肺泡巨噬细胞等亦有表达[3,10],在介导肺部炎性反应、肺鳞状细胞癌、肺动脉高压[10-12]等方面有重要作用。
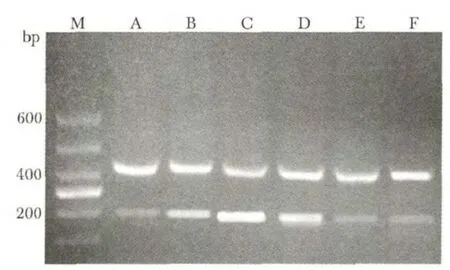
图4 各组细胞MUC5AC mRNA 的表达Fig 4 Expression of MUC5AC mRNA in each group
表2 各组MUC5AC mRNA 表达和蛋白分泌量检测结果Table 2 Expression of MUC5AC mRNA and secretion of MUC5AC protein in each group(±s,n=5)

表2 各组MUC5AC mRNA 表达和蛋白分泌量检测结果Table 2 Expression of MUC5AC mRNA and secretion of MUC5AC protein in each group(±s,n=5)
#P<0.01 compared with control group;*P<0.05 compared with hypoxia group.
groupMUC5AC mRNAMUC5AC control0.18 ±0.040.25 ±0.06 hypoxia0.51 ±0.03#0.56 ±0.07#CaCl2 +hypoxia0.76 ±0.07*0.84 ±0.05*negative-siRNA+hypoxia0.49 ±0.050.53 ±0.02 CaSR-siRNA+hypoxia0.26 ±0.06*0.33 ±0.04*U0126 +hypoxia0.24 ±0.02*0.31 ±0.08*
众多慢性气道炎性反应疾病的重要临床病理特征即为气道黏液高分泌,而气道黏液高分泌形成的主要原因是黏蛋白MUC5AC 的过度生成和分泌,低氧却在上调黏蛋白过度生成和分泌中发挥重要作用,故研究低氧条件下MUC5AC 的合成分泌具有重要的临床意义。实验中也发现在低氧环境下,MUC5AC 的转录及分泌水平显著增加。同时实验证实了16HBE 细胞中有CaSR 的表达,转染CaSR-si RNA 后,明显抑制了MUC5AC 的转录及分泌,由此推测低氧可诱导CaSR 活化,从而介导气道黏液高分泌。细胞外钙离子是CaSR 的主要激动剂,实验中用CaCl2预处理细胞后,MUC5AC 的分泌量进一步增加,从而验证了CaSR 在低氧诱导的气道黏液高分泌中的作用。ERK1/2 是分裂原激活的蛋白激酶家族的成员之一,包括ERK1 和ERK2,属于丝/苏氨酸蛋白激酶,细胞外的刺激可经表皮生长因子受体、G 蛋白偶联受体、酪氨酸蛋白激酶受体等经由MEK/ERK1/2 途径激活ERK,从而调节许多转录因子和激酶的活性。实验发现低氧可通过CaSR 激活ERK1/2 并使其磷酸化水平增加,抑制ERK1/2 和CaSR 后ERK1/2 的磷酸化水平显著降低,并伴随MUC5AC 分泌量的减少,而CaSR 的激动剂则可增加p-ERK1/2 以及MUC5AC 的分泌水平,提示低氧诱导的气道黏液高分泌可能是由CaSR/MEK/ERK1/ 2 信号通路所介导。
实验研究探讨了低氧通过活化CaSR 引起气道黏液高分泌的信号通路,初步证实了CaSR 在气道黏液高分泌中的作用,而下一步将侧重于对其下游信号通路的研究,以期全面认识该通路的信号分子及效应元件。
[1]雷蕊霞,周向东.血红素加氧酶-1 对人气道黏液高分泌的影响[J].基础医学与临床,2010,30:246-251.
[2]钟甜,尤列·皮尔曼,维克多·科罗索夫,等.呼吸机机械通气对兔气道黏蛋白表达的影响[J].基础医学与临床,2011,31:118-123.
[3]Milara J,Mata M,Serrano A,et al.Extracellular calciumsensing receptor mediates human bronchial epithelial wound repair[J].Biochem Pharmacol,2010,80:236-246.
[4]Li GW,Xing WJ,Bai SZ,et al.The calcium-sensing receptor mediates hypoxia induced proliferation of rat pulmonary artery smooth muscle cells through MEK1/ERK1,2 and PI3K pathways[J].Basic Clin Pharmacol Toxicol,2011,108:185-193.
[5]Ward DT.Calcium receptor-mediated intracellular signalling[J].Cell Calcium,2004,35:217-228.
[6]Li N,Li Q,Zhou XD,et al.The effect of quercetin on human neutrophil elastase-induced mucin5AC expression in human airway epithelial cell[J].Int Immunopharmacol,20 12,14:195-201.
[7]吴小玲,周向东.气道黏液高分泌的信号传导通路[J].基础医学与临床,2008,28:1142-1145.
[8]Conigrave D,Quinn SJ,Brown EM.Cooperative multi-modal sensing and therapeutic implications of the extracellular Ca2+-sensing receptor[J].Trends Phannacol Sci,2000,21:401-407.
[9]Brown EM,Gamba G,Riccardi D,et al.Cloning and characterization of all extracellual Ca2+-sensing receptor from bovine extracellual parattlyroid[J].Nature,1993,366:575-580.
[10]Cortijo J,Milara J,Mata M,et al.Nickel induces intracellular calcium mobilization and pathophysiological responses in human cultured airway epithelial cell[J].Chem Biol Interact,2010,183:25-33.
[11]Yamamura A,Guo Q,Yamamura H,et al.Enhanced Ca(2+)-sensing recetor function in idiopathic pulmonary arterial hypertension[J].Circ Res,2012,111:469-481.
[12]Lorch G,Viatchenko-Karpinski S,Ho HT,et al.The calcium-sensing receptor is necessary for the rapid development of hypercalcemia in human lung squamous cell carcinoma[J].Neoplasia,2011,13:428-438.
