双烯雌酚纯度标准物质的定值与不确定度评定*
2014-03-15姜峰王志龙王巧云申玉星
姜峰 王志龙 王巧云 申玉星
(1.华南理工大学化学与化工学院,广东广州510640;2.广州计量检测技术研究院,广东广州510030)
Dodds[1]于1938年首次合成了双烯雌酚(Dienestrol,DIEN),随后人们又对其合成制备[2]、电子密度[3]和生物代谢效应[4]等进行了详细的研究.双烯雌酚作为一种常见的人工合成非甾类雌激素,从20世纪60年代起作为重要的生长促进剂,曾经广泛使用于畜牧业和水产业,以促进动物蛋白质沉积和快速增重[5-7].相对于天然雌激素,合成雌激素较为稳定,易在动物脂肪和组织内残留,进而通过食物链危害人类健康[8].
由于此类激素存在潜在致癌和致畸风险[9-11],欧盟相关法规96/22/EC已禁止将其用于畜牧生产,并对其在动物性食品中的残留进行监控;我国也出台了多项标准 (GB/T 20766—2006,GB/T 20767—2006等)严格控制其在食品中的残留.由于双烯雌酚的检测方法繁杂而多样[12-13],因此,双烯雌酚纯度标准物质的开发和使用对保证临床检验、食品安全、环境保护等相关检测的准确性、可比性和溯源性具有重要意义.文中介绍了双烯雌酚纯度标准物质的研制过程,对双烯雌酚纯度标准物质的物化性质进行了分析,并对标准物质的不确定度进行了详细评定.
1 实验
1.1 主要仪器与试剂
1200型高效液相色谱仪(配二极管阵列检测器)、7890A型气相色谱仪(配火焰离子化检测器),ZORBAX Eclipse XDB-C18 9.4 mm×250 mm×5 μm型半制备液相色谱柱,美国 Agilent公司生产;Bru ker/Agilent 1290-microTOF QII型液相色谱-质谱联用仪,德国 Bruker公司/美国 Agilent公司生产; 400MHz核磁共振仪,德国 Bruker公司生产;Spectrum Two型红外光谱仪,美国珀金埃尔默仪器(上海)有限公司生产;831 KF型卡氏水分仪,瑞士万通公司生产;AAF11/18型马弗炉,英国Carbolite公司生产;双烯雌酚原料,上海紫一试剂厂生产;乙腈,德国MERK公司生产,色谱纯;其他试剂均为分析纯;实验用水为二次去离子水.
1.2 双烯雌酚高纯原料化合物的制备
采用半制备高效液相色谱法通过多次制备得到双烯雌酚高纯原料化合物.将双烯雌酚原料(HPLC归一化法纯度约为94.00%)于乙腈中超声溶解,配制成质量浓度为35 g/L的样品备用;再经半制备型HPLC制备分离,收集保留时间10.0~12.0 min的馏分,离心旋蒸浓缩,冷冻干燥得到白色粉末;将制备得到的化合物作为双烯雌酚高纯原料化合物.半制备色谱条件:ZORBAX Eclipse XDB-C18 9.4mm× 250mm×5 μm型半制备型色谱柱,柱温为室温,检测波长230nm,流速4mL/min,流动相为乙腈与水体积比为1∶1的混合液,进样量100 μL,分析时间16min,进样方式为Agilent标准自动进样器自动进样;收集方式为手动收集.
1.3 双烯雌酚高纯原料化合物的定性分析
采用液相色谱-质谱联用法,核磁共振氢谱、碳谱法和红外光谱法对制得的原料化合物进行定性分析.
1.4 双烯雌酚纯度标准物质中有机主成分含量的测定
根据标准物质研制技术规范ISO Guide 34和ISO Guide 35的要求,选用高效液相色谱法并联合多家实验室对双烯雌酚纯度标准物质中的有机主成分含量进行测定.通过实验优化,在保证分离的前提下,选择杂质与主体成分吸收都比较好的波长作为检测波长.实验采用 Agilent 1200型液相色谱仪,ZORBAX Eclipse XDB-C18 4.6 mm×250 mm×5μm色谱柱,流动相为乙腈与水体积比为70∶30的混合液,检测器为二极管阵列检测器(DAD),检测波长为220、230、239、260nm,定值波长为230nm.共有7家实验室参加,每家实验室7瓶样品(每瓶样品测量3次,所有纯度结果均为HPLC归一化结果),每家实验室分别给出1-7瓶样品的测量平均值.
1.5 双烯雌酚纯度标准物质的均匀性检验
依据标准物质研制相关技术规范,抽取15个包装,做瓶间和瓶内均匀性检验(每个包装样品测3次).实验采用Agilent 1200型液相色谱仪,ZORBAX Eclipse XDB-C18 4.6mm×250mm×5μm色谱柱流动相为乙腈与水体积比为70∶30的混合液,检测器为二极管阵列检测器(DAD),检测波长为230nm.
1.6 双烯雌酚纯度标准物质的稳定性检验
稳定性检验按先密后疏的原则,取6个包装,每个包装测量3次,取平均值,得到稳定性检验时间点纯度含量数据.实验条件同1.5节。
1.7 双烯雌酚纯度标准物质中水分、金属元素、灰分及挥发性物质含量的分析
采用卡氏水分仪(卡尔费休容量法)测定标准物质中的水分含量,测量10次取平均值;采用ICPOES测定Al、As、Ba、Be、B、Cd、Ca、Ce、Cs、Cr、Co、Cu、Dy、Er、Eu、Gd、Ga、Ho、Fe、La、Pb、Lu、Mg、Mn、Nd、Ni、P、K、Pr、Rb、Sm、Se、Ag、Na、Sr、S、Tl、Th、Tm、U、V、Yb共42种无机金属元素的含量;采用GCFID检测标准物质中的挥发性物质;采用灼烧灰化质量差法测定标准物质中的灰分含量.
2 结果与分析
2.1 双烯雌酚高纯原料化合物的定性分析结果
双烯雌酚高纯原料化合物的质谱图如图1所示.由图1可见,目标组分分子离子峰(M+H)+的质荷比m/z为267.1284,非常接近于双烯雌酚相对分子质量(266.1307)加上氢原子量(1.0000),由此可以确定双烯雌酚高纯原料化合物与双烯雌酚具有相同的分子质量.
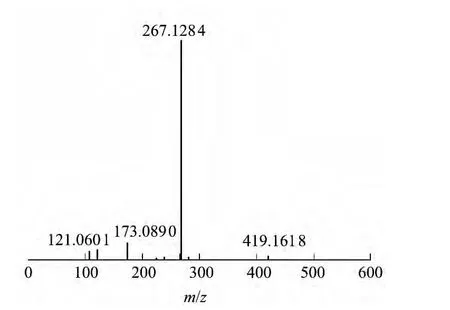
图1 双烯雌酚高纯原料化合物的质谱图Fig.1 MS spectrum of high-purity raw material of dienestrol
双烯雌酚高纯原料化合物的1HNMR和13CNMR谱如图2所示.通过对1HNMR谱图的分析,发现有5组化学环境不同的特征氢,它们与双烯雌酚的氢原子个数和空间耦合关系完全相符.通过对13CNMR谱图的分析,7组碳原子的数量与化学位移同双烯雌酚完全相符.

图2 双烯雌酚高纯原料化合物的1HNMR和13CNMR谱图Fig.2 1HNMR and13CNMR spectra of high-purity raw material of dienestrol
最后通过双烯雌酚高纯原料化合物和双烯雌酚标准物质的红外光谱图(见图3(a)和3(b))的比较,再次确认双烯雌酚高纯原料化合物为目标化合双烯雌酚,结构式如图4.
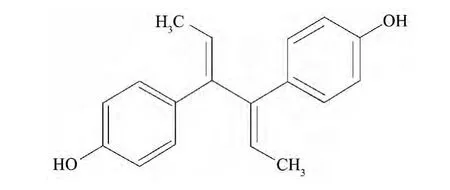
图4 双烯雌酚的分子结构Fig.4 Molecular structure of dienestrol
2.2 双烯雌酚纯度标准物质中有机主成分含量的测定结果
采用高效液相色谱法并联合多家实验室对双烯雌酚纯度标准物质中有机主成分的含量进行测定,并分别利用柯克伦检验[9]和狄克逊检验[9]对7家实验室的数据进行检验,结果如表1所示.由表1所示结果可知实验数据无可疑值,由多家实验室合作测量确定的双烯雌酚纯度标准物质中的有机主成分的含量为99.52%.

表1 双烯雌酚纯度标准物质有机主成分含量的多实验室合作测定结果Table 1 Multi-lab measurement results of organic principal components in certified reference material for purity determination of dienestrol
2.3 双烯雌酚纯度标准物质的均匀性检验结果
标准物质均匀性是标准物质最基本的属性,是标准物质特性量值在空间分布一致程度的表征.标准物质的均匀性通常用差方分析法来检验.具体检验方法如下:
通过随机抽取一定数量的样品,采用相同的试验方法,在同样的实验条件下得m组等精度测量数据如下:

(m)xm1,xm2,…,xmnm,平均值;
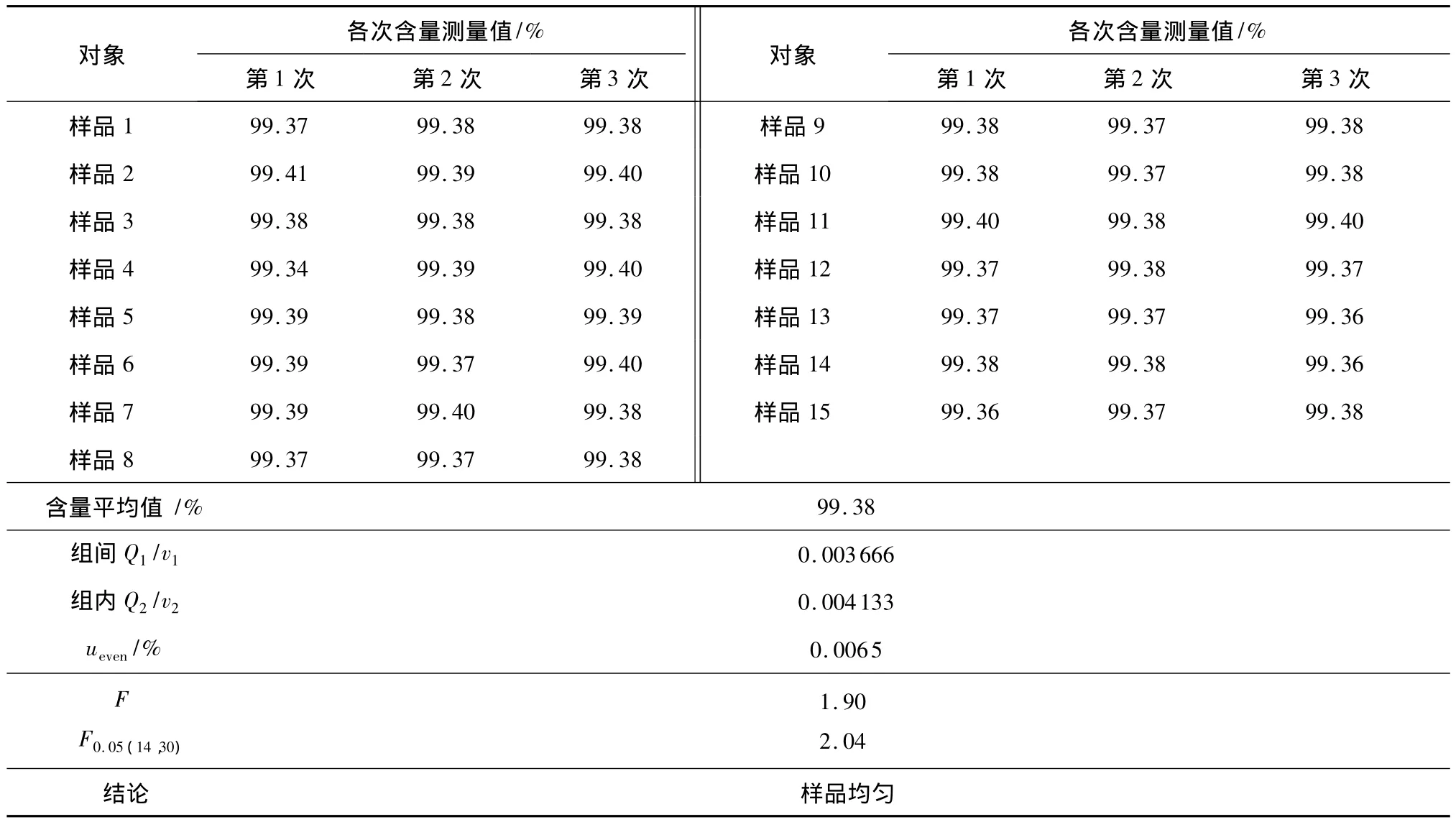
表2 双烯雌酚纯度标准物质均匀性检验结果Table 2 Homogeneity testi results of certified reference material for purity determinootion of dienestrol
2.4 双烯雌酚纯度标准物质的稳定性检验结果
根据测得的纯度含量数据绘制标准物质纯度特性量值随时间变化的图,拟合回归曲线,用该曲线斜率的显著性来评估标准物质的稳定性,该方法为趋势分析法.分析方法如下:设时间对特性量值的直线方程为y=b0+b1x,斜率分别是时间与特性量值.截距;直线的标准偏差,斜率的标准偏差(即斜率的不确定度);当置信度水平取95%时,-0<t0.95,n-2·s(b1),表明标准物质的稳定性良好.稳定性检验结果如表3所示,从表中数据看,在1年时间内,检测数据组间和各时间点数据无显著性差异,双烯雌酚的纯度值变化差异不大.经趋势分析,时间与特性量值的回归趋势线的斜率b1为 -0.000 279 0,t0.95,n-2·s(b1)为0.003 141,即︱b1︱<t0.95,n-2·s(b1),因此斜率估计值不显著,表示双烯雌酚纯度标准物质的纯度没有发生显著性变化.稳定性引入的不确定度为ustable=0.012%.
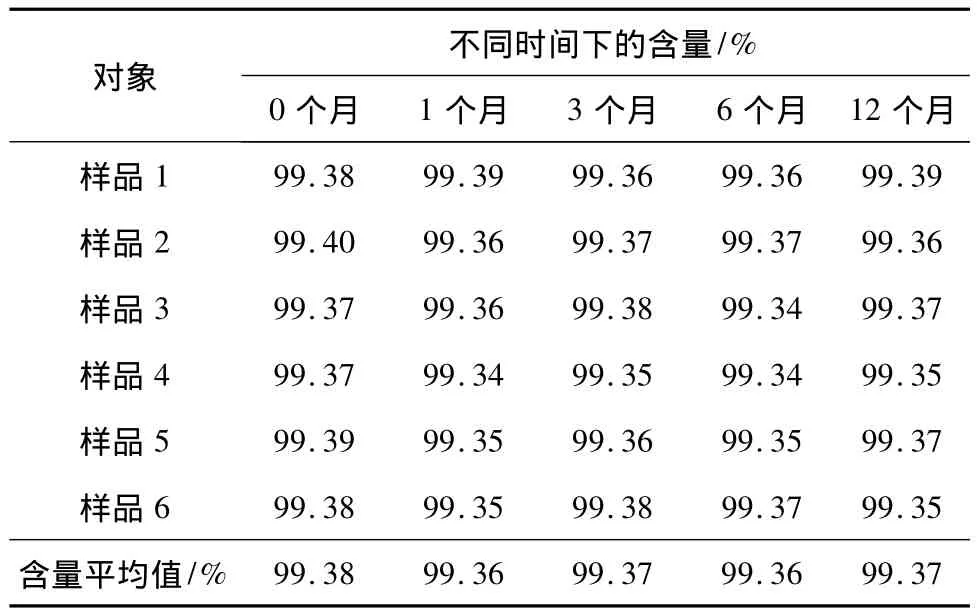
表3 双烯雌酚纯度标准物质的稳定检验结果Table 3 Stability test results of certified reference material for purity determination of dienestrol
2.5 双烯雌酚纯度标准物质中水分、金属元素、灰分及挥发性物质含量的分析结果
经测定,双烯雌酚纯度标准物质中水分含量为0.03000%,灰分含量为0.001000%,Al、As、Ba、Be、B、Cd、Ca、Ce、Cs、Cr、Co、Cu、Dy、Er、Eu、Gd、Ga、Ho、Fe、La、Pb、Lu、Mg、Mn、Nd、Ni、P、K、Pr、Rb、Sm、Se、Ag、Na、Sr、S、Tl、Th、Tm、U、V、Yb等共42种无机金属元素含量为0.00007900%,未检出双烯雌酚纯度标准物质中含有无紫外吸收的挥发性物质.
3 双烯雌酚纯度标准物质的不确定度评定
[15]中的方法对双烯雌酚纯度标准物质进行不确定度评定.主要的不确定度来源于多家实验室联合测定双烯雌酚纯度标准物质时的有机主成分含量以及均匀性与稳定性检验,在此基础上最终合成了标准物质的不确定度.
3.1 有机主成分含量测定引入的不确定度
多家实验室联合测定双烯雌酚纯度标准物质中的有机主成分含量时所引入的不确定度由3部分组成:将合作实验室的平均值作为一组新的测量值,该组测量值的相对标准偏差作为不确定度来源之一,即u1=0.27%;多家合作测量所用的方法的重复性,取各家测量结果中最大的相对标准偏差,即u2= 0.045%;合作测量所用的方法(即液相色谱法)的响应因子引入的相对标准不确定度u3.u3按下式进行量化:
u3-i=Rimax,-Riset,,
其中,Rimax,表示各组分在不同波长下的最大响应值,Riset,表示目标组分在设定的检测波长下的响应值,i表示检测波长.
假设由各组分在不同波长下的响应差异引入的不确定度呈均匀分布,则u3可计算如下:

双烯雌酚纯度标准物质在不同波长下的检测结果如表4所示.由表4所示结果计算可得u3=0.11%.

表4 双烯雌酚纯度标准物质在不同波长下的检测结果Table 4 Test results at different wavelengths of purity certified reference material for purity determination of dienestrol
3.2 相对合成不确定度
由于双烯雌酚纯度标准物质中的水分、灰分、无机元素、挥发性物质含量均小于0.1%,其不确定度可忽略不计.因此标准物质的最终不确定度由3部分组成,即:标准物质中有机主成分含量测定所引入的不确定度(u1,u2,u3)、标准物质均匀性引入的不确定度ueven和标准物质稳定性引入的不确定度ustable.
双烯雌酚纯度标准物质的相对合成不确定度按下式计算:
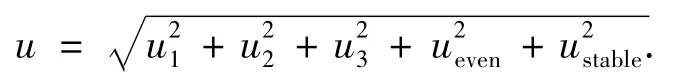
将u1、u2、u3、ueven、ustable的取值代入式中计算得u=0.30%.
3.3 相对扩展不确定度
双烯雌酚纯度标准物质的相对扩展不确定度计算如下:

3.4 双烯雌酚纯度标准物质的定值结果
双烯雌酚纯度标准物质的最终纯度由质量平衡法来确定.质量平衡法要求首先确定样品中各种杂质的含量,包括非挥发性杂质(有机杂质)、水分、挥发性溶剂和灼烧残渣等,再从总物质中减去上述杂质得到该物质的含量,可以直接溯源到国际单位制(SI)中质量单位(kg),是一种潜在的基准方法[16].
文中测定的双烯雌酚纯度标准物质中有机主成分含量(Po)为99.52%,水分含量(Xw)为0.03000%,灰分含量(Xa)为0.001 000%,无机金属元素含量(Xe)为0.00007900%,挥发性物质(Xv)含量为0.根据质量平衡法确定标准物质最终纯度为
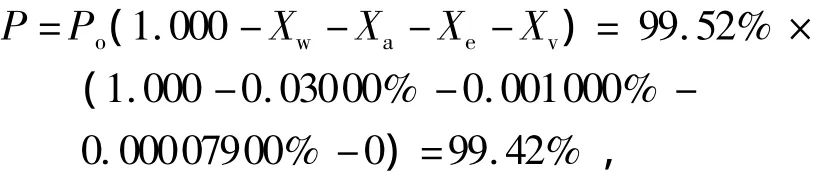
修约为99.4%.
故此,文中研制的双烯雌酚纯度标准物质定值结果为99.4%,扩展不确定度为0.6%(k=2).
4 结论
文中通过半制备高压液相色谱法制备了双烯雌酚纯度标准物质,采用液相色谱-质谱联用法、核磁共振氢谱、碳谱法和红外光谱法对制得的原料化合物进行了定性分析,采用多家实验室联合定值法对双烯雌酚纯度标准物质中的有机主成分含量进行了测定,对双烯雌酚纯度标准物质的均匀性、稳定性、水分含量、灰分含量、挥发性物质含量、无机金属元素含量进行了分析,并对双烯雌酚纯度标准物质的不确定度进行了评定,得出以下主要结论:
(1)研制的双烯雌酚纯度标准物质均匀性良好
(2)1年内,研制的双烯雌酚纯度标准物质纯度变化不大,稳定性较好;
(3)研制的双烯雌酚纯度标准物质中的水分、灰分、无机元素、挥发性物质含量均小于0.1%;
(4)研制的双烯雌酚纯度标准物质定值结果为99.4%,扩展不确定度为0.6%(k=2).
参考文献:
[1] Dodds E C,Goldberg L,Lawson W,et al.Oestrogenic activity of certain synthetic compounds[J].Nature,1938,141(3562):247-248.
[2] Metzler M.Synthesis of diethylstilbestrol metabolites:ωhydroxy-dienestrol and derivatives[J].Tetrahedron,1978,34(20):3113-3117.
[3] Yearley E J,Elizabeth A Z,Vladimir V Z,et al.Experimental electron density studies of non-steroidal synthetic estrogens:Diethylstilbestrol and dienestrol[J].Journal of Molecular Structure,2008,890(1/2/3):240-248.
[4] Chae K,Lindzey J,McLachlan J A,et al.Estrogen-dependent gene regulation by an oxidative metabolite of diethylstilbestrol,diethylstilbestrol-4',4″-quinone[J].Steroids,1998,63(3):149-157.
[5] Aman C S,Pastor A,Cighetti G,et al.Development of a multianalyte method for the determination of anabolic hormones in bovine urine by isotope-dilution GC-MS/MS[J].Analytical and Bioanaly tical chemistry,2006,386 (6):1869-1879.
[6] Pandian T J,Sheela S G.Hormonal induction of sex reversal in fish[J].Aquaculture,1995,138:1-22.
[7] Piferrer F.Endocrine sex control strategies for the feminization of teleost fish[J].Aquaculture,2001,197(1/2/3/ 4):229-281.
[8] 邓省亮,李平,邱静,等.双烯雌酚人工抗原的合成及特异性抗体的制备[J].免疫学杂志,2011,27(3): 250-258. Deng Sheng-liang,Li Ping,Qiu-Jing,et al.Synthesis of artificial antigens and preparation of specific antisera against dienestrol[J].Immunological Journal,2011,27(3):250-258.
[9] Adami H O,Lagiou P,Trichopoulos D.Breast cancer following diethylstilbestrol exposure in utero:insights from a tragedy[J].European Journal of Epidemiology,2012,27 (1):1-3.
[10] Vähäkangas K.Chemical exposure as etiology in developmental origin of adult onset human cancer[J].Front Pharmacol,2011,2:62.
[11] Newbold R R.Lessons learned from perinatal exposure to diethylstilbesterol[J].Toxicol Appl Pharmacol,2004,199(2):142-150.
[12] Alesha D L,Kevin A S.A review of separation methods for the determination of estrogens and plastics-derived estrogen mimics from aqueous systems[J].Analytica Chimica Acta,2011,696(1/2):6-26.
[13] 李平,于洪侠,杨曙明.双烯雌酚残留检测方法研究进展[J].中国兽药杂志,2010,44(2):41-45. Li Ping,Yu Hong-xia,Yang Shu-ming.Advances in research on dienestrol residue analytical technique[J].Chinese Journal of Veterinary Drug,2010,44(2):41-45.
[14] 全国标准物质管理委员会.标准物质的研制 管理与应用[M].北京:中国计量出版社,2010.
[15] 苏福海,全灿,王海峰,等.睾酮甲醇溶液标准物质的定值及不确定度评定[J].分析测试学报,2010,29 (11):1211-1215. Su Fu-hai,Quan Can,Wang Hai-feng,et al.Certification of testosterone methanol solution and Its uncertainty evaluation[J].Journal of Instrumental Analysis,2010,29(11):1211-1215.
[16] Richter W.Primary methods of measurement in chemical analysis[J].Accreditation and Quality Assurance,1997,2(8):53-354.
