石墨烯吸附材料的制备与应用研究进展
2014-03-15杨胜韬赵连勤
杨胜韬, 赵连勤
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
石墨烯吸附材料的制备与应用研究进展
杨胜韬, 赵连勤
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
石墨烯具有独特的结构、优异的性能, 在诸多领域有广泛的应用. 石墨烯层的原子均为表面原子, 其表面积非常大, 是天然的吸附材料. 其易于制备、成本低廉等优势使得石墨烯吸附材料成为水处理研究中的热点. 石墨烯及其复合材料已经在重金属、染料、杀虫剂、抗生素、石油等污染物的治理方面得到应用. 综述了石墨烯吸附材料的制备方法以及其在污水处理方面的应用. 分析了污染物在石墨烯吸附材料上的吸附行为, 并讨论了石墨烯与污染物的相互作用.着重关注官能团对石墨烯吸附材料性能的影响, 从化学视角提出了设计高效石墨烯吸附剂的思路.
石墨烯; 吸附材料; 污水处理; 纳米技术
石墨烯是近年来备受关注的明星材料, 具有独特的结构和性质[1-2]. 结构上, 石墨烯可以视为是单层的石墨, 由sp2杂化的碳原子组成六元环是其基本结构单元. 石墨烯也被视作构筑其他sp2碳材料的基础, 如富勒烯、碳纳米管(CNTs)和石墨[1-2]. 石墨烯的独特结构使得它具有很多奇特的性能与应用, 在很多领域已经展示了巨大的潜力. 研究表明石墨烯在电子、能源、先进材料、催化、生物医学以及环境科学等相关领域有重大的应用价值[3-6]. 例如, 石墨烯具有优良的电学性能, 可以用于场效应管、集成电路、透明导电薄膜、柔性锂电池等[4]. 石墨烯力学性能优越, 其强度是钢的100倍以上, 可以用于制造轻质的高强度材料[6]. 石墨烯具有光电转换性能, 已经被用于制造光电转换装臵,如太阳能电池和显示器[3]. 石墨烯材料具有良好的生物相容性, 可以用于药物载带、活体成像、生化分析以及生物组织工程等[5]. 商业化的生产石墨烯产品研发也已经受到业界的重视.
在这诸多应用中, 石墨烯在污水处理中的应用是最有可能实现产业化的石墨烯技术之一[7]. 石墨烯以及它的衍生物有许多作为吸附材料的天然优势. 首先, 石墨烯是单层的结构, 所有的原子都是表面原子, 因而石墨烯具有极大的比表面积. 石墨烯的有效吸附表面甚至要比CNTs的还要高, 这是因为污染物很难扩散进入CNTs的内表面. 其次, 与传统的吸附剂相比, 污染物在石墨烯吸附材料上的吸附有着较快的吸附动力学. 石墨烯吸附材料的孔状结构使得污染物具有更高的扩散速率, 并直接导致更高的吸附速率. 再者, 相较其他高效吸附材料, 石墨烯吸附材料的生产成本更低. 最后, 石墨烯吸附材料能同时处理多种污染物. 石墨烯吸附材料处理重金属、染料、小分子有机污染物和油污等都有较高的吸附量[7]. 如前所述, 石墨烯吸附剂的优势已经得到证实和广泛认可. 为了适应不同的需求, 石墨烯吸附材料的官能化是重要途径. 污染物在石墨烯上的吸附行为和影响因素也已经被逐渐揭示. 这些激动人心的研究成果正激励着更多石墨烯吸附材料的研究.
在取得巨大进展的同时, 石墨烯吸附材料的研究还存在着许多亟待解决的问题. 首先, 即使同样类型的石墨烯材料在文献中也被报道出差异巨大的吸附量和吸附行为, 缺乏一个统一的衡量标准来判断石墨烯吸附材料的优劣. 这种巨大差异可能是源于起始原料、制备方法和实验批次的不同. 其次, 石墨烯吸附材料的物理化学性能如何影响石墨烯吸附材料的性能尚不清楚. 这严重阻碍了设计高效石墨烯吸附材料的研究. 最后, 用石墨烯吸附材料处理实际污水样品方面的报道极少. 现有文献主要基于模型污染物的开展研究. 因此, 总结和分析石墨烯吸附材料取得的进展和不足是很有必要的.
本文综述了石墨烯吸附材料的制备方法及在污水处理中的应用. 针对不同类别的石墨烯吸附材料, 总结了制备方法的基本方法和吸附量、吸附动力学、吸附热力学等性质. 探讨了石墨烯与污染物之间的相互作用, 从物理化学的角度探讨影响石墨烯吸附材料性能的因素. 本文还从化学视角为设计高效石墨烯吸附材料提出了一些思路.
1 石墨烯吸附材料的制备
1.1 氧化石墨烯
氧化石墨烯(GO)是最重要的石墨烯吸附剂, 因为它价格低廉、易于生产、吸附量大. GO同时也是制备还原的氧化石墨烯(RGO)的原料. 制备GO最经典的方法是Hummers法. Hummers法的典型步骤如下: 石墨粉与NaNO3混匀后加入到浓硫酸中, 然后加入高猛酸钾固体进一步对石墨进行氧化[8]. 在反应完成以后, 加入过氧化氢来还原过量的高锰酸钾. 所得的氧化石墨经超声剥离, 得到单层的GO.
在后续的研究中, 研究人员对Hummers法进行了各种改进, 以提高单层GO的产率. 预氧化是提高高锰酸钾氧化效果的有效方法. 例如, 石墨可以预先用P2O5和K2S2O8氧化[9], 之后再按Hummers法处理. 同时, 在石墨氧化过程中需要对温度进行精准的控制. 尤其是加入固体高锰酸钾后会产生大量的热, 甚至引燃石墨. 应该用冰浴来避免石墨的过度氧化. 利用改进的Hummers法能得到高质量的GO(Figure 1). 此外, Mishra和Ramaprabhu报道了一种很迂回的方法制备GO[10]. 首先用Hummers法将石墨氧化成GO. GO在200℃下用氢气还原, 得到RGO. RGO再由硝酸进一步氧化, 重新变成GO.

图1 GO的原子力显微镜照片(A-C)和拉曼光谱图(D).[11]Figure 1 Atomic force microscopy (AFM) images (A-C) and Raman spectra (D) of GO.[11]
Hummers法制得的GO都是在分散液中, GO样品的干燥方法需要仔细选择. 直接烘干GO分散液无法得到多孔的GO干粉, 相反GO单层之间会紧密堆叠在一起, 形成厚的GO片[11]. 这种如纸张的片状结构在污染物的吸附处理上是不会被采用的, 因为紧密的堆叠使得污染物在吸附材料中的扩散变得异常困难. 更好的选择是采用冷冻干燥法, GO中的水分子通过升华除去, 能有效的保留GO单层(少数层)的性质, 获得多孔蓬松的GO样品. 例如, Liu等报道过冻干GO分散液制备三维多孔GO泡沫[12]. 在条件允许的情况下, 直接使用GO分散液是最理想的, 能达到最大的吸附量和最快的吸附动力学.
1.2 还原型石墨烯
还原型石墨烯是另一种重要的石墨烯吸附剂. 还原型石墨烯含有少量的氧原子, 因此还原型石墨烯也是带有负电荷的, 但是电荷远远少于GO. 还原型石墨烯的制备方法主要有两类, 即直接生长法和化学还原法. 在吸附材料制备中, 化学还原法利用还原剂将GO还原, 制备还原型石墨烯. 这种方法原料简单易得、成本低廉、产量较高, 因此被广泛采用. 直接生长法制备石墨烯的成本高、产量低, 往往用于制备具有特殊结构的还原型石墨烯.
化学还原法制得的还原石墨烯通常称作RGO. 许多能还原含氧基团的还原剂都能用于化学还原法制备RGO. 在这些还原剂中, 最常用的还原剂是水合肼. 水合肼能将GO的大多数含氧基团还原, 产物含氧量远低于GO. 其他还原剂, 如维生素c, NaBH4和Na2S2O3等, 也常用于RGO的制备. 不同的还原剂反应条件不完全一致, 需要调节适合的温度和反应时间. 无论选用哪种还原剂, 充分搅拌是成功制备RGO必需的. 与常规的还原剂不同, Wang等报道了[13]应用等离子体来还原制备RGO的方法. GO在电感耦合等离子体发生器中被还原. 反应器的压力被减少到3 Pa后通入H2. 在10 Pa下, H2等离子体还原GO的时间为30 min, 得到产物RGO.
1.3 石墨烯海绵
石墨烯海绵是呈海绵状的石墨烯三维结构. 海绵结构允许污染物在它的孔状间隙中扩散. 海绵状的结构也比单分散的片层容易处理和使用. 因此, 石墨烯海绵已经成为极具实用前景的石墨烯吸附材料. 制备石墨烯海绵的关键在于保持石墨烯的多孔结构.
正如前文讨论, 冷冻干燥能在干燥过程中很好的保持GO的孔状结构. 在制备石墨烯海绵时, 冷冻干燥也是干燥样品的最佳选择. Liu等[12]在真空旋转浓缩仪中制备了GO海绵. GO在真空旋转浓缩仪中1×10-4Torr的压力下干燥6小时就能制备得到GO海绵. Mi等[14]也采用了类似的策略制备GO气凝胶. GO在液氮中冷冻, 随后冷冻干燥处理48 h.最近, 我们利用冷冻干燥制备了GO-壳聚糖复合海绵材料[15-16]. 将GO-壳聚糖复合材料冷冻后进行冷冻干燥即可.
石墨烯海绵也可以在水热法还原GO的过程中得到. 与GO海绵类似, RGO海绵的孔状结构只有在冷冻干燥法中才能得到保持. 直接干燥RGO海绵会导致其孔状结构坍塌. Bi等[17]通过水热反应还原GO得到RGO海绵. GO分散在蒸馏水/氨水的混合溶液中的. 这些深褐色的凝胶分散液在180 ℃下水热反应24 h. 制备得到的RGO凝胶在冷冻干燥处理48 h后变成RGO海绵. Zhao等[18]制备了一种新型的氮掺杂石墨烯海绵. GO被分散在5%的吡咯溶液中, 然后180 ℃水热处理12 h. 所得含氮的凝胶经过冷冻干燥和退火处理. Zhao等[19]用硫脲作为还原剂制备RGO海绵. 硫脲加入到GO分散液之后, 它们的混合物在180 ℃下水热反应4.5 h. 冷冻干燥处理产物得到RGO海绵.
除了水热法以外, 较低温度条件下的还原反应同样能够制备石墨烯海绵. Wang等[20]曾在低温条件下制备了RGO气凝胶, 并将其应用于水净化. GO分散液在95 ℃下用苯酚酸处理8 h而还原. 透析还原得到的RGO, 经过冷冻干燥就能获得RGO气凝胶. 为了避免产生过多碎片, 这类方法在还原过程中不能搅拌, 因此还原反应速率较慢. 此外, 并非所有的还原剂都适合制备RGO海绵. 最常用的水合肼就不能得到结构完整的RGO海绵.
超临界CO2也可以用于保持吸附剂的孔状结构. Sui等[21]制备了CNTs与RGO的海绵. CNTs能分散在GO悬浮液中, 并与GO一起被维他命C还原, 变成CNTs/RGO悬浮液. CNT/RGO悬浮液在超临界CO2环境下干燥成为海绵.
除还原法, 石墨烯海绵还可以由小分子直接制备得到. Choucair等[22]在220 ℃下用乙醇与钠溶剂热反应72 h来制备了具有3D结构的石墨烯吸附剂.
1.4 功能化石墨烯
为了使吸附剂具有更好的性能, 石墨烯可以用化学修饰的方法进行功能化. 功能化的目的是往石墨烯材料上添加一些能与污染物分子产生强烈相互作用的基团. 在发展石墨烯吸附剂的进程中, 功能化应该仔细地设计和研究.
共价修饰是最常见的功能化方法. Madadrang等[23]制备了GO-EDTA吸附剂, 并将其应用于Pb2+的吸附. 在这个复合吸附剂中, EDTA是Pb2+的螯合剂, 因而用EDTA来功能化GO是非常合理的. Zhao等[24]制备了磺化的石墨烯吸附剂. GO先进行预还原, 在80 ℃下用NaBH4还原1 h. 预还原的GO与对氨基苯磺酸的重氮盐反应, 随后再用水合肼还原, 得到磺化的RGO. Yang等[25]制备了藻青菌金属硫因修饰的GO (GO-SmtA). GO-SmtA是通过EDC/NHS缩合反应制备的.
功能化的另一种方法是通过非共价修饰. Wu等[26]将石墨烯分散在CTAB溶液中, 干燥得到石墨烯-CTAB. Song等[27]将茶多酚加入到GO分散液中, 然后在180 ℃下反应8 h. GO的片层被还原的同时也被功能化, 成为石墨烯-多酚.
1.5 石墨烯-无机复合材料
石墨烯与其他无机材料可以形成复合材料, 这些无机材料赋予石墨烯新的性能. 最广泛研究的是石墨烯磁性复合材料. 附着磁性纳米颗粒(NPs)使得吸附后的分离变得简单, 只需外加磁场进行磁分离即可.
磁性NPs与石墨烯可以通过化学键共价连接. He等[28]将末端为氨基的SiO2包覆在Fe3O4上, 再通过EDC/NHS法缩合到GO上, 得到具有磁性的GO-Fe3O4. GO-Fe3O4可以在NaOH溶液中用NaBH4还原获得RGO-Fe3O4. Yao等[29]也采用了EDC/NHS法将Fe3O4/SiO2纳米颗粒连接在GO吸附剂表面上. Fan等[30]将壳聚糖作为连接制备了GO-壳聚糖-Fe3O4复合材料. 壳聚糖与戊二醛交联, 从而包覆在Fe3O4纳米颗粒上. 壳聚糖-Fe3O4则采用EDC/NHS法缩合到GO上. Fan等[31]采用EDC/NHS法将β-环糊精-壳聚糖修饰的Fe3O4连接到GO上. Xie等[32]报道了酰氯法缩合制备磁性石墨烯吸附剂. 用二氯亚砜处理GO得到了GOCl. Fe3O4在无水四氢呋喃中通过酰胺键连接到GO上.
磁性纳米材料可以直接沉淀在石墨烯上. Wang等[33]报道了碱性环境下Fe2+/Fe3+共沉淀到石墨烯上, 制备石墨烯-Fe3O4复合材料. 类似的方法Geng等[34]也曾报道. Luo等[35]制备了Fe3O4-RGO-MnO2纳米复合材料. Fe3O4是通过往含有Fe2+/Fe3+的石墨烯分散液中添加氨水得到的. 随后加入Mn2+、MnO4-和OH-, MnO2就能够在Fe3O4-RGO吸附剂上长出来了.
溶剂热法也是非常流行的一种制备磁性石墨烯材料的方法. Sun等[36]将GO分散在乙二醇/甘二醇溶液中, 加入丙烯酸钠、醋酸钠和FeCl3, 在200 ℃下水热反应. Fe3O4生长与GO还原同步完成, 得到RGO-Fe3O4. Chang等[37]与Wu等[38]也报道过类似的方法.
其他含铁的纳米材料也被用于与石墨烯复合. Guo等[39]报道了用NaBH4还原GO/FeCl3混合液, 制备石墨烯-铁复合物. Zhu等[40]利用Fe(CO)5作为前体在石墨烯上生长制备了Fe@Fe2O3. 将石墨烯分散在二甲基甲酰胺中, 然后将Fe(CO)5注射到体系中回流处理. 产物干燥后, 在H2/Ar环境下退火.
石墨烯吸附剂还可以与其他无机材料复合在一起. Hao等[42]制备了石墨烯-SiO2复合材料, 通过四甲基正硅酸盐(TEOS)在GO上水解得到. Ren等[42]用高锰酸钾作为原料通过在微波照射下的氧化还原反应制备了石墨烯-MnO2复合材料. Zhang等[43]在GO上沉淀Fe(OH)3而制备得到了GO-FeOH复合材料. Li等[44]将Mg(OH)2沉淀在GO上, 并用水合肼还原, 制备了RGO-Mg(OH)2复合材料.
此外, 石墨烯可用于包覆传统的无机吸附材料, 显著提高传统吸附剂的性能. Gao等[45]报道了GO包覆的沙子. 将干净的沙子加入到GO分散液中, 并在150 ℃的真空干燥箱中干燥. 重复操作, 以增加GO包覆层的厚度. 鉴于沙子的体积较大, GO包覆的沙子被用来填充分离柱. Sreeprasad等[46]制备了表面包覆RGO-无机纳米材料的沙子. RGO与金属离子的前体混合(KMnO4、HAuCl4、AgNO3、H2PtCl6和PdCl2), 在没有搅拌的条件下反应. RGO-无机纳米复合物与壳聚糖溶液1:1混合, 加入到沙子上并彻底混合. 干燥后的样品浸泡在氨水溶液中, 随后用蒸馏水洗涤至中性. Zhang等[47]采用石墨烯来包覆棉花秆制备了生物炭复合材料. 加入石墨烯分散液后, 棉花杆在烘箱中80 ℃干燥. 石墨烯包裹的棉花杆在N2环境下退火处理, 制得石墨烯包覆的生物炭.
1.6 石墨烯-高分子复合材料
石墨烯可以与聚合物形成复合材料. 壳聚糖本身就是一种较好的吸附剂, 并且具有良好的生物相容性, 因此将壳聚糖-石墨烯复合材料引起了广泛的研究兴趣.
首先, 石墨烯可以掺入到壳聚糖中, 起到提高壳聚糖力学性能的作用. Yang等[48]报道质量比1%的GO掺入到壳聚糖中能够加强壳聚糖的性能. 在Zhang等[49]的研究中质量比4.5%的GO能增强壳聚糖的机械强度. Zeng等[50]与Pan等[51]曾报道GO增强的壳聚糖膜, 采用的也是掺入法. 将GO还原就能得到石墨烯-壳聚糖复合材料[51].
其次, 将壳聚糖掺入到GO中, 可以制备GO-壳聚糖复合材料. Cheng等[52]制备了具有中孔结构的3D石墨烯-壳聚糖复合材料. GO首先与壳聚糖混合, 得到的GO-壳聚糖复合物, 再在氩气流下加热到150 ℃反应45 min, 得到RGO-壳聚糖. Liu等[53]制备的GO-壳聚糖球复合材料可用于Pb2+的吸附处理. 将GO与壳聚糖混合, 逐滴加入到氢氧化钠溶液中. GO-壳聚糖珠用戊二醛交联, 得到结构稳定的产物. Chen等[54]将GO加入到壳聚糖溶液中得到了GO-壳聚糖水凝胶. 制备水凝胶的关键是将混合溶液剧烈摇动并超声处理. Yang等[55]将少量的壳聚糖加入到GO分散液中, 沉淀得到GO-壳聚糖复合材料.
除了壳聚糖, 其他高分子材料也可以与石墨烯形成复合材料. Yuan等[56]等曾报道GO-PAMAM (聚酰胺-胺型树枝状高分子)的制备. 在EDC/NHS缓冲溶液中将GO加入到乙二胺的溶液中. 在30℃下反应4 h, 制备得到GO-PAMAM. GO-PAMAM 0.0与过量的甲基丙烯酸酯反应可制备GO-PAMAM 0.5. 重复上面的步骤就能够得到GO-PAMAM 2.0.
2 石墨烯吸附污染物的作用力
2.1 静电相互作用
在阳离子污染物接触到GO及其复合材料时, 静电相互作用是主要的作用力. GO含有大量的含氧官能团, 这些含氧官能团都是负电性的. 负电性的GO更容易吸附阳离子污染物, 如重金属、阳离子染料和其他的带正电荷的污染物.在碱性环境中, GO上羧基的去质子化会得到加强, 对阳离子污染物的吸附会增强. pH-依赖的阳离子吸附在不同的吸附实验中都有报道. 例如, Yang等[57]曾报道GO在高pH下对亚甲基蓝有更大的吸附量. 类似的现象在其它石墨烯吸附材料研究中也有报道[12,58]. 除了直接的静电相互作用外, 阳离子与π电子(石墨烯的碳原子形成sp2杂化的六元环)之间也可能存在的静电相互作用.
静电相互作用中的静电排斥对吸附是不利的. GO及其复合材料不适合于处理带负电荷的污染物, 因为极大的静电排斥使得吸附极为困难. 在我们的研究中, 与阳离子染料相比, 带负电荷的染料在GO上的吸附非常少. Ramesha等[59]比较了阳离子染料与阴离子染料在GO上吸附量的区别. 处理阳离子染料时, 吸附效率高达到95%; 处理阴离子染料时, 吸附量接近零. 为了克服静电排斥, GO必须被还原或用-NH2基团来修饰处理. Ramesha等[59]将GO还原成RGO,增加了对阴离子染料的吸附量.
静电作用会影响石墨烯吸附剂的循环再生. 因为静电作用比较强, 循环再生时打破这种静电吸引是很困难的. 这解释了为什么GO的循环效率很低. Zhang等[58]发现用乙酸洗涤GO后, GO对亚甲基蓝的吸附量只有循环利用前的40%. 为了能达到较高的脱附率, Madadrang等采用了pH为1的HCl溶液[60]. Yang等[61]报道GO在吸附了Cu2+后可以利用大量的水洗涤5次来脱附. 考虑到循环利用的难度, 我们应该适当降低石墨烯吸附材料与污染物之间的静电相互作用, 在降低静电相互作用与降低吸附量之间找到平衡点. 在降低静电相互作用的同时, 无可避免的会降低吸附量.
2.2 π-π堆叠
π-π相互作用是发生在芳环与石墨烯结构之间的相互作用. 在π-π相互作用中, 芳环和石墨烯平面的最优构像是平行或者呈T形[62]. 实验和计算研究表明π-π相互作用广泛存在, 对石墨烯与含芳环污染物的吸附力有较大贡献. 这样的探索已经在CNTs研究中被广泛接受. 鉴于石墨烯有着与CNTs相似的结构, 并且很多有机污染物的结构包含芳环, π-π相互作用对于石墨烯吸附材料的应用有很重要的影响.
必须指出的是, 当污染物上有离子化的基团时, 相对于静电相互作用而言, π-π相互作用要弱的多. 典型例子是石墨烯吸附亚甲基蓝. Yang等[57]发现GO对亚甲基蓝的吸附量远高于同类结构但不带负电的吸附材料, 如还原型石墨烯、剥离的石墨烯和CNTs. 这说明静电吸引的贡献远大于π-π相互作用.
2.3 疏水相互作用
疏水作用是另一种促进污染物在石墨烯上吸附的重要作用力. 疏水作用是源于熵效应, 这里熵效应是指将排列整齐的水分子从非极性的表面上排斥出去. 疏水作用是广泛存在于疏水链与石墨烯结构之间的作用力. 亲水的污染物、油以及其他疏水污染物可以通过疏水相互作用吸附到石墨烯上. 即使是亲水污染物, 如果它们包含疏水部分(具有两亲结构), 疏水作用也会存在于疏水部分和石墨烯之间.
2.4 络合作用
络合作用在吸附研究中很少讨论, 然而用GO及其复合材料处理金属离子时, GO上的氧原子与金属离子发生的络合作用会促进吸附发生. 在研究由Cu2+引起GO折叠时, Yang等[61]比较了Cu2+与Na+引起折叠的不同效果. Cu2+能导致GO片严重折叠, 而相同离子强度的Na+则不会. 除此之外, 络合作用引起Cu2+光谱蓝移也在紫外-可见光谱中证实(图2). 在处理重金属离子污染时, 络合作用是应该考虑, 甚至是仔细设计的. 这样的尝试已经在CNTs的研究中有所报道, 在碳骨架上连接的巯基能够与Cd2+发生络合作用[63].
Madadrang等[60]报道了一种基于络合作用的石墨烯吸附材料. GO首先通过硅烷化反应与EDTA相连接. EDTA是很多金属离子的螯合剂. 将EDTA修饰在GO上, 复合材料中的EDTA能与很多金属离子, 如Pb2+、Cu2+、Ni2+、Cd2+和Hg2+, 发生螯合作用. 因此, GO-EDTA复合材料对这些金属离子有较高的吸附量. 另一个典型例子是Yang等[25]报道的藻青菌金属硫蛋白修饰的GO. 金属硫因中的半胱氨酸残基含有巯基, 巯基与Cd2+的螯合作用促进了复合材料对Cd2+的吸附.
2.5 其它作用力
氢键作用是发生在氢的给体与受体之间的相互作用力. 当利用GO以及其复合材料时, GO层上的-COOH和-OH能够提供极性氧连接的氢原子, 这些氢原子与其他极性原子(如O、N和S)形成氢键. 然而在水溶液中, 水分子也能提供氢的给体与受体. 因此, 我们认为氢键的净贡献应该很小, 尽管氢键相较于其他次价键来说很强(5-30 kJ/mol).
范德华力会促进污染物在石墨烯上的吸附. 范德华力能在很大范围内(几百个皮米)起作用, 处在界面上的原子对接触越紧密, 范德华力就越强. 在水溶液中, 只有紧密接触的原子才会有净贡献. 范德华力对单原子而言是较弱的作用力, 而很多污染物只含有少量原子. 因此, 范德华力对污染物在石墨烯上的吸附贡献也很小.
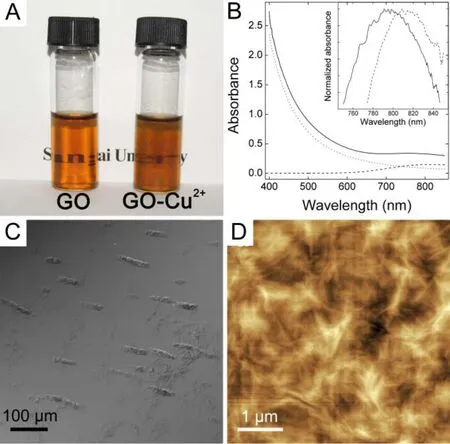
图2 Cu2+与GO的络合作用. (A)Cu2+引起GO团聚的照片; (B)紫外-可见光谱(插图显示络合引起吸收光谱蓝移); (C)GO-Cu2+的显微镜照片; (D)GO-Cu2+的原子力显微镜照片.[61]Figure 2 Chelation between Cu2+and GO. (A) photograph of GO and GO-Cu2+composite; (B) UV-vis spectra with the inset highlighting the shift of Cu2+absorbance; (C) microscopy image of GO-Cu2+; (D) AFM image of GO-Cu2+.[61]
3 污染物在石墨烯吸附材料上的吸附
3.1 重金属离子和有毒非金属离子
重金属污染在全世界范围内经常发生[64]. 重金属的毒性使得重金属污染极具危害性[66]. 石墨烯吸附剂已经被用于处理重金属离子以及一些有毒的非金属离子污染物.
大多数的重金属离子是阳离子性, 容易吸附在含氧的GO吸附剂上. Yang等[61]发现GO能有效吸附Cu2+. Ren等[66]证实GO有着比CNTs和活性炭更高的吸附Cu2+的能力. GO气凝胶同样能用于处理Cu2+[14]. GO对Cu2+的吸附过程复合Langmuir模型, 最大吸附量是19.65mg/g. 相对于GO分散液, GO气凝胶的吸附量更小[14,61]. 这可能是因为在干燥过程中发生GO片层的堆叠, 这些堆叠使得一些吸附位点被封闭. Chen等[54]报道GO-壳聚糖复合材料对Cu2+的吸附量是70 mg/g, 对Pb2+的吸附量是90 mg/g. 增加GO-壳聚糖复合材料中壳聚糖的含量能增加对Pb2+的吸附量. 对Cu2+而言, 最佳的GO:壳聚糖配比是10:1. Ren等[42]报道石墨烯-MnO2复合材料对Cu2+的吸附量是1637.9 mg/g, 对Pb2+的吸附量是793.65 mg/g. Huang等[67]研究了Pb2+在石墨烯上的吸附. 石墨烯对Pb2+的处理量是22.42 mg/g. 对石墨烯进行700 ℃热处理, 石墨烯对Pb2+的吸附量会增加到35.46 mg/g. 依据Langmuir模型, 石墨烯-SiO2对Pb2+的最大吸附量是113.6 mg/g[41]. GO-壳聚糖-Fe3O4对Pb2+的吸附量是82.1 mg/g[68]. Gao等[45]用石墨烯包覆的沙子吸附Hg2+, 可以用柱分离的方式处理污水. Sreeprasad等[46]曾报道RGO-无机纳米材料包覆的沙子在蒸馏水和地下水中都能将Hg2+吸附. 在298K时, 石墨烯-MnO2对Ni2+的吸附量达到了46.55 mg/g[69]. GO-PAMAM能够吸附不同的金属离子, 对不通过金离子的处理能力遵循以下的顺序: Fe3+>Cr3+>Zn2+>Pb2+>Cu2+[56]. 当金属离子被排放到环境中, GO-PAMAM吸附金属离子的顺序则变为: Fe3+>Zn2+>Cu2+>Cr3+>Pb2+, 总的吸附量是1.0 mmol/g. 石墨烯-CNTs对Pb2+的吸附量是104.9 mg/g,对Hg2+的吸附量是93.3 mg/g, 对Ag+的吸附量是64 mg/g,对Cu2+的吸附量是33.8 mg/g[21]. 除了处理重金属, 石墨烯-CNT气凝胶还能用于水体脱盐, 脱盐量达到521.6mg/g. 石墨烯-CTAB对Cr3+的吸附量达21.6 mg/g[26]. Langmuir模型与Freundlich模型这两个模型都能用于描述这个吸附过程, 但是二者都不能很好的描述吸附过程.
为提高石墨烯吸附剂的吸附性能, 可以采用螯合剂将石墨烯吸附剂功能化. Madadrang 等[60]研究了GO-EDTA对Pb2+的吸附(图 3). 根据Langmuir模型, GO-EDTA对Pb2+的吸附量达到了525 mg/g. Song等[71]报道了石墨烯-多元酚对Pb2+的吸附. 根据Langmuir模型, 石墨烯-多元酚对Pb2+的吸附量达到了1102 mg/g, 且该吸附是选择性吸附. 石墨烯-多元酚对Cu2+、Ni2+、Co2+、Cd2+及Cr3+却不会有很好的吸附效果. 根据Langmuir模型, GO-SmtA在pH 6时对Cd2+的吸附量是7.7 mg/g[25]. GO-SmtA对金属离子的吸附同样是选择性的, 几乎不会受到K+、Na+、Ca2+、Mg2+、NO3-、Cl-和SO42-等离子干扰. 除螯合剂外, 金属纳米材料和聚合物也能提高吸附剂的吸附能力. 与单纯的石墨烯相比, 石墨烯-Fe@Fe2O3对Cr (V)有着较高的吸附量[71]. GO-壳聚糖复合材料能更有效的吸附Au3+与Pb2+[53]. GO-壳聚糖的吸附量比单纯的GO的吸附量要高很多, 但仅仅比壳聚糖高很少一些. 增加GO含量会导致GO-壳聚糖复合材料吸附量减少.
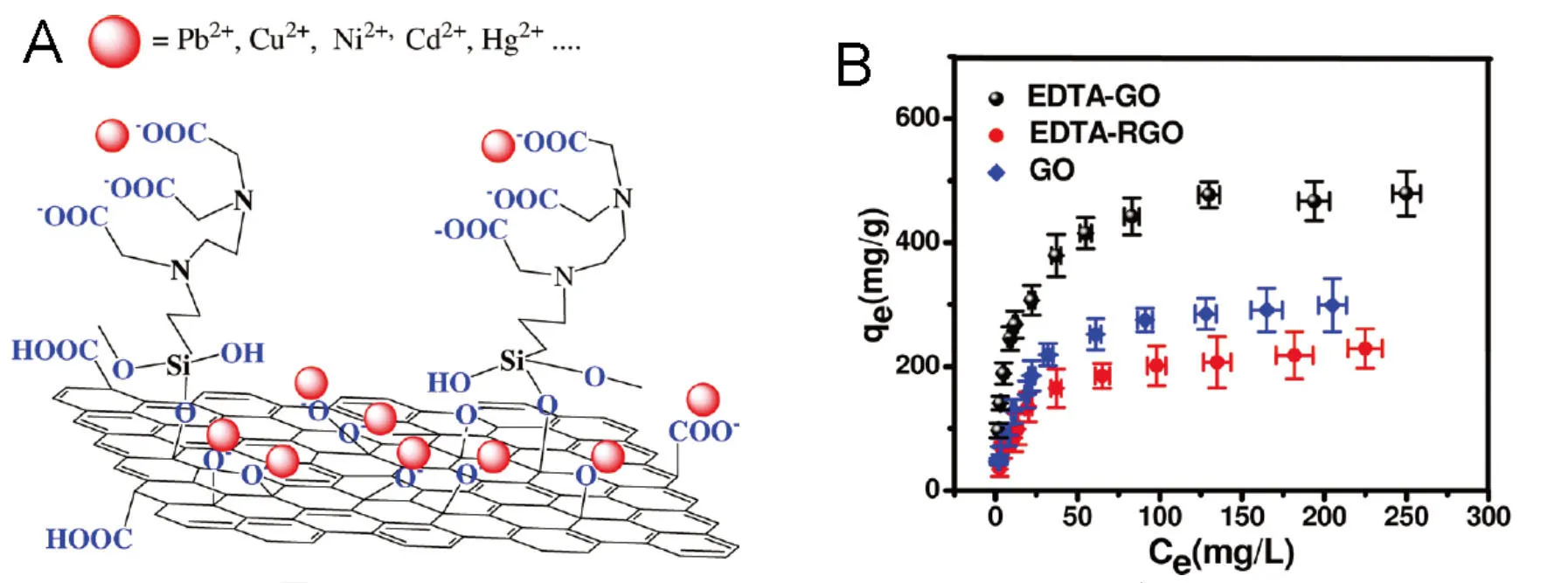
图3 Pb2+在GO-EDTA上的吸附. (A)吸附示意图; (B)吸附等温曲线.[60]Figure 3 Adsorption of Pb2+on GO-EDTA. (A) Schematic illustration of the adsorption mechanism; (B) adsorption isotherm.[60]
石墨烯吸附剂对非金属离子来说也是一种很好的吸附剂. Luo等[72]采用磁性的Fe3O4-RGO-MnO2复合材料用于吸附处理As (III)和As (V). 吸附符合Langmuir模型, 拟合得出的As (III)最大吸附量是14.04 mg/g, As (V)最大吸附量是12.22 mg/g. GO也能从水溶液中有效的吸附Na+、As (III)和As (V)[10]. 相应的最大吸附量分别是122 mg/g, 142 mg/g和139 mg/g. 从Langmuir模型中计算得出的b的值非常小, 以及Freundlich模型计算出的n值略大于1, 这些都表明吸附剂对非金属污染物的亲和力不是足够强.
在某些情况下, 石墨烯被用来提高其他吸附剂的机械强度. Zhang等[47]用GO来提高壳聚糖吸附材料的强度, GO-壳聚糖复合材料能够有效的处理Cu2+和Pb2+. 复合材料中GO的含量对Cu2+的吸附量影响很小, 但是增加GO的含量却对Pb2+的吸附产生显著影响. GO的含量达到4.5%时, GO-壳聚糖对Pb2+的吸附量是98 mg/g.
除了在吸附量上的区别以外, 石墨烯吸附材料具有一些相同的特点. 首先, 石墨烯吸附剂的吸附缺乏选择性. 石墨烯吸附剂的吸附或多或少的是静电相互作用等非特异性作用. 吸附剂的氧含量能明显的影响石墨烯吸附剂的性能.为了提高吸附特异性, 石墨烯吸附剂必须进行功能化. 其次, 金属离子在石墨烯吸附剂上的吸附大都遵循Langmuir模型, 而不是Freundlich模型. 这说明金属离子在石墨烯吸附剂上的吸附都是单层吸附. 最后, 石墨烯片层的堆叠会降低对污染物的吸附量. 但是单分散的片层结构并不适合实际上的应用. 在保持吸附量的同时, 对石墨烯片层进行适度堆叠是未来研究的重点.
3.2 染料
染料是很常见的水污染物. 因为染料污染的重要性以及染料容易被肉眼识别的特点, 石墨烯对染料的吸附被广泛研究.
研究石墨烯吸附剂时, 亚甲基蓝是最常用的模型染料. 在研究石墨烯吸附剂之初, Yang等用亚甲基蓝作为染料污染物的模型. 研究发现GO对亚甲基蓝的吸附量达到了749 mg/g(图4)[57]. GO对亚甲基蓝的吸附能用Freundlich模型拟合, 而不是Langmuir模型. 这项研究把亚甲基蓝这一阳离子染料介绍到石墨烯吸附材料研究中, 因其和石墨烯上的含氧基团有强的静电相互吸引, 被许多后续研究采纳. 类似的, Zhang等发现GO对亚甲基蓝的吸附量达到了1.939 mg/mg[58]. 在另一篇报道中, GO使用之前在100 ℃下干燥处理[73]. GO对亚甲基蓝的吸附量仅为243.9 mg/g. 吸附等温曲线更符合Langmuir模型. 这种干燥处理的GO对亚甲基蓝的吸附量比活性炭低, 但是仍然比CNTs要高. Liu等等将GO海绵用于亚甲基蓝及甲基紫的吸附[12]. GO海绵对亚甲基蓝的吸附量(387 mg/g)要比单纯的GO低很多[57]. GO对甲基紫的吸附量在298K时是384 mg/g. GO-Fe3O4能有效地吸附亚甲基蓝和中性红[32]. 在吸附完成以后, 磁性分离能将吸附剂分离除去. Liu等发现RGO能吸附亚甲基蓝, 吸附量达到154 mg/g[74]. 吸附的过程符合Langmuir模型, 而不是Freundlich模型. Fan等曾制备了GO-壳聚糖-Fe3O4复合材料用于处理亚甲基蓝, 其最大吸附量是95 mg/g[30].RGO-Mg(OH)2能够脱色亚甲基蓝溶液.[44]GO-Fe3O4以及RGO-Fe3O4复合材料能够处理亚甲基蓝(220 mg/g)以及中性红(150 mg/g), 吸附符合Freundlich模型.[28]GO-壳聚糖对亚甲基蓝的最大吸附量是390 mg/g.[54]GO-壳聚糖对伊红Y的吸附量是326 mg/g. GO-壳聚糖中壳聚糖含量的增加能增加复合材料对伊红Y的吸附量, 然而却抑制了对亚甲基蓝的吸附. 根据Langmuir模型, GO-β-环糊精-壳聚糖@Fe3O4对亚甲基蓝的吸附量是84.32 mg/g.[31]亚甲基蓝在石墨烯-Fe3O4/SiO2上的吸附量达到97 mg/g, 吸附过程遵循Langmuir模型.[29]包覆石墨烯的生物碳相比于生物碳(8 mg/g)对亚甲基蓝有着更高的吸附量(174mg/g).[47]
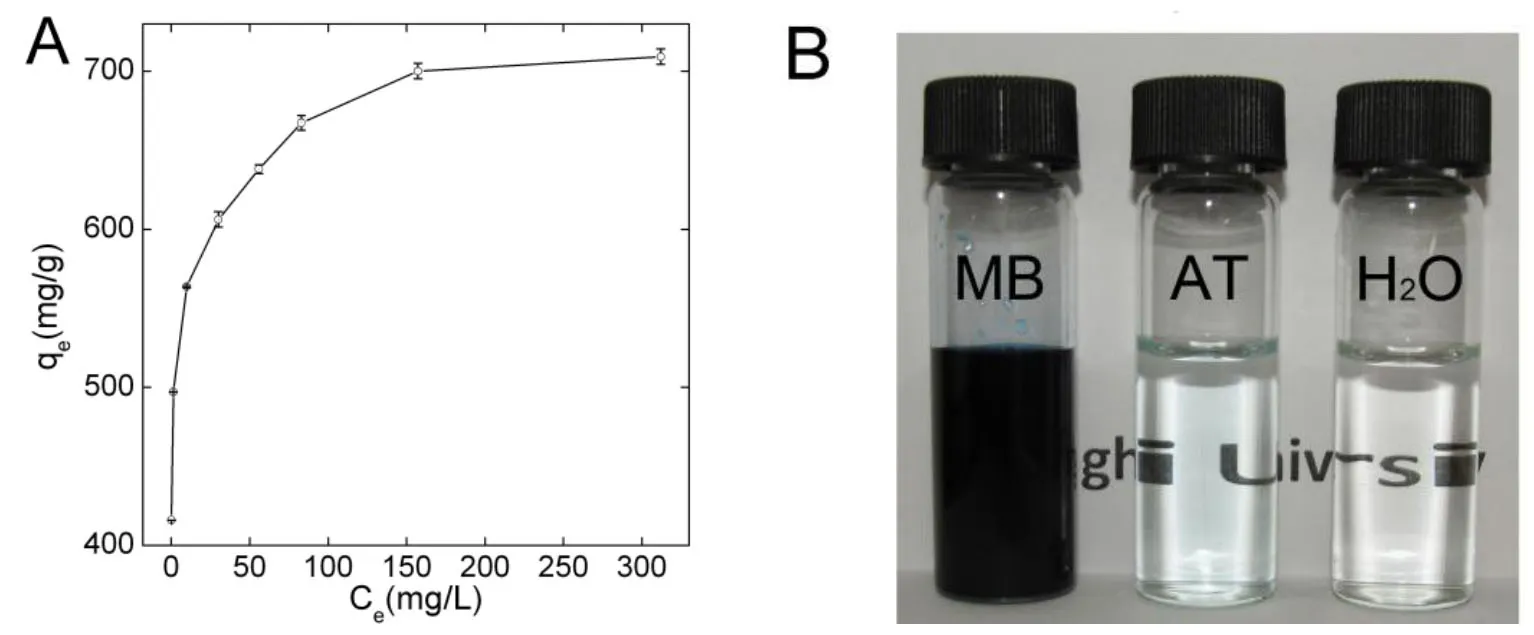
图4 亚甲基蓝在GO上的吸附. (A)吸附等温曲线; (B)处理前后溶液的照片[57]Figure 4 Adsorption of methylene blue on GO. (A) adsorption isotherm; (B) photograph of solution before and after treatment.[57]
其他的一些染料也可用于评价石墨烯吸附剂的性能. 石墨烯-壳聚糖复合材料的多孔结构可用于吸附活性黑5染料[52]. 石墨烯-壳聚糖吸附剂相比于活性炭有更好的吸附性能. Gao等[45]曾用GO包覆的沙子吸附处理罗丹明B. RGO-Fe3O4也能用于吸附处理罗丹明B, 它的吸附量达到了35 mg/g[34]. RGO-Fe3O4能用于吸附处理其他的染料, 如罗丹明6G、酸性蓝92、孔雀绿以及新胭脂红等. 增加RGO的含量能增加吸附剂对各种染料的吸附量. 石墨烯-Fe3O4对碱性红的吸附能用Langmuir模型拟合, 最大吸附量是89.4 mg/g[33]. Sun等报道RGO-Fe3O4能用于吸附罗丹明B(13.15 mg/g)和孔雀绿(22 mg/g)[36]. 吸附能用Langmuir模型拟合. 这种RGO-Fe3O4吸附剂的优点是不仅能处理实验室污水样品, 还能用于处理湖水及工业用水的样品. 石墨烯海绵也是吸附罗丹明B的优质材料, 吸附量达到了72.5 mg/g[19]. 石墨烯-CNT气凝胶对亚甲基蓝的吸附量是190.9 mg/g, 对罗丹明B的吸附量是145.9 mg/g, 对酸性复红的吸附量是35.8 mg/g[21]. Wang等报道石墨烯海绵能用于处理活性蓝、甲基橙、氨基黑10B、罗丹明6G, 钙黄绿素、孔雀绿、亚甲基蓝等[20]. 根据Langmuir模型, 石墨烯-Fe3O4对碱性副品红的吸附量达到198.23 mg/g[38]. Travlou等[76]曾报道磁性GO吸附活性黑5的吸附量为368 mg/g, 比GO(205 mg/g)高得多. Sun等[77]报道亚硫酸氢钠原位还原GO, 这样处理能提高GO对吖啶橙的吸附效果, 相应的吸附量可由1428 mg/g增加到3333 mg/g.
染料的电荷能影响染料在石墨烯吸附剂上的吸附量. Ramesha等[59]比较了阳离子与阴离子染料在RGO吸附剂上的吸附情况. GO对亚甲基蓝(17.3mg/g)及甲基紫(2.47mg/g)有较好的吸附量, 这两种阳离子染料都是带正电的. 橙黄G和罗丹明B(1.24 mg/g)是阴离子染料, 带负电的阴离子染料会和GO产生静电排斥, 抑制染料在GO上的吸附. 尤其是橙黄G在GO上的吸附可以忽略, 这是因为橙黄G上有两个磺酸基. 为了提高对GO对橙黄G的吸附, 将GO还原成含氧量低的RGO是首选方法(吸附量达5.98 mg/g).
3.3 油污
原油的污染经常发生,带来生态灾难. 石墨烯的疏水本质使石墨烯吸附剂在处理石油污染上具有天然优势. Bi等[17]报道RGO海绵能吸附很多的油类, 如辛烷、泵油、煤油以及豆油等. Zhao等报道石墨烯能有效地吸附油类(包含橄榄油和汽油)[18]. 其对汽油的吸附量是277 mg/g. 石墨烯海绵能处理正庚烷、柴油和菜籽油[19]. 石墨烯海绵对菜籽油的吸附量达到了84 mg/g. Wang等报道石墨烯海绵可用于处理菜籽油、石蜡油、煤油和泵油等[20]. 石墨烯海绵对油类的吸附量在35-50g/g的范围内.
在油类污染物处理中研究使用的石墨烯吸附材料都是石墨烯海绵. 石墨烯海绵对油类污染物有非常高的吸附量.它的吸附过程更像是石墨烯的孔洞容纳了油类污染物, 而不是真正的吸附. 此外, 由于石墨烯海绵的孔状结构及它的疏水性, 使得石墨烯海绵能够漂浮在水面上, 非常适合实际应用.
3.4 杀虫剂、抗生素及其他有机污染物
一些小的有机污染物, 包括杀虫剂、抗生素、酚类等, 是环境污染物中的重要一类. 石墨烯吸附材料也能对这些污染物进行处理.
毒死蜱、硫丹(烈性杀虫剂)和马拉硫磷(有机磷杀虫剂)是典型的杀虫剂. Maliyekkal等报道GO和RGO可以吸附毒死蜱、硫丹和马拉硫磷. 结果表明吸附剂在处理蒸馏水和地下水样品时, 吸附量很接近. RGO对毒死蜱的吸附量是1200 mg/g, 对硫丹的吸附量是1050 mg/g, 对马拉硫磷的吸附量是700 mg/g.四环素是一种广泛使用的抗生素.Gao等[78]采用GO来吸附四环素, 发现GO对四环素的吸附量是313 mg/g, 对氧四环素的吸附量是212 mg/g, 对强力霉素的吸附量是398 mg/g. Zhao等[16]用GO-壳聚糖气凝胶处理四环素, 吸附量达到1470 mg/g.
在吸附处理有机污染物上, 氧含量低的RGO相对于GO而言更加疏水, 因此更容易吸附有机污染物. Wu等[80]曾经比较过丙烯腈、对甲苯磺酸、萘磺酸和亚甲基蓝在RGO上的吸附情况. 这些污染物在RGO上的吸附量遵循以下顺序: 对甲苯磺酸>萘磺酸>亚甲基蓝>丙烯腈. 磺化处理的石墨烯吸附剂对萘的最大吸附量是2.326 mmol/g, 对萘酚的最大吸附量是2.407 mmol/g. 如此大的吸附量应该归因于强烈的π-π相互作用[24]. Sun等[80]采用腐殖酸包覆的GO处理萘胺(178.57 mg/g)和萘酚(434.78 mg/g). 腐殖酸包覆的GO对二者的吸附量都要比CNTs、活性炭和石墨烯片高许多. Wang等[13]报道对于4, 4‘-二氯联苯, RGO的吸附量(1552mg/g)要比GO和CNTs都要大. 石墨烯-Fe3O4复合材料也可用于处理苯胺(吸附量20284 mg/g)和对氯苯胺(吸附量35.47 mg/g)[37].
与处理油类相似, 石墨烯海绵可以在它的孔状结构中容纳有机物质, 最终导致更高的吸附量. RGO海绵能够吸附疏水的污染物, 包括: 泵油(86倍)、1,2-二氯苯(46倍)、二甲桠枫(63倍)以及甲苯(54.7倍)[17]. RGO海绵也能处理甲醇(49.3倍)、乙醇(51倍)和丙酮(51.1倍). 石墨烯多孔结构对有机污染物具有超高的吸附量, 范围在200-600 g/g之间[18].乙醇、丙酮、四氯化碳、环己烷、氯苯、四氢呋喃、甲醇、甲苯、二甲亚砜、氯仿和硝基苯都可以用石墨烯多孔结构有效除去. 石墨烯海绵能够处理乙醇、乙酸乙酯、乙二醇和氯仿[19]. 吸附量在70-160 g/g范围内变化.
总的来说, 石墨烯吸附剂在处理不同的污染物上有着较高的吸附量. 石墨烯海绵的吸附处理能力要比传统的活性炭吸附剂要好. 石墨烯吸附材料的吸附性能也可以与其他的一些高性能的吸附剂相比拟, 如生物基材料、CNTs以及树脂等. 除此之外, 生产石墨烯吸附材料的成本也较低. 因此, 石墨烯吸附材料是一种较有前景的有机污染物吸附剂.
4 吸附动力学和热力学
4.1 动力学
污染物在石墨烯吸附材料上的吸附动力学对石墨烯吸附剂的应用来说是至关重要的. 已有的研究表明石墨烯的分散状态对其吸附动力学有重要的影响.
高度分散的GO能很快地吸附污染物. 在Yang等[58]的研究中, 亚甲基蓝的吸附在20 min内达到平衡. Yang等[58]也发现亚甲基蓝在GO上的吸附在5 min内达到平衡. 四环素在GO上的吸附过程同样非常快, 且四环素浓度越高, 吸附动力学越快[39]. 类似的, GO-EDTA能够在水中分散, 因此Pb2+在GO-EDTA上的吸附在20 min内达到平衡[23]. 石墨烯-多元酚复合材料能够较快的处理Pb2+[27], 吸附量在15 min后变为常数. 吸附过程能够用准二级动力学模型来拟合. Cr(V)在石墨烯-CTAB上的吸附在1h内达到平衡[26]. 吸附的动力学遵循准二级动力学模型. 在Cr(V)初始浓度为50 ppm时, k2值是0.0801/min.
相反,干燥后的GO则需要更长的时间才能达到吸附平衡.干燥后的GO吸附亚甲基蓝的速率明显变慢,需要150 min才能达到平衡[73]. 准二级动力学模型能够很好的拟合, k2是0.00098 g/(mg·min). 亚甲基蓝在GO海绵上的吸附符合准二级动力学模型[12]. 升高温度, 吸附动力学会更快. 显然干燥过程导致的石墨烯片堆叠阻碍了污染物在石墨烯上的扩散, 从而降低了吸附速率.
由于RGO在水中不分散, 扩散的影响变大, RGO的吸附过程要慢一些. RGO在吸附处理40 mg/L的亚甲基蓝时需要15 h才能达到吸附平衡[74]. 根据准二级动力学模型, 较小的k2值(0.0001/min)意味着吸附过程缓慢. 氧化的石墨烯与RGO有类似的性质. As (III)与As (V)在氧化的石墨烯上需要2 h才能达到吸附平衡[10]. 与Elovich模型相比, 它们的吸附过程能更适合用内扩散模型来拟合. 罗丹明B在石墨烯海绵上的吸附需要180 min才能达到吸附平衡[19]. 吸附动力学符合准二级动力学模型, 其k2速率常数是0.19 g/(mg.min).
RGO吸附剂处理疏水污染物时, 吸附动力学较快. RGO吸附4,4,-二氯联苯的速率很快[13]. 吸附过程在10min内就能完成92%. 吸附动力学符合准二级动力学模型, 其拟合常数k2值是0.023 g/(mg· h). 根据内扩散模型, 吸附过程发生在两个阶段. 第一阶段是在吸附剂表面的吸附位点上发生直接吸附. 第二阶段是源于污染物在吸附剂内部空洞上的缓慢扩散. 毒死蜱、硫丹和马硫磷在GO和RGO上的吸附速率非常快, 在10 min内90%的污染物都会吸附完成[81].在吸附处理30 min以后, 杀虫剂就清除完成.
当石墨烯与纳米材料形成复合材料, 无可避免的导致石墨烯层堆叠, 吸附速率会变慢. GO-Fe3O4对亚甲基蓝和中性红的吸附需要1 h才能达到饱和[32]. Luo等[35]发现Fe3O4-RGO-MnO4对As (III)与As (V)的吸附在120 min内达到平衡, 准二级动力学模型的k2是0.001419 g/(mg.min). 亚甲基蓝在GO-壳聚糖-Fe3O4上的吸附动力学遵循准二级动力学模型[31], 其k2是0.096 g/(mg·min). 其吸附的过程不仅是内扩散控制的, 还包含了更复杂的扩散机制. 罗丹明B在RGO-Fe3O4上的吸附符合准二级动力学模型[34]. 在罗丹明的初始浓度较低以及溶液的pH较高时, 吸附动力学更快. RGO-Fe3O4吸附罗丹明B和孔雀绿的速率很快, 吸附过程能在30 min内完成[36]. 准二级动力学模型常数, 罗丹明为0.048 g/(mg·min), 孔雀绿为0.032 g/(mg·min). Hg2+在RGO-无机纳米材料包覆的沙子上的吸附能用准一级动力学模型来描述[46]. Hg2+在RGO-Ag以及RGO-Mn纳米颗粒包覆的沙子上的吸附动力学更快.

图5 GO-壳聚糖吸附四环素的动力学. (A)吸附量随时间的变化曲线; (B)准一级动力学模型; (C)准二级动力学模型; (D)内扩散模型.[16]Figure 5 Adsorption kinetics of tetracycline on PGO-CS. (A) adsorption as a function of contact time; (B) the pseudo-first-order model; (C) the pseudo-second-order model; (D) the intraparticle diffusion model.[16]
石墨烯和聚合物形成复合材料会阻碍污染物在吸附剂中的扩散, 从而减慢吸附过程. Au3+和Pb2+在GO-壳聚糖上的吸附在6 h内达到平衡[53]. 准二级动力学模型的拟合常数k2对Au3+是0.02315 g/(mg·min), 对Pb2+是0.01698 g/(mg·min). 亚甲基蓝和伊红Y在GO-壳聚糖上的吸附速率较慢[54]. 对亚甲基蓝来说, 吸附需要经过58 h才能达到吸附的平衡, 而对伊红Y的吸附处理则需要36 h才能达到吸附的平衡. 相反, 吸附剂对Cu2+与Pb2+的吸附处理要快一些,但仍分别需要4 h和10 h才能达到吸附的平衡. 最近, Zhao等报道了GO-壳聚糖吸附四环素的动力学, 12 h尚不足以达到平衡. 吸附动力学可以用准一级动力学和内扩散模型来描述[16].
然而, 有一些研究报道了出乎意料的较快的吸附动力学. Pb2+在石墨烯-壳聚糖-Fe3O4上的吸附很快, 在10 min内达到吸附平衡[68]. 其较快的吸附动力学可能是因为吸附剂有着较好水分散性. Pb2+在石墨烯-SiO2吸附剂上的吸附能在20 min内达到平衡[41]. Cu2+在GO气凝胶上的吸附能在10 min内达到吸附平衡[14]. 在Cu2+的初始浓度是60 mg/L时, 准二级动力学常数k2是0.0518 g/(mg·min). 石墨烯-Fe@Fe2O3在处理Cr (VI)时遵循准二级动力学模型[71], 吸附在30min内达到平衡, 准二级动力学常数k2是0.28 g/(mg·min). 碱性红在石墨烯-Fe3O4上的吸附在10min内达到平衡, 符合准二级动力学模型[33]. 石墨烯-Fe3O4吸附剂能较快的吸附处理苯胺和对氯苯胺[37]. 吸附量在最初的30 min内迅速增加,且对氯苯胺的吸附比苯胺更快. 石墨烯-Fe3O4对副品红的吸附在20 min内达到平衡[38], 准二级动力学常数k2的值是0.1154 g/(mg·min). 亚甲基蓝在GO-Fe3O4/SiO2上的吸附速率较快[29], 在30 min内吸附达吸附平衡.
此外, 污染物的性能也影响吸附动力学. Wu等[79]发现污染物在RGO吸附剂上吸附动力学按如下顺序: 亚甲基蓝>酸性品红>对甲苯磺酸>丙烯腈[79].
4.2 热力学
温度对吸附的影响是石墨烯吸附材料性能的重要参数. 在这些研究中能得到的石墨烯吸附材料的热力学参数.尽管在具体的热力学参数上有所区别, 所有的吸附过程都是自发进行的.
污染物在石墨烯上的吸附过程可能是放热的, 在高温时会被抑制. Yang等[57]曾报道亚甲基蓝在GO上的吸附量在低温条件下更高. Zhang[58]等发现GO对亚甲基蓝的吸附会随着温度的增加而降低. 亚甲基蓝在GO-壳聚糖-Fe3O4上的吸附过程是放热的[30], 所以吸附在低温条件更加有效. 在303K时, ΔG是-0.735 kJ/mol, 说明吸附是自发的. ΔH是-10.28 kJ/mol, 而ΔS是-36.35 J/(mol·k), 说明吸附是焓驱动的. Cr (VI)在石墨烯-CTAB上的吸附量在低温条件下更高[26]. 在293K时, ΔG是-29.295 kJ/mol, 表明吸附是自发的. ΔH是-11.737 kJ/mol, ΔS是59.925 J/(mol·k), 焓和熵都是吸附的动力.
更多的吸附是吸热反应, 随着温度升高而增加. Pb2+在GO-壳聚糖-Fe3O4上的吸附在高温条件下更加有效[68]. 在303K时, ΔG是-10.26 kJ/mol, ΔH是7.743 kJ/mol, ΔS是29.93 J/(mol·k). 这表明吸附是熵驱动的自发反应. Wu等[79]报道亚甲基蓝在RGO上的吸附量随着温度的升高而增加. 对于高浓度的四环素而言, 其在GO上的吸附量随着温度的升高而增加[78]. GO气凝胶在高温条件下能吸附更多Cu2+[14]. 亚甲基蓝在RGO上的吸附量随温度升高而增加[77]. 磁性GO在高温条件下能更有效吸附活性黑[78]. Ni2+在石墨烯-MnO2上的吸附在高温下更有效[69]. GO-壳聚糖复合材料的吸附量也随着温度升高而增加[74]. 亚甲基蓝在GO-Fe3O4/SiO2上的吸附同样在高温时吸附量更大[29]. β-环糊精-壳聚糖@Fe3O4连接的GO在高温条件下吸附更多的亚甲基蓝[31]. 在303K时, ΔG是-0.477 kJ/mol, ΔH是14.1 kJ/mol, ΔS是48.2 J/(mol·k). ΔH是正值, 表明吸附是吸热的. ΔS大于零意味着吸附中在固/液界面上分子紊乱程度增加.
目前石墨烯吸附热力学研究还存在一些不吻合的结果. 这或许是源于制备石墨烯吸附剂的方法有所不同. 即使是很小的区别, 也可能导致热力学参数改变. 在将来的研究中, 系统的比较研究不同的吸附剂样品值得开展.
5 影响石墨烯吸附材料性能的环境因素
很多因素都影响石墨烯吸附剂的性能. 功能化和温度的影响在前面已经讨论. 在这里, 我们仅关注pH和离子强度这两个重要的参数.
5.1 pH
环境pH会影响很多的污染物和石墨烯吸附材料的质子化情况. 研究已经关注到pH对石墨烯吸附剂性能的影响,但是尚未得到统一的结论.
增加pH可能会促进污染物在石墨烯吸附剂上的吸附. Yang等[57]发现亚甲基蓝在GO上的吸附量随pH值增加而增加. Zhang等[58]也报道pH增加有利于亚甲基蓝在GO上的吸附. 亚甲基蓝与甲基紫在石墨烯海绵上的吸附也随pH提高而增加[12]. Ren等[66]发现GO处理Cu2+时, 吸附量在高pH下更大. 在高pH下, GO-EDTA能更有效的吸附Pb2+[60].石墨烯-SiO2对Pb2+的吸附会随pH增大显著提高[42]. 石墨烯-MnO2在高pH下能更有效的吸附Ni2+[69]. 与β-环糊精-壳聚糖@Fe3O4连接的GO在高pH条件下更有效地吸附亚甲基蓝[31]. 以上研究中, pH影响石墨烯含氧基团质子化是可能的机理.
在另一些体系中, 提高pH只在一定范围内促进吸附过程. 当pH在1~4的范围内增加时, GO气凝胶对Cu2+的吸附会增加[14]. 在此范围之外, pH的增加对吸附量影响很小. Wang等发现pH在3~5.5内增加时, 碱性品红在石墨烯-Fe3O4上的吸附会增加, 超过pH 5.5后对吸附量影响不显著[33]. Song等的研究表明当pH在5~7内增加时, 石墨烯-多元酚是优良的Pb2+吸附剂. 在较低的pH条件下, H+会在石墨烯吸附剂表面竞争性的吸附[27]. 当GO-壳聚糖的复合材料在pH2~6内增加, 吸附处理Cu2+的量会增加[49]. 石墨烯-Fe3O4在pH高于2时会吸附副品红[38]. 当pH超过5时, 吸附量就没有太大的增加. 苯胺与对氯苯胺在石墨烯-Fe3O4上的吸附在pH超过4时吸附量几乎保持常数[37].
一些情况下, pH增加会抑制污染物在石墨烯吸附剂上的吸附. 四环素在GO上的吸附受溶液pH影响[79], 较低的pH促进吸附. Luo等[72]发现As (III)与As (V)在Fe3O4-RGO-MnO2上的吸附在高pH下受抑制. 尤其当pH值为11时, 吸附量会有显著降低. Cheng等[52]报道低pH条件下石墨烯-壳聚糖复合材料能吸附处理更多活性黑5. Zhang等[43]发现KH2AsO4在低pH条件下在石墨烯-FeOH上的吸附更有效. 当pH增加, Cr (VI)在石墨烯-CTAB上的吸附会减小[26]. 4,4,-二氯联苯在RGO上的吸附在高pH条件下会抑制[13]. 在低pH条件下, GO-壳聚糖-Fe3O4复合材料能更有效的吸附处理活性黑5[76].
很明显, 染料的结构对pH影响吸附至关重要. Ramesha等[59]直接比较不同染料的吸附情况. 亚甲基蓝与甲基紫在高pH条件在GO上的吸附更高, 但对于罗丹明B而言低pH条件更有利(图6). 橙黄G在pH 2或碱性环境下吸附效果更好, 在pH 4~6范围内, 吸附量是最小. 这些染料的最大区别是染料所带的电荷不同, 导致了不同的吸附行为.
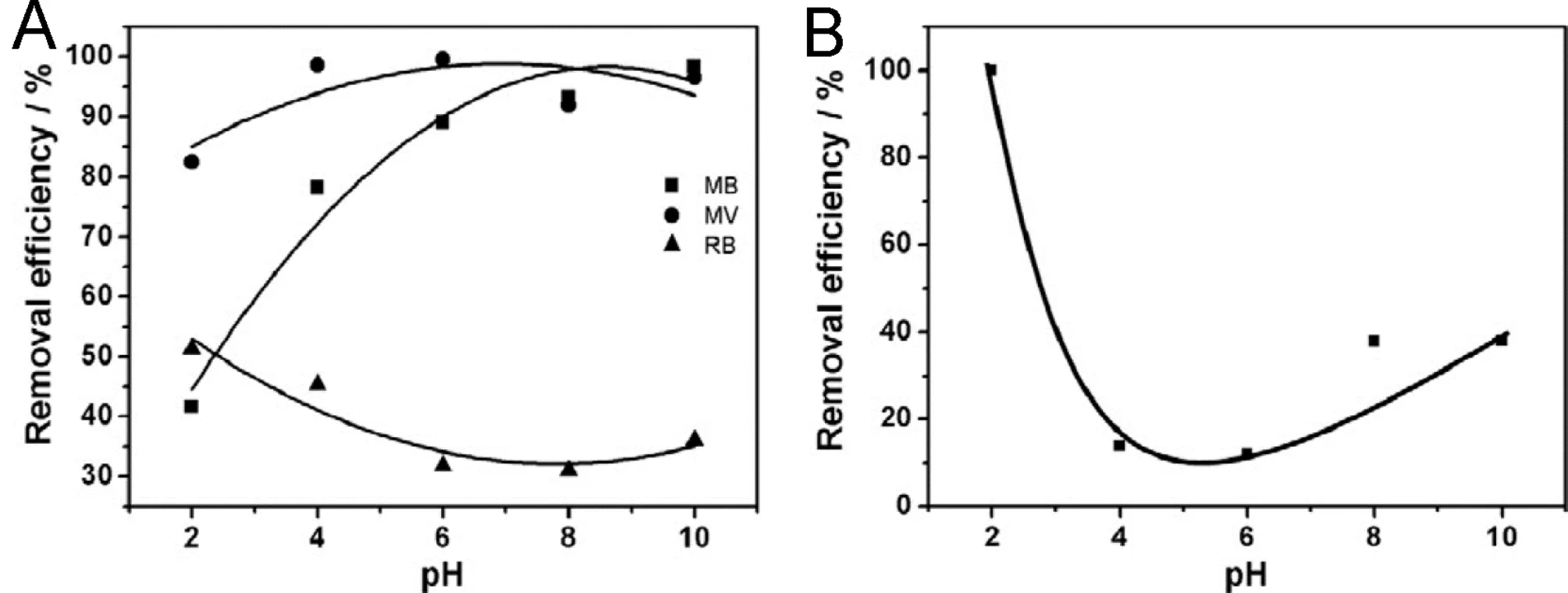
图6 pH对吸附量的影响(A)GO; (B)RGO.[59]Figure 6 Influence of pH on the adsorption capacity of GO (A) and RGO (B).[59]
还有一些研究报告表明pH对吸附几乎没有什么影响. Sun等[80]发现1-萘胺在腐殖酸包覆的GO上的吸附几乎不受到pH影响, 然而其对1-萘酚的吸附却受到pH调控. Xie等[32]发现pH几乎不会影响GO-Fe3O4对亚甲基蓝和中性红的吸附. 在pH3~10内, 吸附量保持不变. Maliyekkal等[81]报道GO和RGO可以用于除去杀虫剂. 当pH在3~9内变化时,毒死蜱, 硫丹和马拉硫磷在GO和RGO上的吸附量几乎保持恒定. 这些例子中pH对吸附量没有显著的影响, 意味着吸附剂上的可离子化基团没有参与到吸附过程中.
在研究pH对吸附过程影响时, 还发现了一些意外的情况. Fan等[31]报道GO-壳聚糖-Fe3O4吸附处理亚甲基蓝的最优pH条件是pH 4.5~6.5. 在此范围之外, 吸附量会显著的降低. Pb2+在GO-壳聚糖-Fe3O4上的吸附量最大出现在pH 5. Cr (VI)在石墨烯-Fe@Fe3O4上的吸附也会受到pH的影响[40]. 最大吸附量出现在pH 1~3, 最小吸附量出现在pH 7. Zhao等[24]发现萘与萘酚在磺化石墨烯片上的吸附量也随着pH增加而降低. 高pH条件下, 萘的吸附并不随pH增加而增加, 然而萘酚在pH>7时吸附量又会增加. Cd2+在GO-SmtA复合材料上的最佳吸附pH是pH 6[25]. 最佳pH的存在表明吸附过程的很多因素同时受到pH的影响.
5.2 离子强度
离子强度是影响石墨烯吸附材料性能的另一重要因素. 离子强度会改变污染物的离子化程度、石墨烯官能团的离子化程度以及石墨烯分散性. 因此, 离子强度会影响污染物在石墨烯上的吸附情况.
一些研究结果显示提高离子强度会抑制吸附. Gao等[78]曾报道四环素在GO上的吸附情况, 高离子强度导致吸附量降低. Pb2+在石墨烯-SiO2上的吸附受高离子强度抑制[41]Yu等发现离子强度增加导致了GO-壳聚糖气凝胶对Cu2+的吸附下降. 抑制作用可能源于Na+与Cu2+在石墨烯吸附剂上竞争性吸附引起的, 也与羧基解离被抑制有关.
另一些研究表明, 离子强度对吸附几乎没有影响. 在Zhang等[58]的研究中, 即使KCl浓度增加到50mM, 石墨烯吸附剂对亚甲基蓝的吸附量保持不变. 类似的发现也曾在石墨烯处理碱性品红中有所报道[33]. 4,4,-二氯联苯在RGO上的吸附也属于这类情况[13]. Zhao等[16]最近的研究表明四环素在GO-壳聚糖上的吸附不受离子强度影响.
考虑到离子强度能影响到吸附过程中的多个因素, 实际的情况可能更加复杂. Yang等[57]发现GO对亚甲基蓝的吸附会受到离子强度的影响. 当亚甲基蓝浓度较高时, 离子强度的增加会促进吸附. 当亚甲基蓝浓度较低时, 离子强度的增加会轻微的抑制吸附. 这可能是源于高离子强度会使得亚甲基蓝与GO的离子化程度降低, 最终导致了GO与亚甲基蓝之间的疏水相互作用占主导地位.
6 石墨烯吸附材料的循环再生
对于石墨烯吸附剂而言, 循环再生利用至关重要的. 能循环使用的石墨烯吸附剂才是低成本的吸附剂. 已有的研究已经在设计石墨烯吸附剂时考虑到循环再生利用.
第一种方法是直接将污染物燃烧除去. 石墨烯海绵在循环再生利用上的最好的性能之一是它能够经受燃烧而不被破坏. 石墨烯海绵有着较高的热导性以及在高温时的相对稳定性. 相反, 有机污染物在高温时会燃烧或蒸发. 利用这一区别, 可以在火上直接燃烧石墨烯海绵, 除掉吸附上去的污染物, 实现循环再生利用. Wu等[79]利用RGO吸附丙烯腈、对氯苯磺酸、1-萘磺酸和亚甲基蓝之后, 将RGO加热到450 ℃下反应100 min. 这种方法可将污染物全部燃烧,循环五次吸附量几乎不受影响. Bi等[17]通过在火上燃烧吸附剂实现了对RGO的循环再生利用. 燃烧处理十次以后, RGO海绵对甲苯和十二烷的吸附量仍保持在99%以上. Zhao等[18]报道在火上直接燃烧石墨烯多孔结构可以实现循环再生利用, 9个循环以后吸附量仍能达到151 g/g. Zhao等[19]发现将石墨烯海绵放在火上燃烧, 循环利用6次以后对罗丹明B的吸附量仅会减少2.3%. 与直接燃烧类似, Geng等[34]在400 ℃密封氩气环境中热处理RGO-Fe3O4复合材料, 在5个循环之内吸附量只有很小的变化.
第二种方法是直接洗脱污染物. 染料和有机污染物能够通过疏水洗脱液从吸附剂上洗脱出去. 因为洗脱液较高的疏水性能够更好的溶解污染物, 洗脱液能将污染物从石墨烯吸附剂中萃取出来. Li等[44]用乙醇洗涤RGO-Mg(OH)2,实现了循环再生利用. 4个循环后, 吸附剂的吸附量几乎保持不变. RGO-Fe3O4复合材料能够用乙二醇洗涤来完成循环再生利用[36]. 5个循环之后, 吸附量还能保持超过80%. Ai等[83]发现乙醇作为洗脱液处理5个循环之后, 磁性石墨烯-Fe3O4的吸附量能从15 mg/g减少到9 mg/g. GO与β-环糊精-壳聚糖@Fe3O4连接之后的复合材料用乙醇清洗12 h同样实现循环再生利用[31], 但每次循环之后, 吸附量都会减少. 5个循环之后, 相比于初始的84.32 mg/g, 吸附量仅剩余30 mg/g. Maliyekkal等[81]用正己烷洗脱毒死蜱、硫丹和马拉硫磷, 循环再生利用GO和RGO, 超过90%污染物能够脱附.
第三种方法是在一定pH下实现脱附. GO和RGO上的羧基在不同的pH条件下质子化程度不同. 污染物的离子化作用也会受到pH的影响. 因此, 可以通过改变pH值来提高脱附效率, 实现循环再生利用. Fan等[30]在磁性GO吸附处理了亚甲基蓝以后, 用0.5 mol/L的NaOH进行洗脱(洗脱率达到了95%). 而HCl(脱附率5.1%)和双氧水(脱附率1.4%)不是理想的洗脱液. 在五个循环之后, 脱附的速率达到75%. 洗脱法的优点是适合处理金属污染物, 因为燃烧法不能用于处理金属污染物. Madadrang等[60]研究了Pb2+在GO-EDTA上的脱附情况. 在pH 2时脱附率能达到90%. Zhang等[49]报道GO-壳聚糖复合材料能在硝酸处理后脱附Cu2+. 此时, -NH2质子化成-NH3+, 与Cu2+有强烈的静电排斥作用. 石墨烯-MnO2复合材料能在0.1 mol/L的HCl中脱附Ni2+, 脱附率达97.6%[69]. 在5个循环后, 脱附率仍能达到91.1%. HCl的脱附效果比EDTA和硼酸好. Song等[70]在石墨烯-多元酚吸附处理Pb2+之后, 用0.1 mol/L的HCl进行脱附. 脱附在25 ℃下搅拌60 min完成, 脱附率在85%~90%之间. Wu等报道pH 3的乙醇促使副品红从石墨烯-Fe3O4上脱附, 脱附率达到93%. 在Ren等[42]的研究中, 为了能循环利用石墨烯-MnO2吸附剂, 吸附剂在吸附Cu2+与Pb2+之后用0.1 mol/L的HCl溶液洗脱. 4个循环以后, 吸附剂对Cu2+的吸附量仍有1474.4 μmol/g, 对Pb2+的吸附量为661.2 μmol/g. 由于GO-壳聚糖-Fe3O4复合材料在高pH条件下对活性黑5的吸附较少[76], 所以可以增加pH到12来实现脱附(脱附率达81%). Fan等[68]报道过Pb2+在GO-壳聚糖-Fe3O4上吸附是可逆性. pH为1时, 脱附率达90.3%; pH 2时, 脱附速率达90.1%. 5个循环以后, 吸附剂的吸附量仍有75%.
除此之外, 还可将上述三种方法联合使用. Wang等报道碱性品红在石墨烯-Fe3O4上的脱附率达到94%, 采用的洗脱液为乙醇(用0.1 mol/L的HCl调节pH为2). Zhang等[58]采用往甲醇中加入醋酸的方法来洗脱GO所吸附的亚甲基蓝, 脱附率为37%. 乙酸浓度对脱附率几乎没有影响. Liu等[82]报道在GO-壳聚糖吸附Au3+与Pb2+之后用硫脲-HCl来洗脱, 脱附率分别是99.89%与99.38%. 三个循环以后, 脱附率仍然高达98.7%.
7 结论
综上所述, 我们总结了目前石墨烯吸附材料的研究成果. 石墨烯吸附材料在水处理领域上有巨大的应用前景. 为了促进将来的研究和实际应用, 更多的研究力量应放在下面的事项上.
设计高效能的石墨烯吸附剂是研究的重点. 首先, 静电相互作用是最优先考虑的, 静电作用应该是能增强或避免的. 为改变GO吸附剂的电荷性, 我们建议对GO进行还原和官能化. 切合实际需要的官能化是未来设计的重点. 还应该优化石墨烯吸附剂的分散状态. 高分散性的石墨烯吸附剂有着优良的吸附动力学, 但是在吸附剂处理完成污染物之后, 吸附剂很难从体系中分离出去. 更好的选择是设计多孔结构的石墨烯材料, 既能实现快速扩散, 又易于分离.第四, 生产石墨烯吸附剂的成本需要降低, 生产路线需要更优化. 而且, 吸附实验的参数也需要仔细的最优化, 避免使用极端条件.
另一个值得深入研究的是石墨烯吸附材料的可循环利用性. 即使现在很多的研究结果已经表明石墨烯吸附剂具有循环可利用性, 但是这些研究往往只评价几个吸附循环过程中石墨烯吸附量的变化. 当石墨烯吸附剂在实际污水处理中应用时, 能经受更多循环的吸附剂才有价值, 能大大降低石墨烯吸附剂的使用成本. 为了实现循环利用, 优化污染物与石墨烯之间的相互作用强度至关重要. 污染物与吸附剂之间太强的作用力将会阻碍脱附. 在火上直接燃烧的方法是最有希望的一类, 但仅限于有机污染物. 未来的研究需控制燃烧参数, 因为直接燃烧处理或多或少的会导致石墨烯的损耗.
同时, 应该将对石墨烯吸附材料的应用研究上升到真实污染物样本上. 目前的研究主要采用模型污染物来评价石墨烯吸附剂的性能. 这在研究的初始阶段是可行的, 使得吸附剂的探索更加简易. 在石墨烯吸附剂的吸附量、动力学、热力学以及影响因素等基础数据大量积累的今天, 石墨烯吸附材料的研究应该推进到更高的水平, 与实际污水处理结合起来. 能够处理真实污染物样本是关键的一步. 真实污染物的样本更复杂, 吸附和脱附条件需要仔细摸索. 处理后水的质量也应该用更丰富的分析技术来进行监测.
最后, 石墨烯吸附材料的生物安全性需要更多关注. 石墨烯的毒性已有报道[11]. 石墨烯对细菌、细胞、动物、以及植物等来说是具有较低低毒性. 相关研究已在文献中有良好的总结[84-85]. 在生产、运输、使用以及循环利用石墨烯吸附剂的过程中, 石墨烯可能无可避免的会泄露到环境中去, 石墨烯吸附材料的生态毒性需要更多研究.
[1] GEIM A K. Graphene: Status and prospects [J]. Science, 2009, 324: 1530-1534.
[2] RAO C N R, SOOD A K, SUBRAHMANYAM K S, et al. Graphene: The new two-dimensional nanomaterial [J]. Angew Chem Int Ed, 2009, 48: 7752-7777.
[4] SCHWIERZ F. Graphene Transistors [J]. Nat Nanotechnol, 2010, 5: 487-496.
[6] YOUNG R J, KINLOCH I A, GONG L, et al. The mechanics of graphene nanocomposites [J]: a review. Compos Sci Technol, 2012, 72: 1459-1476.
[7] ZHAO G, WEN T, CHEN C, et al. Synthesis of graphene-based nanomaterials and their application in energy-related and environmental-related areas [J]. RSC Adv, 2012, 2: 9286–9303.
[8] HUMMERS JR W S, OFFERMAN R E. Preparation of graphitic oxide. [J]. Am Chem Soc, 1958, 80: 1339-1346.
[9] KOVTYUKHOVA N I, OIIOVVIER P J, MARTIN B R, et al. Layer-by-Layer assembly of ultrathin composite films from micron-sized graphite oxide sheets and polycations [J]. Chem Mater, 1999, 11: 771-778.
[10] MISHRA A K, RAMAPRABHU S. Functionalized graphene sheets for arsenic removal and desalination of sea water [J]. Desalination, 2011, 282: 39-45.
[11] CHANG Y L, YANG S T, LIU J H, et al. In vitro toxicity evaluation of graphene oxide on A549 cells [J]. Toxicol Lett, 2011, 200: 201-210.
[12] LIU F, CHUNG S O H, SEO G, et al. Three-dimensional graphene oxide nanostructure for fast and efficient water-soluble dye removal [J]. ACS Appl Mater Interfaces, 2011, 4: 922-927.
[13] WANG Q, LI J, SONG Y, et al. Facile synthesis of high-quality plasma-reduced graphene oxide with ultrahigh 4, 4′-dichlorobiphenyl adsorption capacity [J]. Chem Asian J, 2013, 8: 225-231.
[14] MI X, HUANG G, XIE W, et al. Preparation of graphene oxide aerogel and its adsorption for Cu2+ions [J]. Carbon, 2012, 50: 4856-4864.
[15] YU B, XU J, LIU J H, et al. Adsorption behavior of copper ions on graphene oxide-chitosan aerogel [J]. J. Environ Chem Eng, 2013, 1: 1044-1050.
[16] ZHAO L, DONG P, XIE J, et al. Porous graphene oxide-chitosan aerogel for tetracycline removal [J]. Mater Res Express, 2014, 1: 015601
[17] BI H, XIE X, YIN K, et al. Spongy graphene as a highly efficient and recyclable sorbent for oils and organic solvents [J]. Adv Funct Mater, 2012, 22: 4421-4425.
[18] ZHAO Y, HU C, HU Y, et al. A versatile, ultralight, nitrogen-doped graphene framework [J]. Angew Chem Int Ed, 2012, 124: 11533-11537.
[19] ZHAO J, REN W, CHENG H. Graphene sponge for efficient and repeatable adsorption and desorption of water contaminations [J]. J Mater Chem, 2012, 22: 20197-20202.
[20] WANG J, SHI Z, FAN J, et al. Self-assembly of graphene into three-dimensional structures promoted by natural phenolic acids [J]. J Mater Chem, 2012, 22: 22459-22466.
[21] SUI Z, MENG Q, ZHANG X, et al. Green synthesis of carbon nanotube-graphene hybrid aerogels and their use as versatile agents for water purification [J]. J Mater Chem, 2012, 22: 8767–8771.
[22] CHOUCAIR M, TSE N M K, HILL M R, et al. Adsorption and desorption characteristics of 3-dimensional networks of fused graphene [J]. Surf Sci,2012, 606: 34-39.
[23] MADADRANG C J, KIM H Y, GAO G, et al. Adsorption behavior of EDTA-graphene oxide for Pb (II) removal [J]. ACS Appl Mater Interfaces, 2012, 4: 1186-1193.
[24] ZHAO G, JIANG L, HE Y, et al. Sulfonated graphene for persistent aromatic pollutant management [J]. Adv Mater, 2011, 23: 3959-3963.
[25] YANG T, LIU L, LIU J, et al. Cyanobacterium metallothionein decorated graphene oxide nanosheets for highly selective adsorption of ultra-trace cadmium [J]. J Mater Chem, 2012, 22: 21909-21916.
[26] WU Y, LUO H, WANG H, et al. Adsorption of hexavalent chromium from aqueous solutions by graphene modified with cetyltrimethylammonium bromide [J]. J Colloid Interface Sci, 2013, 394: 183-191.
[27] SONG H, HAO L, TIAN Y, et al. Stable and water-dispersible graphene nanosheets: sustainable preparation, functionalization, and high-performance adsorbents for Pb2+[J]. ChemPlusChem, 2012, 77:379–386.
[28] HE F, FAN J, MA D, et al. The attachment of Fe3O4nanoparticles to graphene oxide by covalent bonding [J]. Carbon, 2010, 48: 3139-3144.
[29] YAO Y, MIAO S, YU S, et al. Fabrication of Fe3O4/SiO2core/shell nanoparticles attached to graphene oxide and its use as an adsorbent [J]. J Colloid Interface Sci, 2012, 379: 20-26.
[30] FAN L, LUO C, LI X, et al. Fabrication of novel magnetic chitosan grafted with graphene oxide to enhance adsorption properties for methyl blue [J]. J Hazard Mater, 2012, 215-216, 272-279.
[31] FAN L, LUO C, SUN M, et al. Synthesis of magnetic β-cyclodextrin–chitosan/graphene oxide as nanoadsorbent and its application in dye adsorption and removal [J]. Colloids Surf, B, 2013, 103: 601-607.
[32] XIE G, XI P, LIU H, et al. A facile chemical method to produce superparamagnetic graphene oxide-Fe3O4hybrid composite and its application in the removal of dyes from aqueous solution [J]. J Mater Chem, 2012, 22: 1033-1039.
[33] WANG C, FENG C, GAO Y, et al. Preparation of a graphene-based magnetic nanocomposite for the removal of an organic dye from aqueous solution [J]. Chem Eng J, 2011, 173: 92-97.
[34] GENG Z, LIN Y, YU X, et al. Highly efficient dye adsorption and removal: a functional hybrid of reduced graphene oxide-Fe3O4nanoparticles as an easily regenerative adsorbent [J]. J Mater Chem, 2012, 22: 3527-3535.
[35] LUO X, WANG C, LUO S, et al. Adsorption of As (III) and As (V) from water using magnetite Fe3O4-reduced graphite oxide–MnO2nanocomposites [J]. Chem Eng J, 2012, 187: 45-52.
[36] SUN H, CAO L, LU L. Magnetite/reduced graphene oxide nanocomposites: One step solvothermal synthesis and use as a novel platform for removal of dye pollutants [J]. Nano Res, 2011, 4: 550-562.
[37] CHANG Y, REN C, QU J, et al. Preparation and characterization of Fe3O4/graphene nanocomposite and investigation of its adsorption performance for aniline and p-chloroaniline [J]. Appl Surf Sci, 2012, 261: 504-509.
[38] WU Q, FENG C, WANG C, et al. A facile one-pot solvothermal method to produce superparamagnetic graphene–Fe3O4nanocomposite and its application in the removal of dye from aqueous solution [J]. Colloids Surf, B, 2013, 101: 210-214.
[39] GUO J, WANG R, TJIU W W, et al. Synthesis of Fe nanoparticles@graphene composites for environmental applications [J]. J Hazard Mater, 2012, 225-226, 63-73.
[40] ZHU J, WEI S, GU H, et al. One-pot synthesis of magnetic graphene nanocomposites decorated with core@double-shell nanoparticles for fast chromium removal [J]. Enviro Sci Technol, 2011, 46: 977-985.
[41] HAO L, SONG H, ZHANG L, et al. SiO2/graphene composite for highly selective adsorption of Pb (II) ion [J]. J Colloid Interface Sci, 2012, 369: 381-387.
[42] REN Y, YAN N, FENG J, et al. Adsorption mechanism of copper and lead ions onto graphene nanosheet/δ-MnO2[J]. Mater Chem Phys, 2012, 136: 538-544.
[43] ZHANG K, DWIBEDI V, CHI C, et al. Graphene oxide/ferric hydroxide composites for efficient arsenate removal from drinking water [J]. J Hazard Mater, 2010, 182: 162-168.
[44] LI B, CAO H, YIN G. Mg(OH)2@reduced graphene oxide composite for removal of dyes from water [J]. J Mater Chem, 2011, 21: 13765-13768.
[45] GAO W, MAJUMDER M, ALEMANY L B, et al. Engineered graphite oxide materials for application in water purification [J]. ACS Appl Mater Interfaces, 2011, 3: 1821-1826.
[46] SREEPRASAD T, MALIYEKKAL S M, LISHA K, et al. Reduced graphene oxide–metal/metal oxide composites: facile synthesis and application in water purification [J]. J Hazard Mater, 2011, 186: 921-931.
[47] ZHANG M, GAO B, YAO Y, et al. Synthesis, characterization, and environmental implications of graphene-coated biochar [J]. Sci Total Environ, 2012, 435-436: 567-572.
[48] YANG X, TU Y, LI L, et al. Well-dispersed chitosan/graphene oxide nanocomposites [J]. ACS Appl Mater Interfaces, 2010, 2: 1707-1713.
[49] ZHANG N, QIU H, SI Y, et al. J. Fabrication of highly porous biodegradable monoliths strengthened by graphene oxide and their adsorption of metal ions [J]. Carbon, 2011, 49: 827-837.
[50] ZENG Q, CHENG J S, LIU X F, et al. J. H. Palladium nanoparticle/chitosan-grafted graphene nanocomposites for construction of a glucose biosensor [J]. Biosens Bioelectron, 2011, 26: 3456-3463.
[51] PAN Y, WU T, BAO H, et al. Green fabrication of chitosan films reinforced with parallel aligned graphene oxide [J]. Carbohydr Polym, 2011, 83: 1908-1915.
[52] CHENG J, DU J, ZHU W. Facile synthesis of three-dimensional chitosan–graphene mesostructures for reactive black 5 removal [J]. Carbohydr Polym, 2012, 88: 61-67.
[53] LIU L, LI C, BAO C, et al. Preparation and characterization of chitosan/graphene oxide composites for the adsorption of Au(III) and Pd(II) [J]. Talanta, 2012, 93: 350-357.
[54] CHEN Y, CHEN L, BAI H, et al. Graphene oxide-chitosan composite hydrogels as broad-spectrum adsorbents for water purification [J]. J Mater Chem, A, 2013, 1: 1992-2001.
[55] YANG S-T, LUO J, LIU J, et al. Graphene oxide/chitosan composite for methylene blue adsorption [J]. Nanosci Nanotechnol Lett, 2013, 5: 372-376.
[56] YUAN Y, ZHANG G, LI Y, et al. Poly(amidoamine) modified graphene oxide as an efficient adsorbent for heavy metal ions [J]. Polym Chem, 2013, 4: 2164-2167.
[57] YANG S-T, CHEN S, CHANG Y, et al. Removal of methylene blue from aqueous solution by graphene oxide [J]. J Colloid Interface Sci, 2011, 359: 24-29.
[58] ZHANG W, ZHOU C, ZHOU W, et al. Fast and considerable adsorption of methylene blue dye onto graphene oxide. Bull. Environ [J]. Contam Toxicol, 2011, 87: 86-90.
[59] RAMESHA G, VIJAYA KUMARA A, MURALIDHARA H, et al. Graphene and graphene oxide as effective adsorbents toward anionic and cationic dyes [J]. J Colloid Interface Sci, 2011, 361: 270-277.
[60] MADADRANG C J, KIM H Y, GAO G, et al. Adsorption behavior of EDTA-graphene oxide for Pb (II) removal [J]. ACS Appl Mater Interfaces, 2012,4: 1186-1193.
[61] YANG S-T, CHANG Y, WANG H, et al. Folding/aggregation of graphene oxide and its application in Cu2+removal [J]. J Colloid Interface Sci, 2010, 351: 122-127.
[62] YANG S-T, WANG H F, GUO L, et al. Interaction of fullerenol with lysozyme inwestigated by experimental and computational approaches [J]. Nanotechnology, 2008, 19: 395101.
[63] LIU Y, LI Y, YAN X P. Preparation, characterization, and application of L-cysteine functionalized multiwalled carbon nanotubes as a selective sorbent for separation and preconcentration of heavy metals [J]. Adv Funct Mater, 2008, 18: 1536-1543
[64] BOYD R S. Heavy metal pollutants and chemical ecology: Exploring new frontiers[J]. J Chem Ecol, 2010, 36: 46-58.
[65] PASSOW H, CLARKSON T W, ROTHSTEIN A. The general pharmacology of the heavy metals [J]. Pharmacol Rev, 1961, 13: 185-224.
[66] REN X, LI J, TAN X, et al. Comparative study of graphene oxide, activated carbon and carbon nanotubes as adsorbents for copper decontamination [J]. Dalton Trans, 2013, 42: 5266-5274.
[67] HUANG Z, ZHENG X, LV W, et al. Adsorption of lead (II) ions from aqueous solution on low-temperature exfoliated graphene nanosheets [J]. Langmuir, 2011, 27: 7558-7562.
[68] FAN L, LUO C, SUN M, et al. Highly selective adsorption of lead ions by water-dispersible magnetic chitosan/graphene oxide composites [J]. Colloids Surf, B, 2013, 103: 523-529.
[69] REN Y, YAN N, WEN Q, et al. Graphene/δ-MnO2composite as adsorbent for the removal of nickel ions from wastewater [J]. Chem Eng J, 2011, 175: 1-7.
[70] SONG H, HAO L, TIAN Y, et al. Stable and water-dispersible graphene nanosheets: sustainable preparation, functionalization, and high-performance adsorbents for Pb2+[J]. Chem Plus Chem, 2012, 77: 379-386.
[71] ZHU J, WEI S, GU H, et al. One-pot synthesis of magnetic graphene nanocomposites decorated with core@double-shell nanoparticles for fast chromium removal [J]. Enviro Sci Technol, 2011, 46: 977-985.
[72] LUO X, WANG C, LUO S, et al. Adsorption of As (III) and As (V) from water using magnetite Fe3O4-reduced graphite oxide–MnO2nanocomposites [J]. Chem Eng J, 2012, 187: 45-52.
[73] XIA Y, XIA L. Comparative study of methylene blue dye adsorption onto activated carbon, graphene oxide, and carbon nanotubes [J]. Chem Eng Res Des, 2013, 91: 361-368.
[74] LIU T, LI Y, DU Q, et al. Adsorption of methylene blue from aqueous solution by graphene [J]. Colloids Surf B, 2012, 90: 197-203.
[73] LI B, CAO H, YIN G. Mg(OH)2@reduced graphene oxide composite for removal of dyes from water [J]. J. Mater Chem ,2011, 21: 13765-13768.
[76] TRAVLOU N A, KYZAS G Z, LAZARIDISS N K, et al. Functionalization of graphite oxide with magnetic chitosan for the preparation of a nanocomposite dye adsorbent [J]. Langmuir, 2013, 29: 1657-1668.
[77] SUN L, YU H, FUGETSU B. Graphene oxide adsorption enhanced by in situ reduction with sodium hydrosulfite to remove acridine orange from aqueous solution [J]. J Hazard Mater, 2012, 203: 101-110.
[78] GAO Y, LI Y, ZHANG L, et al. Adsorption and removal of tetracycline antibiotics from aqueous solution by graphene oxide. [J] J Colloid Interface Sci, 2012, 368: 540-546.
[79] WU T, CAI X, TAN S, et al. Adsorption characteristics of acrylonitrile, p-toluenesulfonic acid, 1-naphthalenesulfonic acid and methyl blue on graphene in aqueous solutions [J]. Chem Eng J, 2011, 173: 144-149.
[80] SUN Y, CHEN C, SHAO D, et al. Enhanced adsorption of ionizable aromatic compounds on humic acid-coated carbonaceous adsorbents [J]. RSC Adv, 2012, 2: 10359-10364.
[81] MALIYEKKAL S M, SREEPRASAD T S, KRISHNAN D, et al. Graphene: A reusable substrate for unprecedented adsorption of pesticides [J]. Small, 2013, 9: 273-283.
[82] LIU L, LI C, BAO C, et al. Preparation and characterization of chitosan/graphene oxide composites for the adsorption of Au(III) and Pd(II) [J]. Talanta, 2012, 93: 350-357.
[83] AI L, ZHANG C, CHEN Z. Removal of methylene blue from aqueous solution by a solvothermal-synthesized graphene/magnetite composite [J]. J Hazard Mater, 2011, 192: 1515-1524.
[84] YANG K, LI Y, TAN X, et al. Behavior and toxicity of graphene and its functionalized derivatives in biological systems [J]. Small, 2012, 9: 1492-1503.
[85] HU X, ZHOU Q. Health and ecosystem risks of graphene [J]. Chem Rev, 2013, 113: 3815-3835.
Advances in the preparation and applications of graphene adsorbent materials
YANG Sheng-Tao, ZHAO Lian-qin
(College of Chemistry and Environmental Protection Engineering, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
Due to the unique structure and fascinating properties, graphene holds great potential in various areas. All atoms of graphene sheets are surface atoms, so graphene has large surface area and graphene materials are ideal adsorbents. Because graphene materials are easy to prepare and the operating costs are low, graphene adsorbent materials have attracted large interests in water treatment. Graphene and its derivatives have been applied in remediating heavy metals, dyes, pesticides, antibiotics, oils, and so on. In the review, the advances are summarized in the preparation and application of graphene adsorbent materials, in particular the applications in water treatment. The adsorption behaviors of pollutants on graphene materials are analyzed, and the interactions between pollutants and graphene materials are discussed. The influence of functional groups is emphasized on the performance of graphene adsorbent materials. Some guidelines in designing high-performance graphene adsorbents are also proposed.
graphene; adsorbent material; water treatment; nanotechnology
O613,X703
A
1003-4271(2014)02-0203-16
10.3969/j.issn.1003-4271.2014.02.08
2014-02-18
杨胜韬(1985-), 男, 博士, 副教授, 研究方向: 碳纳米材料的制备、应用及安全性研究. Email: yangst@pku.edu.cn.
四川省科技支撑计划(No. 2013FZ0060)和国家自然科学基金青年基金项目(No. 21307101)
