生物类似物研究领域的知识图谱分析及其对我国政策启示
2014-03-15陈名,邵蓉
陈 名,邵 蓉
( 中国药科大学医药产业发展研究中心,江苏 南京 211198)
1 引言
伴随着生物药品专利的陆续到期,一些制药公司开始着手研发生物类似物(即生物仿制药)。为了规范生物医药市场的可持续发展和保障患者的用药安全,探索生物类似物行之有效的监管体系已成为生物医药产业发展的重要课题之一。
在世界范围内,欧洲药品管理局(EMEA)、世界卫生组织(WHO)和美国食品药品监督管理局(FDA)等已出台较完善的生物类似物指南。目前,我国药品管理当局正积极探索这一指南以规范促进该行业的科学发展。
2 数据来源和方法
2.1 数据来源
在Web of Science 中,以数据库= SCI-EXPANDED,CCR-EXPANDED,IC,主题词= “biosimilar* ”OR“follow-on biologic* ”OR“follow-on biological product* ”,文献类型=Article,选择题录信息,不限时间跨度进行检索 (数据更新至2013/09/19),实得2004—2013 年间374 篇文献。
2.2 研究方法
选择基于Java 程序的信息可视化软件CiteSpace II[1]作为生物类似物知识图谱的分析工具。通过共现网络、共词分析和文献共被引等方法,从文章发表时间、地区分布、所属机构和研究内容等方面来探索世界范围内生物类似物研究的基本情况、研究热点和未来可能的发展趋势,并寻求适合我国国情的生物类似物政策启示。
3 数据分析和结果
3.1 生物类似物研究的时间分布
一个研究领域的年度发文量变化趋势可从侧面反映该领域的研究发展状况。在SCI 文献数量方面(见图1),以生物类似物为主题的研究始于2004 年,2004—2011 年间逐年递增,于2011 年达高峰。欧盟早在1998 年就已陆续发布一系列生物类似物指导原则,2004 年在世界上首次正式起草生物类似物审批指南(2005 年10 月30 日正式生效)。美国总统奥巴马于2010 年3 月签发《患者保护与平价医疗法》,并在《生物制剂价格竞争与创新法》部分创建了生物类似物缩短审批途径。2010 年4 月,WHO 正式发布用于指导各成员国生物类似物评估的指南。同时,世界上其他国家和地区也逐渐意识到生物类似物监管的重要性。

图1 2004—2013 年生物类似物研究发展趋势
3.2 生物类似物研究的空间分布
(1)国家共现网络分析。以2004—2013 年为时间跨度,时间切片为1,用Pathfinder 剪枝算法进行生物类似物研究领域的国家共现网络分析(见图2)。图2 中每个节点代表一个国家,年轮粗细表示该国的发文频率。

图2 生物类似物研究的国家共现网络
SCI 数据库中生物类似物文献来自55 个国家和地区,按发文数量排序,美国、德国和英国在世界上遥遥领先。在欧洲,以德国和英国为代表国家,这两国科技与经济实力雄厚,拥有先进的医药科研机构。欧洲各国统一遵照欧盟生物类似物法案进行药品的注册审批,相互交流与合作紧密。美国作为世界第一医药强国,由FDA 制定专门的生物类似物法案,因此,图2 节点中自形成一个聚类核心。在亚洲,以中国台湾、日本和印度为代表,这些国家的节点较小,属于生物类似物研究领域中的新兴国家。国家共现网络图反映科学合作和合作规模,可间接判断论文研究的深度和广度、学科性质等。研究发现,国际合作度大的国家或地区产文量相对高,如美国、德国,而我国的国际合作度尚有待提高。
(2)研究机构共现网络分析。以2004—2013年为时间跨度,时间切片为1,用Pathfinder 算法进行机构共现网络分析。研究机构主要分为三大聚类:①以杜克大学和安进公司为代表,中国台湾和加拿大高校与之形成共引网络;②根据节点大小和年轮色彩发现荷兰乌得勒支大学近年来逐渐成为欧洲生物类似物研究的核心机构;③德国临床药物研发合作中心是一个致力于药物非临床与临床试验的研究机构,关注药品相似性研究,涉及药代动力学和药效学(PK/PD)研究及临床数据等,以2010 年前关于生物类似物的研究形成一聚类。
3.3 生物类似物的研究内容
(1)经典研究文献。本部分使用CiteSpace II对该领域有效引文进行文献共被引分析(忽略因姓名缩写与顺序造成的一作者多名误差)。以2004—2013 年为时间跨度,时间切片为1,采取Pathfinder 算法得到492 个节点、1542 条连线。经统计,被引频次≥10 的共有33 篇文献,被引频次≥15 的共9 篇,其中被引频次最高的前4 篇如下,这些是生物类似物研究领域最受关注的文章。①Mellstedt[2]等将治疗癌症的生物药以粒细胞集落刺激因子(G-CSF)、红细胞生成素(EPO)和干扰素等类别划分,参照欧盟生物类似物指南,从药物替代性、标签和命名、外推法等角度围绕如何确保类似物的安全有效性进行讨论,并明确了药品上市后药物警戒作用的重要性。②Woodcock[3]等FDA 研究者阐述了重组蛋白和非重组蛋白产品在美国FDA 申报审批的实例,并梳理美国历史上生物类似物相关法案,包括联邦食品药品化妆品法案中的(21 USC§355)及公共健康服务法中的(42 USC §262)等。③Casadevall[4]等通过血清检验发现13 位慢性肾衰贫血患者经临床使用放射性标记的EPO,产生了抗EPO 的中和抗体并出现红细胞再生障碍症状。④Schellekens[5]等表明影响治疗性蛋白免疫原性的因素,除了蛋白质空间结构、储藏条件、使用剂量和治疗期的长短,也源于抗体影响蛋白质的活性。其中,Mellstedt 和Woodcock 共同表明生物类似物不可依照化学仿制药与参比药物间相同的化学成分与生物等效性(Equivalence)的衡量标准来研发,而需以可比相似性(Comparability)来保障药品的临床效用与安全性。Casadevall 和Schellekens 强调中和抗体会影响EPO的活性,甚至导致慢性贫血患者红细胞再生障碍,在临床使用时应注意。
(2)关键演进路径。因欧盟于2005 年10 月30 日在世界上首次正式生效生物类似物指南,随后其他国家地区开始致力于政策研究,因此,将2005 年作为路径演进时期的划分时点,可将该领域研究大致分为形成期→发展期。
在形成期(2002—2005 年),具有代表意义的三篇文献Casadevall (2002)、Schellekens (2004)和Schellekens (2005)从分子层面和试验角度说明影响生物类似物有效性与安全性的因素,并用试验数据证明类似物与参比药物间相似性的重要性。其中Schellekens[7]通过评价八个不同国家EPO 产品的生物活性,有五款样品竟不能满足WHO 规定的71% ~226%标准活性范围,强调药品生产商应注重生物类似物的生产过程控制并将试验数据如实反应于药品说明书,呼吁药监部门设立科学全面的生物类似物审批与监管指南。
在发展期(2006—2008 年),生物类似物领域研究主要为指南构建与政策监管。Roger(2006)、Woodcock (2007)和Mellstedt (2008)均表示生物类似物与化学仿制药在仿制意义上的不同。在政策构建方面,除FDA 与EMEA 外,Roger[8]指出澳大利亚药物治疗管理局(TGA)将采纳欧盟的相关指导原则。目前,生物药的专利到期也刺激着单克隆抗体生物类似物的迅速发展,Schneider[9]表示单抗研发与生产中面临着巨大挑战(投资高且与参比药物间分子结构和生产操作方面的微小变化就可能引起有效性的显著差异),探讨单抗产品在欧盟现有监管指南下研发的可行性,建议单抗生产商应在研发早期寻求科学的政策建议。
近年来,生物医药产业在各类疾病治疗领域实现突破,尤其在糖尿病、癌症、血友病以及免疫系统缺陷等领域正逐渐满足日益增长的患者需求。EMEA、FDA 和TGA 在实践中不断更新生物类似物指南以创造更加科学的准入机制和监管原则,我国也积极探索着。预测在该领域研究发展期后将逐渐迎来其成熟期,将伴随着更加完善的政策与更多的类似物审批上市。
(3)研究热点。关键词是文章的核心与精髓,能够对研究主题进行高度概括与集中描述,因此,利用高频关键词来判断一个专业研究领域的热点。以2004—2013 年为时间跨度,时间切片为1,用Pathfinder 算法剪枝,每片截取前50 个高频关键词进行关键词共现分析,共得2 个聚类(1*和2*)、241 个节点和521 条连线。
选取中心度≥0.10、频次≥20 的节点,剔除文献基础词与特征词,如biosimilar (生物类似物)、follow-on biologic (生物类似物)、protein(蛋白质)等,进一步筛选数据以明确生物类似物研究领域热点(见表1)。

表1 生物类似物研究热点
免疫原性是研究聚类1*的重要关键词。所有生物制剂都存在免疫原性,会增强或降低药物生物活性,引起免疫反应或并发症等不良反应,是生物类似物研究中需面临的安全问题。在临床方面,EPO 适用于慢性肾衰患者,然而作为一种生物制剂,它对机体具有一定的抗原性,刺激机体免疫反应的产生,相应的抗EPO抗体中和外源性与内源性EPO,使之失活继而导致红细胞再生障碍,大量研究围绕这方面进行了试验探索,也常被引为实例用以指导原则的构建。中和抗体也是影响生物类似物活性的一大因素(聚类2*)。
(4)研究前沿。研究前沿可理解为研究对象的临时突变组合,根据关键词词频变化的大小来确定领域的研究前沿和发展趋势。其中,膨胀词(Burst Term) 是频次变化率高的词。利用CiteSpace II 软件的膨胀词探测功能,得到生物类似物领域中膨胀系数较高的膨胀词(见表2,筛选频次≥15)。
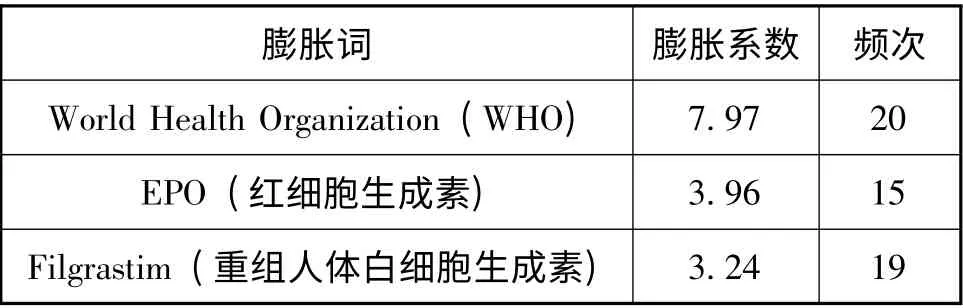
表2 膨胀系数较高的膨胀词
膨胀词知识图谱数据显示WHO、EPO 和Filgrastim 是膨胀系数较高的词,代表近些年来生物类似物的国际研究前沿和发展趋势。2009 年10月,WHO 发布用于指导各成员国的《治疗性生物制品相似物评价指导原则》,内容包括化学仿制药的申请步骤不适于生物类似物,并介绍了证明生物类似物与参比药物间的可比性所需的质量、非临床和临床等方面的技术要求[10]。对于EPO 和Filgrastim 的研究,多年来一直有生产商和学者致力于此。
4 政策启示
4.1 明确生物类似物的概念界定,提出合理有效的缩短审批途径
在欧盟、WHO 和美国已出台的生物类似物指南中,欧盟 (指南CHMP/437/04)将生物类似物定义为“与已通过审批的参比药物相似的生物药品”,并指明“生物类似物不是仿制药”[11]。WHO 指南采纳欧盟的相关定义,采用治疗性生物制品 (SBPs,Similar Biotherapeutic Products)来定义生物类似物。美国则将之定义为“与FDA 批准的参比药物具有高度相似性或可替代它的生物药品”[12]。我国现行《药品注册管理办法》第12 条及其附件三,以及2005版《中国药典》的三部生物治疗产品技术标准等均提出生物制品按照新药申请程序注册,但还没有明确关于生物类似物的概念界定。国内已上市生物药物多为仿制性生物制品,在治疗领域发挥了重要作用。相比我国现实要求,国外生物类似物指南不能完全适用于我国,需制定适合我国实际情况的指导原则,首先应明确生物类似物的概念界定。
我国《药品注册管理办法》第12 条规定“生物制品仿制药按照新药申请程序注册”,这意味着需要提供完整的非临床和临床试验数据,无疑会增加企业的研发费用,递交数据申报后,也不得不面临审批周期长的局面。该规定对于那些与参比药物具有极高相似度的药品不太适用,这些药品本可以节约临床II 期的研究成本,并省去这部分时间来加速审批,提早上市。WHO 指南对于这类具高度相似性的生物类似物,表明完整的毒性研究和与使用剂量相关的临床II 期试验可免去,但审批必须提供临床III 期数据。美国也在《生物制剂价格竞争与创新法》中创建了生物类似物的缩短审批途径。建议在我国生物类似物指南构建中,对于与参比药物具高相似性的生物类似物,提出适合生物医药产业发展的合理有效的缩短审批途径。
4.2 完善不同类别药品的质量标准,重视生物类似物的生产过程管理
由于生物药品各品种间差异巨大,很难在一个评价体系中顾及所有品种,建议可为每一品种单独建立标准。欧盟就有针对不同产品类别的生物类似物指南与草案。同时,由于目前国内生物制品成分标准相对简单,与国际上通行标准相比缺少含量和制度方面等指标,这不利于对产品质量的综合控制,建议提高生物类似物的质量标准,尤其在纯度和成品质量控制水平方面[13]。由于生物分子空间结构复杂,生物学活性易受各种因素影响,生产中细微的变化都可能引起极大的安全有效性差异。因此,在生物类似物的生产过程中,应将“质量源于设计”理念最优化[14],不论是在初期的细胞株筛选、细胞培养过程和生物反应器的选择,还是后期纯化等过程。
4.3 建设完整的药品检测体系和药物警戒系统,完善临床数据库
免疫原性会极大地影响生物药品的安全性,在临床前和临床研究中也具有不可预测性。因此,在生物类似物研究过程中,需要建立充分的临床数据档案和必要的药物警戒应急预案;在生产至上市过程中,建立覆盖药物生产、运输、保存和使用的完整检测体系[15];在药品上市后,建立完善的药物警戒系统和质量风险管理体系。截至目前,世界范围内生物类似物的临床经验还比较匮乏,各国都有责任积极建立和完善其临床数据库,协同发展,共同保障生物类似物临床用药的安全有效,推进生物医药产业健康可持续地发展。
[1]Chen C. CiteSpace II:Detecting and Visualizing Emerging Trends and Transient Patterns in Scientific Literature[J].Journal of the American Society for Information Science and Technology,2006,57(3):359 -377.
[2]Mellstedt H,Niederwieser D,Ludwig H. The Challenge of Biosimilars[J].Annals of oncology,2008,19(3):411 -419.
[3]Woodcock J,Griffin J,Behrman R,et al. The FDA's Assessment of Follow-on Protein Products:a Historical Perspective[J].Nature Reviews Drug Discovery,2007,6(6):437 -442.
[4]Casadevall N,Nataf J,Viron B,et al. Pure Red -cell Aplasia and Antierythropoietin Antibodies in Patients Treated with Recombinant Erythropoietin[J].New England Journal of Medicine,2002,346(7):469 -475.
[5]Schellekens H. Factors Influencing the Immunogenicity of Therapeutic Proteins[J]. Nephrology Dialysis Transplantation,2005,20(suppl 6):vi3 -vi9.
[6]钱万强,陈涛,江海燕. 基于文献计量学的国内外干细胞研究热点分析[J].中国科技论坛,2012,(2):152 -159.
[7]Schellekens H. Biosimilar Epoetins:How Similar are They[J].Eur J Hosp Pharm,2004,3:43 -7.
[8]Roger S D. Biosimilars:How Similar or Dissimilar are They?(Review Article)[J].Nephrology,2006,11(4):341 -346.
[9]Schneider C K,Kalinke U. Toward Biosimilar Monoclonal Antibodies[J].Nature Biotechnology,2008,26(9):985 -990.
[10]World Health Organization. Guidelines on Evaluation of Similar Biotherapeutic Products (SBPs)[J/OL]. (2014 -01 -20). http://www. who. int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB_22APRIL2010. pdf
[11]European Medicines Agency. Guideline on Similar Biological Medicinal Products(CHMP/437/04)[J/OL].(2014 -01 -22).http://www. ema. europa. eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003517. pdf
[12]U. S Food and Drug Administration. Part 2:Biosimilar Biological Products[EB/OL].(2014/01/22).http://www. fda. gov/About-FDA/Transparency/Basics/ucm364686. htm
[13]常卫红,王军志. 关于生物仿制药药学研究问题的思考[J].中国药事,2008,22(1):23 -25.
[14]Schiestl M. A Biosimilar Industry View on the Implementation of the WHO Guidelines on Evaluating Similar Biotherapeutic Products[J].Biologicals,2011,39(5):297 -299.
[15]蒋舒寒. 欧美生物仿制药的发展现状综述[J].中国医药指南,2010,8(27).
