皱叶酸模提取物中大黄素的体内过程及参数测定*
2014-03-14李春英张晶吴艳卢杰王洪波
李春英张晶吴艳卢杰王洪波
皱叶酸模提取物中大黄素的体内过程及参数测定*
李春英①张晶①吴艳①卢杰①王洪波①
目的:对皱叶酸模主要药效成分大黄素在大鼠体内的药代动力学进行研究,以反映皱叶酸模药材在大鼠体内的作用规律。方法:采用高效液相色谱法检测大鼠的血液、心、脾、肾等组织、尿液及粪便中大黄素含量。结果:大黄素的血药浓度—时间曲线呈现双峰形状;灌胃后大黄素在大鼠心、脾、肾等组织均有分布,且24 h后基本消除;大黄素以原形形式排泄较少。结论:皱叶酸膜中大黄素在大鼠体内吸收入血迅速,并快速分布至各组织,且少数以原形排泄,该研究有助于阐明皱叶酸膜药理作用的物质基础及作用规律。
皱叶酸模提取物; 大黄素; 体内过程; 参数测定
皱叶酸模Rumex crispus L.为蓼科(Polygonaceae)酸模属植物,俗名土大黄。为多年生草本植物,根、根茎、叶及全草入药,性味苦、寒,具有清热解毒、泻火通便、止血、杀虫等功效。在黑龙江省大庆市区湖泊沿岸及水溪旁广泛分布,资源丰富。民间主要用于治疗鼻出血、子宫出血、血小板减少性紫癜、肠道积滞、大便秘结等症[1]。目前对皱叶酸模化学成分的研究文献[2-9]报道的主要为蒽醌类、黄酮类及多糖类成分,其中蒽醌类成分大黄素为重要的药效成分之一。本文以大黄素为指标,应用高效液相色谱技术,测定大鼠灌胃给予皱叶酸膜提取物后,大黄素在血浆、组织、排泄物中的含量变化,了解其在体内动态变化的规律,并为临床合理用药,制定最佳的给药方案提供依据。
1 材料与仪器
1.1 仪器 Agilent1100高效液相色谱仪、BP211D电子天平(sartorius)、RE-52A旋转蒸发仪(上海亚荣生化仪器厂)、KQ5200超声波清洗器(昆山市超声仪器有限公司)、SHE-D(Ⅲ)型循环水式真空泵(巩义市科瑞仪器有限公司)TGL-16C离心机(上海安亭科学仪器厂)。
1.2 药品与试剂 大黄素标准品(批号0756-200110)购自中国药品生物制品检定所、甲醇(色谱纯)、冰醋酸、乙醚、硫酸、乙酸乙酯、氯仿等均为分析纯。
1.3 实验动物 SD大鼠10只,体重(200±20)g,雌雄各半,由大庆医学高等专科学校动物室提供。
1.4 方法
1.4.1 皱叶酸膜提取物样品的制备 取皱叶酸膜干燥全草药材,粉碎,80%乙醇溶液浸泡48 h后,6倍体积回流提取2次,每次2 h,过滤,合并滤液,减压浓缩成皱叶酸膜浸膏,干燥。称取皱叶酸膜浸膏20.3 g,至烧杯中,分次加入0.5%羧甲基纤维素钠溶液共200 mL,超声助溶,制成大黄素浓度为5.6 mg/mL的混悬液,备用。
1.4.2 色谱条件 色谱柱:Zorbax SB-C18柱(5 μm,
250 mm×4.6 mm);流动相冰醋酸(99.9:0.1);流速:1.0 mL/min;检测波长:254 nm;柱温:30 ℃;进样量:20 μL,采用外标法定量测定血浆大黄素浓度。
1.4.3 对照品溶液和内标溶液的制备 精密称取大黄素对照品约5.3 mg,置于50 mL容量瓶中,用甲醇溶解稀释至刻度,摇匀,即得对照品溶液。
1.5 皱叶酸模提取物中大黄素在大鼠体内的药代动力学参数研究
1.5.1 给药与采血 SD大鼠10只,雌雄各半,给药前禁食12 h,自由饮水,灌胃皱叶酸模提取物混悬液,剂量1.0 mL/100 g(相当于大黄素0.8 mg/100 g),灌胃后眼眶静脉取血约1 mL,血样经肝素钠抗凝后分取血浆,按血浆样品处理后测定。
1.5.2 血浆样品处理方法 取大鼠血浆200 μL,加入30%硫酸200 μL,旋涡混匀30 s,水浴水解30 min。冷却,加入乙醚2 mL,漩涡混合提取5 min,3000 r/min离心5 min,倾出乙醚层,水相再用2 mL乙醚同法萃取,合并乙醚液,通氮气挥干,残渣用100 μL甲醇溶解,取20 μL进样。
1.5.3 药代动力学研究 SD大鼠8只,雌雄各半,灌胃皱叶酸模提取物混悬液后,分别于灌胃后5、15、30 min及1、2、3、4、6、9、12、24 h,眼眶静脉取血约1 mL,肝素钠抗凝后分取血浆,按血浆样品处理后测定。
1.6 皱叶酸模提取物中大黄素在大鼠体内组织分布研究
1.6.1 组织样品的预处理 组织剪碎后取0.2 g,加2 mL生理盐水匀浆后置于具塞离心管中,加入盐酸0.3 mL,涡旋混合30 s,水浴加热20 min。放置室温,加入乙酸乙酯2.5 mL,涡旋混合提取5 min,离心10 min,取乙酸乙酯层,减压浓缩至干,精密加入乙醇0.5 mL,涡旋混匀,超声1 min助溶,微孔滤膜滤过,滤液待测。
1.6.2 组织分布研究 SD大鼠,雌雄各半,给药前禁食12 h,自由饮水,灌胃皱叶酸模提取物混悬液,剂量1.0 mL/100 g,灌胃后5、10、30、60 min,处死大鼠,迅速取脑、心、肝、肾、脾组织,组织用0.9%氯化钠溶液冲净表面血液及内容物,分别称量各脏器湿重,装入自封袋,置于-20 ℃冰箱中保存至分析测定。按组织样品预处理方法处理后,测各组织中大黄素含量。
1.7 皱叶酸模提取物中大黄素在大鼠体内的排泄特点研究
1.7.1 大鼠粪便的预处理方法 取大鼠粪便样品,混匀,精密称取约0.5 g,置锥形瓶中,加乙醇2 mL,水浴上回流1 h,放冷,滤过,滤液置烧瓶中,水浴蒸干,加30%乙醇一盐酸溶液(10:1)15 mL,水解1 h,立即冷却,用氯仿强力振摇提取3次,每次15 mL,合并氯仿液,置水浴上蒸干,残渣用甲醇2.5 mL溶解,摇匀,微孔滤膜滤过,取续滤液,即得。
1.7.2 大鼠尿样的预处理方法 取大鼠尿样3 mL,加人30%盐酸3 mL,旋涡混匀,水浴水解30 min。冷却,氯仿强力振摇提取3次,每次5 mL,合并氯仿液,挥干氯仿,残渣用甲醇2.5 mL溶解,摇匀,微孔滤膜滤过,取续滤液,即得。
1.7.3 粪便及尿液大黄素含量测定 SD大鼠按1.0 mL/100 g剂量给予皱叶酸膜提取物,收集给药后0~2、2~4、4~6、6~8、8~10、10~12、12~24 h的粪便和尿液,按大鼠粪便样品和尿液样品的处理方法进行处理,测定大黄素含量。
2 结果
2.1 皱叶酸模提取物中大黄素在大鼠体内的药代动力学参数研究
2.1.1 分析方法验证
2.1.1.1 线性关系的考察 精密量取不同浓度的大黄素对照品溶液各20 μL,分别加入200 μL空白大鼠血浆中,按血浆样品的处理方法进行处理,取20 μL进样测定,以峰面积A对大黄素血浆含量C(μg/mL)进行线性回归,得回归方程为:Y=0.7485X-0.065,相关系数r=0.9991,结果表明大黄素在0.53~3.71 μg/mL范围内线性关系良好。
2.1.1.2 精密度试验 取大黄素对照品溶液20 μL,用甲醇稀释到100 μL,进样分析,连续进样5次,测得峰面积,计算出大黄素的精密度0.8%。
2.1.1.3 回收率试验 空白血浆中加入大黄素对照品甲醇溶液,按血浆样品的处理方法进行处理,记录其峰面积,以测得量与加入量之比计算回收率,为95.9%~107.5%,RSD为1.2%。
2.1.2 药代动力学参数 将测得的血药浓度数据用药代动力学程序处理,结果表明皱叶酸膜提取物中大黄素在大鼠体内的药代过程符合二房室模型,主要药代动力学参数及统计结果见表1,其平均血药浓度-时间(药-时)曲线呈现双峰形状,见图1。

表1 大黄素在大鼠体内的主要药代动力学参数
2.2 皱液酸模提取物中大黄素在大鼠体内组织分布研究
2.2.1 分析方法验证
2.2.1.1 线性关系的考察 精密量取不同浓度的大黄素对照品溶液各20 μL,分别加入200 μL空白大鼠组织中,按组织样品的处理方法进行处理,取20 μL进样测定,以峰面积A对大黄素组织含量C进行线性
回归,结果见表2。
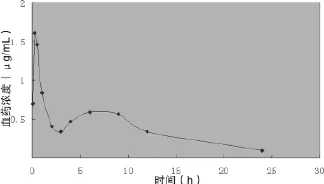
图1 大黄素平均药-时曲线
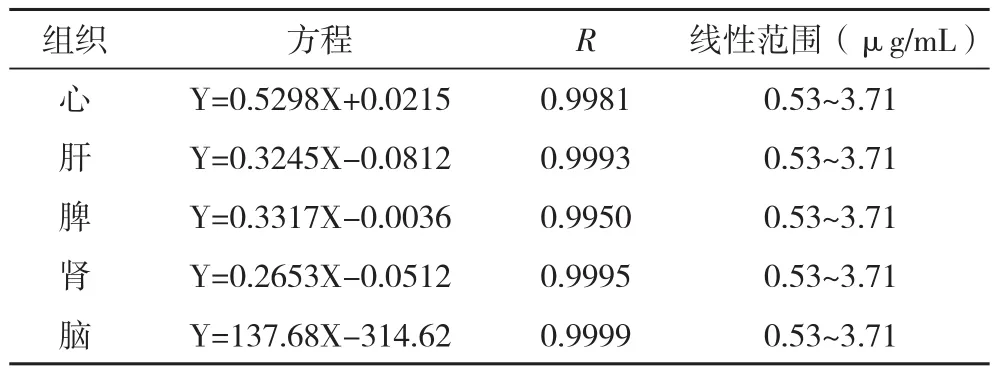
表2 各组织样品标准曲线方程
2.2.1.2 精密度与回收率试验 各组织按精密度及回收率实验方法进行试验,结果均能满足生物样品测定的要求。
2.2.2 大鼠体内各脏器组织中大黄素浓度测定 大鼠按1.0 mL/100 g灌胃皱叶酸模提取物混悬液后5、10、30、60 min,处死大鼠,取出组织,进行含量测定,发现大黄素在大鼠心、脾、肾等组织均有分布,且24 h后基本消除,各组织结果见表3。
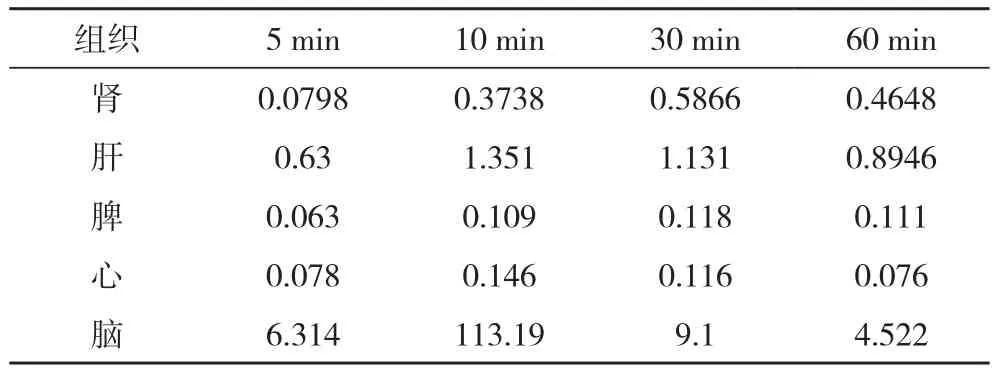
表3 大鼠灌胃大黄素各组织分布 μ g
2.3 皱叶酸模提取物中大黄素在大鼠体内的排泄特点研究
2.3.1 分析方法验证 按线性关系、精密度及回收率实验方法试验,粪便的回归方程为Y=0.107X-0.198,R=0.9997,尿液的回归方程为Y=0.176X-13.14,R=0.9996,尿液和粪便的精密度和回收率试验结果均能满足生物样品测定的要求。
2.3.2 粪便及尿液中大黄素含量测定 收集大鼠灌胃后0~2、2~4、4~6、6~8、8~10、10~12、12~24 h的粪便和尿液,测定大黄素含量,大黄素以原形形式排泄较少,见表4。
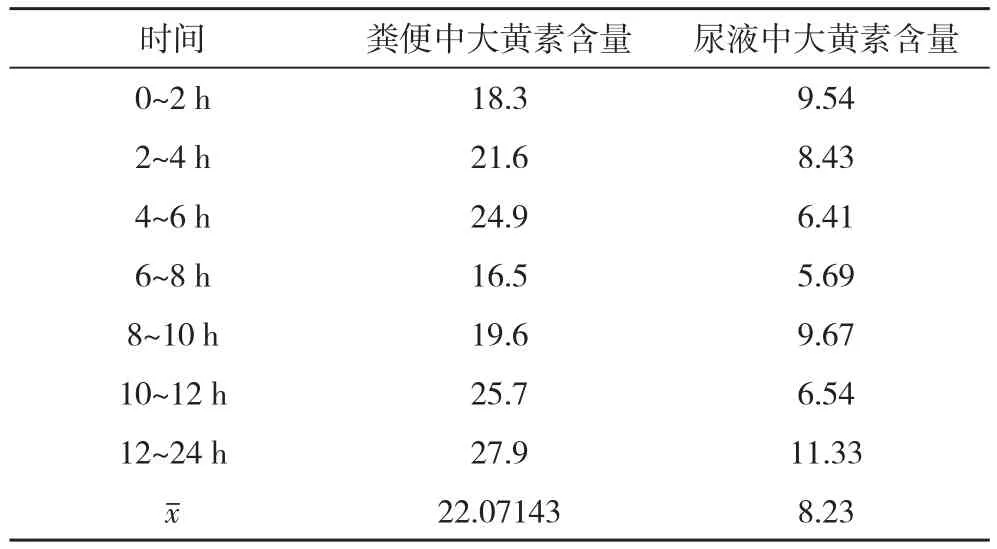
表4 大鼠粪便及尿液中大黄素含量 μ g
3 讨论
本文以研究皱叶酸膜中主要的药效成分蒽醌类化合物大黄素为着眼点,对大鼠灌胃给予皱叶酸膜提取物,研究大黄素在大鼠体内吸收、分布及排泄等特点,全面揭示了皱叶酸膜提取物在大鼠体内的吸收、分布及排泄规律。本文采用高效液相色谱法测定血液、组织及排泄物中大黄素含量,方法验证结果表明各方法线性、精密度及回收率均符合要求,且分析时间短、杂质干扰少、灵敏度高。
实验中大黄素的血药浓度—时间曲线呈现的双峰形状,与文献[10]报道的大黄素药时曲线相符,这可能是由于大黄属于通肠利便药物,灌胃后对胃肠刺激较大,吸收功能迅速下降,经一定时间的恢复之后,胃肠吸收逐渐增加,恢复正常,因此在药时曲线中出现两个峰。
大黄素可通过血脑屏障分布到大鼠脑组织中,给药后10 min大黄素在脑组织中分布已较丰富,在其他组织中,大黄素的分布由高到低依次为肝、肾、脾、心。大黄素对组织具有较高的亲和力,但24 h后,基本消除完全,不易蓄积[11]。
粪便样本中大黄素的含量远低于灌胃给予大鼠的皱叶酸膜提取物中大黄素的量,与结合蒽醌在肠道被代谢后具有泻下作用一致,同时可看到大黄素以其原形排泄较少。
[1]《新疆中草药》编委会.新疆中草药[M].乌鲁木齐:新疆人民出版社,1976:123-124.
[2]赵文彬,刘金荣,成玉怀,等.新疆皱叶酸模根中总蒽醌的含量测定[J].中国民族医药杂志,2005,11(1):29.
[3]秦冬梅,许玉华.皱叶酸模总黄酮和多糖的超声提取及含量测定[J].中国民族医药杂志,2004,10(3):34-35.
[4] Mür Demirezer L.Quantitative determination of some Rumex species with regards of anthraquinone derivatives[J].Pharmazie,1994,49(12):936-937.
[5] Choi G J,Lee S W,Jang K S,et al.Effects of chrysophanol,parietin,and nepodin of Rumex crispus on barley and cucumber powdery mildews[J].Crop Protection,2004,23(12):1215-1221.
[6] Bakan S,Daut Zdemir A,Günaydln K,et al.Analysis of anthraquinones in Rumex crispus by micellar electrokinetic
chromatography[J].Talanta,2007,71(2):747-750.
[7]徐波.HPLC法测定清热解毒颗粒中大黄素在大鼠体内的药代动力学[J].成都医学院学报,2012,7(3):402-404.
[8]冯素香,徐会平,李建生,等.大鼠血浆中芦荟大黄素浓度的固相萃取-高效液相色谱法测定及其药代动力学研究[J].中国新药杂志,2012,21(8):45-46.
[9]徐中海,刘克清,曾栋,等.甘青青兰挥发油成分超临界二氧化碳萃取与气相色谱-质谱分析[J].中医药导报,2008,14(8):12-15.
[10]卢永昌,贾丽红,宋永朋,等.HPLC测定麻花艽地上和地下部分的4种有效成分[J].华西药学杂志,2011,23(4):26-28.
[11]蒋智钢.利用《药物代谢动力学》程序计算药动学参数[J].四川畜牧兽医,2004,31(6):59-60.
Determination of Emodin in Vivo Process and Parameters of Rumex Crispus Eextract
/LI Chun-ying,ZHANG J ing,WU Yan,et al.//Medical Innovation of China,2014,11(18):039-042
Objective:To study the vivo pharmacokinetics of the major components of Rumex crispus emodin in rats, to reflect the wrinkle medicinal Ye Suanmo in laws of rats in vivo.Method:The heart, spleen, kidney chromatography of rat tissue, the content of emodin in urine and feces were detected by using high performance liquid blood.Result:Emodin blood drug concentration time curve showed a Shuangfeng shape, after intragastric administration of emodin in heart, spleen, kidney and other tissues in rats after 24 h distribution, and basic elimination, emodin in the base form excreted less.Conclusion:The Savoy acid membrane of emodin in rats in vivo absorption into theblood quickly,and rapid distribution to each organization, and few in the baseexcretion, this research has the material base and action rules help to elucidate the pharmacological effect of folic acid membrane wrinkle.
Rumex crispus extract; Emodin; Pharmacokinetics; Parameter determination
10.3969/j.issn.1674-4985.2014.18.013
2014-04-24) (本文编辑:蔡元元)
黑龙江省教育厅科学技术研究项目资助(12535006)
①大庆医学高等专科学校 黑龙江 大庆 163312
李春英
First-author’s address:Daqing Medical J unior College,Daqing 163312,China
