硅对水培大蒜生长和生理特性的影响
2014-03-13
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安271018)
硅对水培大蒜生长和生理特性的影响
刘景凯 刘世琦*连海峰 成 波 于新会
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安271018)
以金乡白皮蒜为试材,设置5个硅水平(0、0.75、1.50、2.25、3.00 mmol·L-1),探讨了硅对水培大蒜根系生长、光合特性及产量的影响。结果表明:在0~3.00 mmol·L-1硅浓度范围内,大蒜的根系生长量、植株鲜质量、蒜薹鲜质量、鳞茎鲜质量及根系活力均随硅浓度增加呈先升高后降低的趋势,当硅浓度1.50 mmol·L-1时最高;同时叶片中色素含量、净光合速率和气孔导度也随着硅浓度增加呈先升高后降低的趋势,当硅浓度1.50 mmol·L-1时最大;蒸腾速率变化趋势则恰好相反,硅浓度1.50 mmol·L-1时最低,比不施硅处理降低了17.78%。
硅;大蒜;生长;光合特性;产量
硅是地壳中最丰富的元素之一,其含量仅次于氧;虽然硅在土壤中所占的比例较高,但可供植物直接吸收利用的含量却很低(Mengel & Kirkby,1987)。作为细胞壁的组成成分之一,硅能与硅藻酸和果胶酸共价结合在一起,从而稳定其机械结构或其他多糖基结构(何念祖和孟赐福,1985);施硅能促进作物种子萌发和植株生长(马成仓 等,2002),提高作物产量和品质(Miyake & Takahashi,1986;Liang et al.,1996;邹兰香 等,2010);还能保持植物叶片呈直立状态,减少互相遮阴,增加色素含量,提高光合作用(曾宪录 等,2007),降低蒸腾作用(邹春琴 等,2005);同时对干旱(Gong et al.,2005)、病虫害(扈晓杰和朱祝军,2008)、重金属(苏秀伟,2011)、盐害(Zhu et al.,2004)等胁迫造成的伤害也有不同程度的缓解效果。当硅缺乏时,作物的生长就会受到不同程度的影响,硅作为禾本科植物、木贼属植物、甜菜等的必需营养元素,如果将其在营养液中去除会导致一种非典型胁迫(Epstein,1994);水稻叶片会出现褐斑并且下垂呈“垂柳状”,生长受阻(何念祖和孟赐福,1985;邹邦基和何雪晖,1985);此外,缺硅还会导致番茄植株高度、叶面积、地上部与根系鲜质量、干质量及单果质量的降低。
大蒜属百合科葱属一、二年生草本植物,是一种兼具营养价值和药用价值的大众蔬菜。我国是大蒜种植、加工、生产、出口的主要国家之一,大蒜出口占经济作物出口的很大一部分。由于国际市场对大蒜的质量要求非常严格,如横径大、体形完整、皮色洁白、含水量低、营养丰富均衡等(王以元 等,2005),这就给大蒜生产提出了更高的要求。硅作为一种公认的有益元素,在水稻、番茄、黄瓜等作物上的研究已经很多,但在大蒜生长发育及品质的改善方面有什么作用,至今未见相关报道。本试验通过探索水培条件下硅对大蒜生长和生理特性的影响,从而确定水培大蒜适宜的硅浓度,旨在为大蒜合理施用硅肥,提高肥料利用率,实现优质高产提供理论参考。
1 材料与方法
1.1试验设计
以大蒜(Allium sativum L. )品种金乡白皮蒜作为试材,试验于2012年10月至2013年6月在山东农业大学科技创新园进行。2012年10月17日挑选无病斑、无伤口、肥大、色泽洁白的蒜瓣在覆盖聚乙烯无滴膜的拱棚中播种,棚内温度控制在-2~25 ℃之间。采用深液流水培技术(DFT)栽培,以Hoagland营养液为基础,其他微量元素参照其通用配方。营养液用去离子水配制,每7 d更换1次,每次60 L,pH控制在6.0~6.2,采用微电脑控时器进行时间控制,每天供营养液8次,每3 h 1次,每次6 min,营养液深度为4.0 cm,营养液回流速度约为1.3 L·min-1。试验所用硅源为九水偏硅酸钠(,分子量为284.22,分析纯),共设置5个硅水平,即0、0.75、1.50、2.25 mmol·L-1和3.00 mmol·L-1,分别用Si0、Si0.75、Si1.50、 Si2.25和 Si3.00表示。各处理使用的大量元素化合物为和MgSO4·7H2O,使N、P、K、Ca、Mg和S浓度分别为15、1、6、4、2、2 mmol·L-1(本试验中钠离子含量很低,因此营养液中钠离子对大蒜生长的影响基本可以忽略不计)。大蒜栽培于65 cm×50 cm×35 cm的硬质塑料大盆,每个处理20盆,每盆12株。
1.2项目测定
于2013年3月1日取样,测定大蒜根系长度、根系鲜质量、根系数目、根系活力和色素含量;5月10日和26日分别收获大蒜蒜薹和鳞茎,并测定其产量及相关指标。每处理每次取样10株,混合均匀,3次重复。大蒜根系鲜质量以及植株(假茎和叶片)、蒜薹和鳞茎鲜质量用天平测定;根长用卷尺测定;光合参数采用CIRAS-1光合仪于3月25日9:00~10:30进行测定,自然光强1 000~1 100 μmol·m-2·s-1,气温16~18℃,叶温18~19℃,CO2浓度400 μmol·mol-1,测定部位为从上往下数第4片叶中间部位,每处理测定5株;根系活力、色素含量的测定分别采用氯化三苯基四氮唑(TTC)法(王学奎,2006)、丙酮比色法(赵世杰 等,2002)。
试验数据采用Microsoft Excel 2003软件进行处理,采用DPS 6.55软件进行统计分析和处理间显著性检验(Duncan 新复极差法)。
2 结果与分析
2.1硅对水培大蒜根系生长和根系活力的影响
根系是植物吸收水分和矿物营养的主要部位,根系生长的强弱对植物的生长发育及产量和品质的形成具有非常重要的影响。如表1所示:在0~3.0 mmol·L-1硅浓度范围内,随着硅浓度的增加,大蒜根系鲜质量、根系长度、根系数目和根系活力均呈先升高后降低的趋势,Si1.50处理的各项指标最高,与对照相比分别增加了74.35%、18.56%、17.85%和32.90%。说明适宜的硅浓度(1.50 mmol·L-1)有利于大蒜根系生长和根系活力的提高。
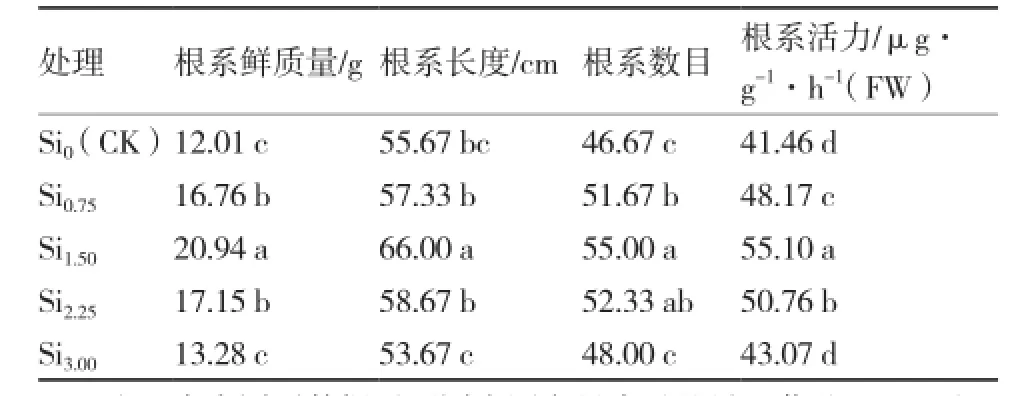
表1硅对水培大蒜根系生长和根系活力的影响
2.2硅对水培大蒜叶片色素含量的影响
由表2可以看出:在低浓度硅范围内(0~1.50 mmol·L-1),叶绿素a、叶绿素b、叶绿素(a+b)以及类胡萝卜素含量均随着硅浓度的升高而增加,在高浓度硅范围内(1.50~3.00 mmol·L-1)各色素含量则随着硅浓度的升高而降低,Si1.50处理的各色素含量最高,与不施硅处理(Si0)差异显著,分别比Si0增加了45.45%、35.29%、43.90%和31.25%。说明适宜水平的硅(1.50 mmol·L-1)有利于水培大蒜叶片内色素的合成,为提高光合效率奠定基础。
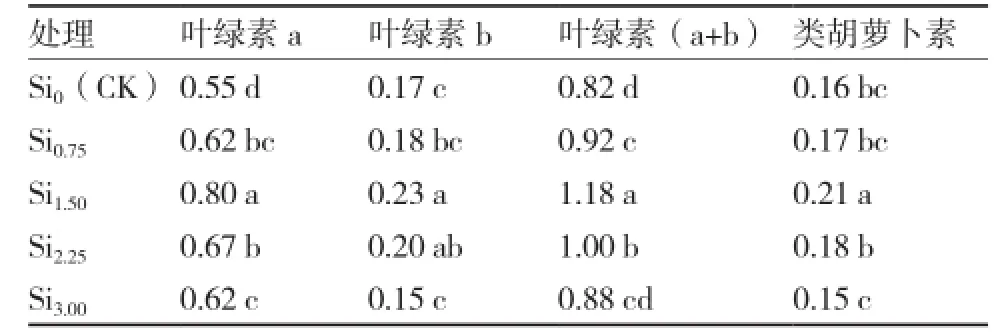
表2硅对水培大蒜叶片色素含量的影响mg·g-1(FW)
2.3硅对水培大蒜光合特性的影响
由表3可知:在0~3.00 mmol·L-1硅浓度范围内,净光合速率和气孔导度均随着硅浓度的增加先升高后降低,硅浓度1.50 mmol·L-1时最大,分别比对照(Si0)增加了39.13%和8.75%;蒸腾速率则恰好相反,随硅浓度的增加先降低后升高,硅浓度1.50 mmol·L-1时最低,与对照相比降低了17.78%,并且各施硅处理蒸腾速率均显著低于对照;胞间CO2浓度也是随硅浓度的增加呈先升高后降低的单峰曲线变化,在Si2.25处理时最大,但与Si0.75、 Si1.50、 Si3.00处理相比差异不显著。综上可见硅浓度1.50 mmol·L-1时,大蒜叶片光合性状最佳,有利于光合产物的合成、转运与积累,同时蒸腾速率最低,水分利用效率较高。
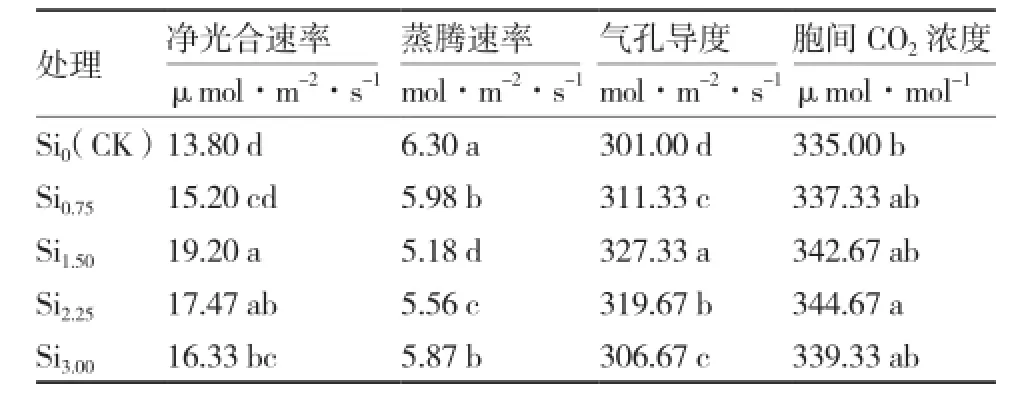
表3硅对水培大蒜叶片光合参数的影响
2.4硅对水培大蒜植株、蒜薹和鳞茎鲜质量的影响
由表4可知,硅对水培大蒜生物量有显著的影响。低浓度硅(0~1.50 mmol·L-1)范围内大蒜生物量随营养液中硅浓度的升高而增加,高浓度硅(1.50~3.00 mmol·L-1)范围内则随硅浓度的增加而降低。硅浓度1.50 mmol·L-1时大蒜单株鲜质量、单薹鲜质量、单头鳞茎鲜质量最大,与不施硅处理(Si0)相比分别增加了51.74%、53.62%和44.85%,并且各施硅处理的单株鲜质量、单薹鲜质量、单头鳞茎鲜质量均显著高于不施硅处理。可见营养液中添加硅有利于水培大蒜植株、蒜薹和鳞茎的生长,并且1.50 mmol·L-1效果较好。
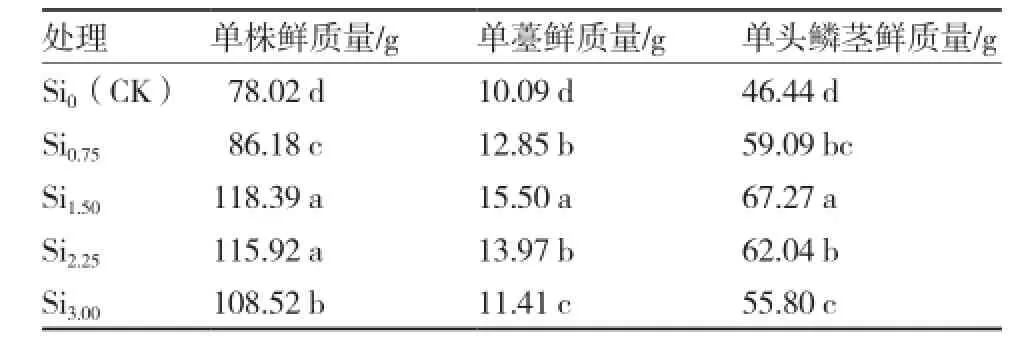
表4硅对水培大蒜植株、蒜薹和鳞茎鲜质量的影响
3 结论与讨论
根系不仅是植物吸收水分和营养物质的主要器官,而且一些复杂生物化学过程,如合成某些植物激素和生物碱,还原大量和等也在根细胞内进行(刘春生,2006)。瞿廷广等(2003)在水稻,邵长泉(2007)在糯玉米上的研究均表明:施硅能显著地增加根系数目、根系体积和根系质量,促进根系呼吸,提高根系活力,增加总根系吸收面积和活跃吸收面积,从而有利于植物吸收更多的水分和矿物营养,提高植物的生产能力。本试验中,大蒜根系鲜质量、根系长度、根系数目以及根系活力都随硅浓度的增加呈先升高后降低的趋势,在硅浓度1.50 mmol·L-1时最高,说明适宜水平的硅能够促进大蒜根系生长和根系活力的提高。这与刘慧霞等(2009)在紫花苜蓿,马雪泷和房江育(2004)在马铃薯试管苗上的研究结果相似。
叶绿素是植物进行光合作用的基础物质,光合作用是植物生长发育物质和能量的来源。硅能改善作物个体和群体条件,增大受光面积;使作物细胞表面形成角质双硅层,避免叶片在强光下过度失水萎蔫,提高光合效率(邹邦基和何雪晖,1985)。供硅能使作物叶片增厚,维管束增粗,叶绿体较大,基粒片层及叶绿素含量增多(饶丽华 等,1986;曹逼力 等,2012),还能增强叶绿体的偶联因子Mg2+-ATPase和Ca2+-ATPase活性,促进光合磷酸化,提高净光合速率(张国芹 等,2008)。周秀杰等(2009)认为硅能增加黄瓜叶片表皮层、栅栏组织的厚度及叶片组织疏松度,降低叶片比表面积,从而减少水分蒸腾,提高叶片含水量。与前人的研究结果相似,本试验中,叶绿素、类胡萝卜素含量、净光合速率以及气孔导度均随硅浓度增加先升高后降低,1.50 mmol·L-1时最高;蒸腾速率则随硅浓度增加先降低后升高,硅浓度1.50 mmol·L-1时最低。但也有学者认为随土壤有效硅含量的增加,棉花(李清芳和马成仓,2003)幼苗叶片以及姜(张国芹 等,2008)叶片中叶绿素含量没有显著变化。由此可见硅对作物叶片内叶绿素含量的影响因植物种类不同而存在差异。同时本试验中,胞间CO2浓度虽然也随硅浓度增加呈先升后降的单峰曲线变化,硅浓度2.25 mmol·L-1时最高 ,但与其他施硅处理相比差异并不显著,因此认为改善胞间CO2浓度并不是硅增强大蒜光合作用,提高净光合速率的主要途径,具体原因及机制还有待进一步试验。
大蒜叶片光合速率的高低直接影响着产品器官(青蒜、蒜薹和鳞茎)的产量和品质,光合速率高,有机物合成与累积量多,则有利于产品器官的形成。研究表明:供硅能使花生植株生长健壮,果仁充实饱满,百果重和百仁重提高,增产幅度达20%(李尚霞 等,2012);水稻基施硅肥225 kg·hm-2时,穗数、每穗粒数和千粒重的增加效应最明显,产量最高(张国良 等,2007)。本试验中,施硅也显著增加了大蒜植株、蒜薹和鳞茎的鲜质量,并且营养液中硅浓度为1.50 mmol·L-1时最大,分别比不施硅处理增加了51.74%、53.62%和44.85%。
水培条件下,适宜水平的硅能提高大蒜叶片内色素含量,改善其光合状况,从而为大蒜生长、生物量的增加和产量提高奠定了基础,并且营养液中硅浓度1.50 mmol·L-1时效果最好。
曹逼力,徐坤,石健,辛国风,刘灿玉,李秀.2012.硅对番茄生长及光合作用与蒸腾作用的影响.植物营养与肥料学报,19(2):354-360.
何念祖,孟赐福.1985.植物营养原理.上海:上海科学技术出版社:315-317.
扈晓杰,朱祝军.2008.硅对黄瓜白粉病抗性及叶片质外体抗氧化酶活性的影响.浙江农业学报,20(1):67-71.
李清芳,马成仓.2003.土壤有效硅对棉花幼苗营养代谢的影响.中国农业科学,36(6):726-730.
李尚霞,杨吉顺,张智猛,吴菊香.2012.硅肥对花生生理特性和产量的影响.花生学报,41(3):37-40.
刘春生.2006.土壤肥料学.北京:中国农业大学出版社:148.
刘慧霞,郭正刚,周雪荣,周雪荣,郭兴华,邹文辉,王爱国.2009.硅对紫花苜蓿根系生长的影响.中国草地学报,31(1): 28-31.
马成仓,李清芳,束良佐,张经余.2002.硅对玉米种子萌发和幼苗生长作用机制初探.作物学报,28(5):665-669.
马雪泷,房江育.2004.硅对马铃薯试管苗根系生长及其细胞壁组成的影响.黄山学院学报,6(6):85-86.
瞿廷广,施正连,丁江妹.2003.硅肥对直播水稻的抗逆性和产量的影响.土壤肥料,(5):26-28.
饶立华,覃莲祥,朱玉贤.1986.硅对杂交稻形态结构和生理的效应.植物生理学通讯,(3):20-24.
邵长泉.2007.硅肥对糯玉米根系生长状况、产量及品质的影响.长江蔬菜,(5):50-51.
苏秀伟.2011.硅缓解苹果植株高锰毒害的研究〔硕士论文〕.泰安:山东农业大学.
王学奎.2006.植物生理生化实验原理和技术.2版.北京:高等教育出版社.
王以元,刘赐全,陈爱红.2005.大蒜出口质量标准及达标技术的研究简报.当代生态农业,14(1):57-58.
曾宪录,梁计南,谭中文.2007.硅肥对甘蔗叶片一些光合特性的影响.华中农业大学学报,26(3):330-334.
张国良,戴其根,王建武,张洪程,霍中洋,凌励,王显,张军.2007.施硅量对粳稻品种武育粳3号产量和品质的影响.中国水稻科学,21(3):299-303.
张国芹,徐坤,王兴翠,张晓艳,董灿兴.2008.硅对生姜叶片水,二氧化碳交换特性的影响.应用生态学报,19(8):1702-1707.
赵世杰,史国安,董新纯.2002.植物生理学实验指导.北京:中国农业科学技术出版社.
周秀杰,赵红波,马成仓,李清芳.2009.外源硅对黄瓜叶片组织结构和保水能力的影响.生态学杂志,28(3):556-559.
邹邦基,何雪晖.1985.植物的营养.北京:农业出版社:277.
邹春琴,高霄鹏,刘颖杰,王荔军,张福锁.2005.硅对向日葵水分利用效率的影响.植物营养与肥料学报,11(4):547-550.
邹兰香,张中华,曹忠杰,游宝杰.2010.有机硅肥对生姜生长及产量的影响.中国果菜,(4):30-31.
Epstein E.1994.The anomaly of silicon in plant biology.Proceedings of the National Academy of Sciences,91(1):11-17.
Gong H J,Zhu X Y,Chen K M,Wang S M,Zhang C L.2005.Silicon alleviates oxidative damage of wheat plants in pots under drought.Plant Science,169(2):313-321.
Liang Y C,Shen Q R,Shen Z G,Ma T S.1996.Effects of silicon on salinity tolerance of two barley cultivars.Journal of Plant Nutrition,19(1):173-183.
Mengel K,Kirkby E A.1987.植物营养原理.张译春,刘同仇,谢振翅,刘武定,译.北京:农业出版社.
Miyake Y,Takahashi E.1986.Effect of silicon on the growth and fruit production of strawberry plants in a solution culture.Soil Science and Plant Nutrition,32(2):321-326.
Zhu Z J,Wei G Q,Li J,Qian Q Q,Yu J Q.2004.Silicon alleviates salt stress and increases antioxidant enzymes activity in leaves of saltstressed cucumber.Plant Science,167(3):527-533.
Abstract:‘Jinxiangbaipisuan’ was taken as experiment material investigate the effects of silicon on root growth,photosynthetic characteristics and yield of hydroponics cultured garlic(Allium sativum L.). Five different silicon levels (0,0.75,1.50,2.25,3.00 mmol·L-1) were designed. The results showed that the root system growth,fresh weights of garlic plant,bolt and bulb,and root system activity all rose with the increase of silicon concentration from 0 to 1.50 mmol·L-1,but fell while the silicon content reached 1.50 mmol·L-1. At the same time,the pigment content,net photosynthetic rate and stomatal conductance of leaves also increased first and then decreased with the increase of silicon content from 0 to 3.00 mmol·L-1.They reached the highest when silicon concentration was 1.50 mmol·L-1. While the change trend of transpiration was just the opposite. It reached the minimum value at Si 1.50 mmol·L-1and was reduced by 17.78% compared with the treatment without silicon.
Effects of Silicon in Nutrient Solution on Garlic Growth and Its Physiological Characteristics
LIU Jing-kai,LIU Shi-qi*,LIAN Hai-feng,CHENG Bo,YU Xin-hui
(College of Horticulture Science and Engineering,Shandong Agricultural University,State Key Laboratory of Crop Biology,Key Laboratory of Biology and Genetic Improvement of Horticultural Crops (Huang-huai Region),Ministry of Agriculture,Tai’an 271018,Shandong,China)
Silicon; Garlic; Growth; Photosynthetic; Yield
刘景凯,男,硕士研究生,专业方向:蔬菜栽培生理,E-mail: liujksdau@126.com
*通讯作者(Corresponding author):刘世琦,教授,博士生导师,专业方向:蔬菜栽培生理,E-mail:liusq99@sdau.edu.cn
2013-11-27; 接受日期:2014-01-03
国家公益性行业科研专项(200903018),山东省农业重大创新项目
