苝酐-纳米金修饰电极同时检测抗坏血酸、多巴胺和尿酸的研究
2014-03-11归国风孙小媛
归国风,宋 鹏,孙小媛
(贵州工程应用技术学院化学工程学院,贵州毕节551700)
0 引言
生物活性小分子物质在哺乳动物及人类体内发挥着重要的作用。不同的活性小分子物质在细胞信号转导、基因表达调控和生物学效应上形成复杂的调节网络,承担着调节机体稳态的重要使命。目前,在电化学领域研究比较多的生物活性小分子物质主要有H2O2[1],多巴胺(DA)[2],抗坏血酸(AA)[3],尿酸(UA)[4]等。其中DA 是一种重要的神经递质[5],UA 是人体最基础的代谢产物[6],AA 是维持人体健康必需的维生素[7],三者作为生物活性小分子同时存在于体液当中,其含量对于人体的健康有着极大的影响。在实际样品的检测中,DA,AA 和UA 三种物质在裸电极上的出峰位置比较接近,很难分离,相互干扰严重[8]。因此,实现多组分DA,AA 和UA 的同时检测具有重要的意义。
纳米材料具有比表面积大、表面活性中心多、催化效率高、吸附能力强、表面活性高等特点,被广泛应用于生物传感器的研究。金纳米颗粒就是纳米材料中的一员,具有良好的催化特性,吸附特性,光学特性,热学特性等[9]。该文利用具有多孔结构的3,4,9,10-苝四甲酸二酐(PTCDA)为骨架,固载纳米金制备得到具有高催化活性的PTC-GNPs 纳米复合物,用于修饰玻碳电极。用循环伏安法(CV)和脉冲伏安法(DPV)研究了该修饰电极对多巴胺、尿酸、抗坏血酸的电化学行为。
1 实验部分
1.1 试验仪器与试剂
CHI 660C 电化学工作站 (上海辰华仪器公司);AB204-S 电子天平 (瑞士Mettler&Toledo 公司);BRANSONIC200超声清洗仪(德国BRANSON ULTRASCHALL 公司);3,4,9,10-苝四甲酸二酐(PTCDA,98%)购于辽宁连港燃料化学工业品公司。氯金酸(HAuCl4) 购于Sigma 化学公司(St.Louis,MO,USA);多巴胺、抗坏血酸及尿酸购于北京化工厂。磷酸盐缓冲溶液 (PBS)由K2HPO4-KH2PO4配制,支持电解质为0.1 mol/L KCl。其他试剂均为分析纯试剂,实验用水为二次蒸馏水。实验中采用三电极系统:修饰玻碳电极为工作电极( φ=4 mm),饱和甘汞电极为参比电极,铂丝电极为对电极;JBZ-14型磁力搅拌器(上海康仪仪器有限公司)。实验中所用水为蒸馏水。所有的化学药品为分析纯且使用时无需进一步纯化。
1.2 PTCGNPs 复合物的制备
1.0 g PTCDA 溶解在10 mL 0.5 mol/L NaOH中,然后逐滴加入1.0 mol/L 的HCl 至沉淀完全,随后离心分离,并用大量的蒸馏水洗涤除去过量的试剂,得到处理后的苝四甲酸(PTCA);最后将所得PTCA 再次分散于蒸馏水中制得悬浊液备用。
取5 mL 上述PTCA 悬浊液超声分散5 min,然后加入0.5 mL HAuCl4(ω=1.0%),在室温下强力搅拌10 min 使其充分混合。后在不断搅拌下于混合液中逐滴加入1.25 mL 0.1 mol/L 抗坏血酸溶液作为HAuCl4的还原剂来制备纳米金(GNPs)。继续搅拌2 h 之后,纳米金原位还原在PTCA 表面制得纳米金修饰的PTCA 复合材料 (PTCAGNPs)。将该复合材料离心洗涤后分散于蒸馏水中,储存于4℃下备用。
1.3 传感器的制备
首先,裸的玻碳电极 (GCE) 分别用0.3 和0.05 μm 的氧化铝粉末抛光后,再依次用蒸馏水、乙醇、蒸馏水中超声洗涤,清洗后的电极置于室温下晾干备用。取10 mL 制备好的PTC-GNPs溶液滴于电极表面,在室温下晾干后就制得目标传感器(PTC-GNPs/GCE)。
2 结果与讨论
2.1 不同的修饰电极的电化学行为
为了展示修饰的电极可以同时检测这三种物质。裸电极与PTC-GNPs/GCE 目标电极分别被用来在0.1 mol/L PBS(pH5.0) 含有AA(1.6 mol/L),DA(0.2 mol/L) 和UA(0.4 mol/L) 的溶液中进行循环伏安响应。由图1可以看出,工作电极为裸的玻碳电极时,只有两个弱且宽的氧化峰在300 mV 和420 mV 出现(曲线a),其中DA 和UA 的氧化峰重叠在一起,没能分开,这表明裸的玻碳电极不能对这三种物质进行同时检测。而在同样的条件下,用PTC-GNPs/GCE 目标电极作为工作电极进行循环伏安表征时,分别在100,250 和410 mV 处出现三个明显的氧化峰(曲线b),说明三种物质的氧化峰的出峰位置能够很好的分离开来。实验结果表明,目标电极能够实现AA、DA和UA 三种物质的同时检测。
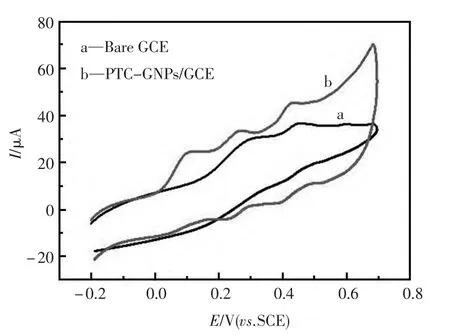
图1 裸电极(a)和PTC-GNPs 修饰电极(b)Fig.1 Cyclic voltammetry of bare electrode(a)and PTCGNPs modified electrode(b)in 0.1 mol/L PBS buffer solution(pH=5.0)containing 1.6 mol/L AA,0.2 mol/L DA and 0.4 mol/L UA.Scan rate:100 mV/s
2.2 pH 的影响
由于质子参与AA、DA 和UA 的电极反应过程,测试溶液的pH 会影响修饰电极对目标物的信号响应。为了能够使AA、DA 和UA 这三种物质在进行检测时的信号响应能更好的分离开,该文研究了pH 对PTC-GNPs/GCE 影响。根据图2可知,在没有目标物的空白PBS 缓冲溶液中测试,没有出现任何氧化还原峰(曲线a)。加入目标物AA、DA 和UA,在pH为3、4、5时,均出现了3个信号峰,其中在pH=5时,电流信号较大,且3个峰的出峰电位能够明显的分开;但pH 增大到6 和7时,只有1个氧化峰比较大,其他的2个都很弱。故在后面的实验中选择用pH = 5.0 PBS(0.1 mol/L) 的缓冲溶液作为测试液。
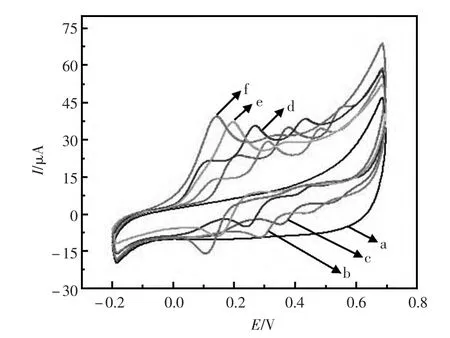
图2 pH 对PTC-GNPs 修饰电极的影响Fig.2 Effect of pH on PTC-GNPs modified electrode.Test solution:(a)pH=5,0.1 mol/L PBS;(b~f)the pH values were 3,4,5,6 and 7,0.1 mol/L PBS containing 1.6 mol/L AA,0.2 mol/L DA and 0.4 mol/L UA.Scan rate:100 mV/s
2.3 循环伏安法同时测定AA、DA 和UA
循环伏安法(CV)一种常用的电化学研究方法。可用于电极反应的性质、机理和电极过程动力学参数的研究。为了研究修饰电极对不同浓度AA、DA 和UA 的电流响应情况,该文课题组用循环伏安法测试了在含不同浓度AA、DA 和UA的测试液中修饰电极的响应特性。如图3所示,修饰的电极可以将AA、DA 和UA 明显分开,且随着各组分浓度的增加,其相对应的峰电流也呈现一种增加的趋势。实验结果说明PTC-GNPs/GCE 对AA、DA 和UA 能够起到很好的分离检测效果。
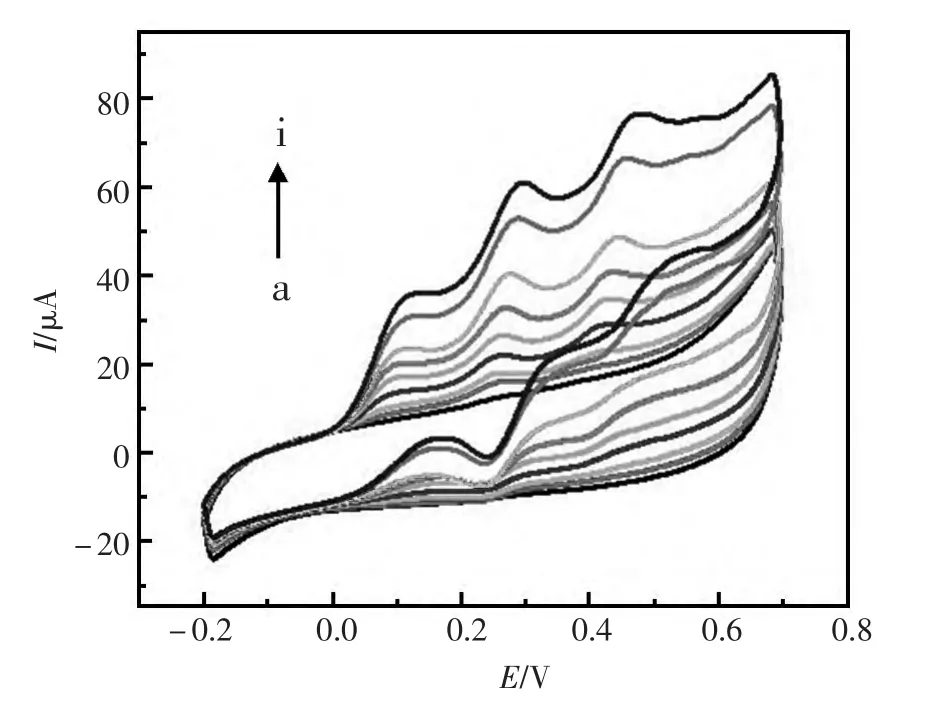
图3 PTC-GNPs 修饰电极在不同浓度的AA、DA 和UA 的循环伏安检测Fig.3 CV of PTC-GNPs modified electrode.(a):0.04 mol/L AA、0.002 mol/L DA and 0.002 mol/L UA,(b):0.09 mol/L AA、0.012 mol/L DA and 0.012 mol/L UA,(c):0.14 mol/L AA、0.032 mol/L DA and 0.062 mol/L UA,(d):0.24 mol/L AA、0.052 mol/L DA and 0.162 mol/L UA,(e):0.34 mol/L AA、0.102 mol/L DA and 0.262 mol/L UA,(f):0.44 mol/L AA、0.202 mol/L DA and 0.362 mol/L UA,(g):0.54 mol/L AA、0.402 mol/L DA and 0.462 mol /L UA,(h):0.74 mol/L AA、0.602 mol/L DA and 0.662 mol/L UA,(i):0.94 mol/L AA、0.802 mol/L DA and 0.862 mol/L UA。Text solution:0.1 mol/L PBS(pH=5).Scan rate:100 mV/s
2.4 微分脉冲伏安法(DPV) 同时测定AA、DA和UA
微分脉冲伏安法(DPV) 是一个更敏感的技术,已被广泛用于电化学检测。如图4所示,DPV是记录阳极峰电极电流来验证同时测定AA,DA和UA 可行性的传感器。如图4A所示,在不同浓度的AA 在DA 和UA 下测试了修饰电极的DPV信号,随着不同浓度的AA、DA 和UA 分别加入,三个阳极峰电流随着加入的AA、DA 和UA 的浓度的增加而增加,且峰值电流与AA、DA 和UA的浓度成线性关系。图4B显示的峰电流对AA的浓度成线性,回归方程表示为IAA= 14.09 +23.98 cAA(mol/L),相关系数r = 0.996。同样,DA(图4C) 和UA(图4D)的线性回归方程分别为:IDA=18.20+23.82 cDA(mol/L)、IDA=32.52+74.14 cDA(mol/L) 和IUA= 19.18 + 91.06 cUA(mol/L)、IUA=27.36+40.24 cUA(mol/L),相关系数分别为0.996、0.998 和0.999、0.998。
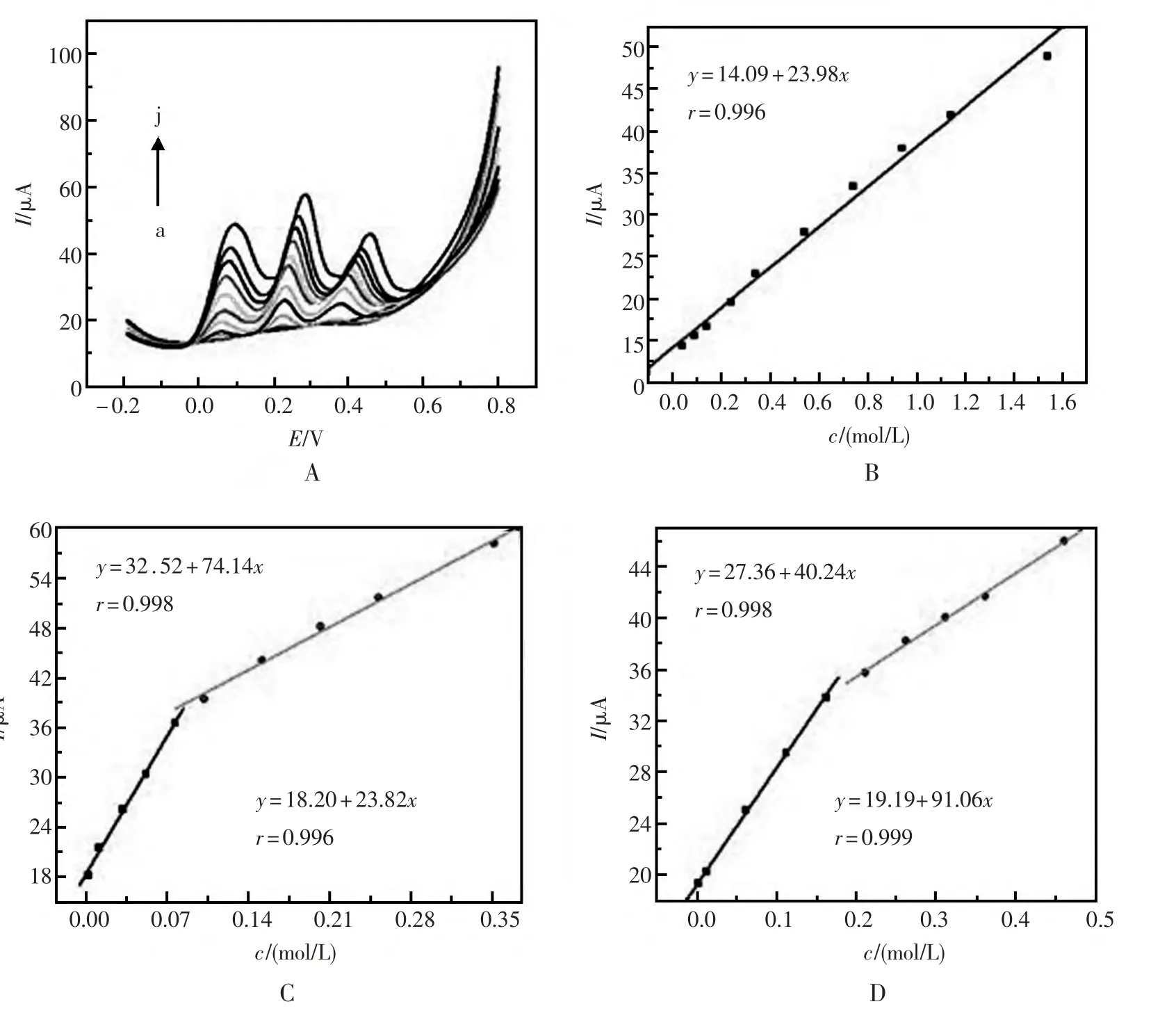
图4 修饰电极在不同浓度的AA、DA 和UA 的PBS溶液中DPV 响应曲线Fig.4 The differential pulse voltammetric response of modified electrode towards different concentration of AA、DA and UA and the correlation coefficient of AA(B),DA(C)and UA(D).(a):0.04 mol/L AA、0.002 mol/L DA and 0.002 mol/L UA,(b):0.09 mol/L AA、0.012 mol/L DA and 0.012 mol/L UA,(c):0.14 mol/L AA、0.032 mol/L DA and 0.062 mol/L UA,(d):0.24 mol/L AA、0.052 mol/L DA and 0.112 mol/L UA,(e):0.34 mol/L AA、0.077 mol/L DA and 0.162 mol/L UA,(f):0.54 mol/L AA、0.102 mol/L DA and 0.212 mol/L UA,(g):0.74 mol/L AA、0.152 mol/L DA and 0.262 mol/L UA,(h):0.94 mol/L AA、0.202 mol/L DA and 0.312 mol/L UA,(i):1.14 mol/L AA、0.252 mol/L DA and 0.362 mol/L UA,(j):1.54 mol/L AA、0.352 mol/L DA and 0.462 mol/L UA。Text solution:0.1 mol/L PBS(pH=5).Scan rate:100 mV/s
3 结论
该实验利用苝四甲酸二酐独特的多孔结构作为纳米金的载体,再结合纳米金优良的催化性能,制备了固载有大量纳米金的修饰电极,用于AA、DA 和UA 的三组分的电化学检测。苝酐-纳米金复合物电极可以提高电荷转移速率并可以在PTCA 表面产生附加的催化活性位点,能够很好的分离并识别AA、DA 和UA 的三组分。并且该方法制备简单,具有较高的灵敏度和特异性,在临床医学检测上具有一定的意义。
[1]Senel M,Cevik E,Abasıyanık M F.A novel amperometric hydrogen peroxide biosensor based on catalase immobilization on poly (glycidyl methacrylate-co-binylferrocene)[J].Anal.Bioanal.Electrochem.,2011,3:14 ~25.
[2]Wang H W,Ren F F,Yue R R.Macroporous flower-like graphene-nanosheet clusters used for electrochemical determination of dopamine[J].Colloid Surf.A-Physicochem.Eng.Asp,2014,448:181~185.
[3]Pakapongpan S,Mensing J P,Phokharatkul D.Highly selective electrochemical sensor for ascorbic acid based on a novel hybrid graphene-copper phthalocyaninepolyaniline nanocomposites[J].Electrochim.Acta,2014,133:294~301.
[4]Wei Y,Li M,Jiao S,et al.Fabrication of CeO2nanoparticles modified glassy carbon electrode and its application for electrochemical determination of UA and AA simultaneously[J].Electrochim.Acta,2006,52:766~772.
[5]Dursun Z,Gelmez B.Simultaneous determination ofascorbic acid,dopamine and uric acid at Pt nanoparticles decorated multiwall carbon nanotubes modified GCE[J].Electroanal.,2010,22(10):1 106~1 114.
[6]Li N B,Ren W,Luo H Q.Caffeic acid-modified glassy carbon electrode for the simultaneous determination of epinephrine and dopamine [J].Electroanal.,2007,19(14):1 496~1 502.
[7]Kaur H,Halliwell B.Action of biologically-relevant oxidizing species upon uric acid.Identification of uric acid oxidation products[J].Chemico-biological interactions,1990,73(2/3):235~247.
[8]Falat L,Cheng H.Voltammetric differentiation of ascorbic acid and dopamine at an electrochemically treated graphite/epoxy electrode[J].Anal.Chem.,1982,54:2 108~2 111.
[9]杨鼎宜,孙伟.纳米材料的结构特征与特殊性能[J].材料导报,2003,17(10):7~9.
