维生素D受体基因多态性与慢性乙型肝炎患者的关联研究*
2014-03-11刘蒙赵龙凤
刘蒙赵龙凤
维生素D受体基因多态性与慢性乙型肝炎患者的关联研究*
刘蒙①赵龙凤①
目的:探讨维生素D受体(VDR)FokⅠ基因多态性与慢性乙型肝炎患者临床表型的关联。方法:应用聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)技术检测VDR FokⅠ基因的多态性在44例慢性乙型肝炎重度患者、46例中度患者和40例非活动性HBsAg携带者中的分布,并进行基因型分析。结果:慢性乙型肝炎重度组、慢性乙型肝炎中度组VDR FokⅠ基因的基因型与对照组(非活动性HBsAg携带者)比较差异有统计学意义(P<0.01);慢性乙型肝炎重度组、中度组与对照组VDR FokⅠ基因酶切位点的等位基因F/f分布存差异有统计学意义(P<0.01)。Pearson列联系数=0.53,提示等位基因F/f分布与慢性乙型肝炎患者的不同临床表型存在相关性。慢性乙型肝炎重度组、中度组f等位基因分布频率高于对照组。结论:VDR FokⅠ基因的多态性与慢性乙型肝炎患者的不同临床表型存在一定的关系。
慢性乙型肝炎; 维生素D受体; 基因多态性; 免疫调节
慢性乙型肝炎(CHB)是以肝细胞损伤和肝组织炎性反应为主的疾病,乙型肝炎病毒(HBV)引起的肝损伤及转归与机体的细胞免疫密切相关,主要以T淋巴细胞清除病毒和肝细胞的损伤为主[1]。1,25-二羟维生素D3[1,25(OH)2D3]是维生素D3的活性形式[2]。随着研究的深入,人们认识到它除了调节钙磷代谢外,还具有介导免疫反应作用,而这些功能的实现主要是由维生素D受体( vitamin D receptor, VDR)来介导的[3]。本研究采用聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)的方法,初步探讨VDR基因多态性与慢性乙型肝炎患者不同临床表型的关系。
1 资料与方法
1.1 一般资料 选取2013年5月-11月本院感染科住院的慢性乙型肝炎现症患者90例,其中重度患者44例,男26例,女18例,平均年龄(37.4±12.5)岁;中度患者46例,男29例,女17例,平均年龄(35.4±10.5)岁。对照组选择同期本院感染科住院和门诊的非活动性HBsAg携带者40例,其中男27例,女13例,平均年龄(32.5±9.2)岁,全部患者均为生活在本地区的汉族人群,无血缘关系。诊断标准参照“慢性乙型肝炎防治指南2010年更新版”,所有患者在3个月内未使用免疫调节剂和抗病毒药物,并排除合并其他病毒性肝炎、自身免疫性肝炎、肝硬化及肝癌等。全部患者均自愿参加本次研究。三组研究对象一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 实验室检查 肝功能相关指标,包括AST/ALT、血清总胆红素TBIL、凝血酶原活动度PTA、血清白蛋白;检测HBsAg、anti-HBs、HBeAg、anti-HBe和anti-HBc及HBVDNA滴度。
1.2.2 基因组DNA的提取 留取慢性乙型肝炎中度及重度患者和非活动性HBsAg携带者空腹12 h后,晨起静脉采血4 mL(EDTA抗凝),采用硅胶柱纯化方式,用血液DNA提取试剂盒(D3741-01 美国OMEGA),从700 μL抗凝血液中提取淋巴细胞基因组DNA。利用UV计测定所提取的DNA浓度及纯度,并将其稀释至10 ng/μL,分装保存于-20 ℃冰箱保存备用。
1.2.3 聚合酶链反应-限制性片段长度多态性分析(PCRRFLP) VDR FokⅠ基因的引物序列:上游引物,5,-AGCTGGCCCTGGCACTGACTCTGCTCT-3;下游引物,5,-ATGGAAACACCTTGCTTCTTCTCCCTC-3。总反应体系均为25 μL:1 μL基因组DNA,2.5 μL 10×PCR 缓冲液,上下游引物各0.5 μL,dNTPs 2 μL,0.25 μL Taq DNA 聚合酶,去离子水18.25 μL。VDR FokⅠPCR扩增条件:95 ℃预变性4 min;98 ℃变性10 s,63 ℃退火30 s,72 ℃延伸60 s,共30个循环;72 ℃再延伸5 min。取扩增的PCR产物0.5 μL,1 μL限制性内切酶FokⅠ,及2 μL 10×M Buffer, 2 μL 0.1% BSA(由大连TaKaRa公司提供)及14.5 μL灭菌水组成酶切总反应体系20 μL,置于37 ℃水浴1 h,进行FokⅠ酶切,将酶切产物经2%琼脂糖凝胶电泳,以DL700 Marker为参考,紫外凝胶成像仪下观察结果。
1.3 观察指标 比较慢性乙型肝炎现症患者重度组、中度组和对照组VDR基因多态性的差异;VDR FokⅠ基因多态性与慢性乙型肝炎不同病情程度的关联程度。
1.4 统计学处理 分别统计CHB现症患者重度组、CHB现症患者中度组和对照组非活动性HBsAg携带者基因型和等位基因的分布频率数据,用SPSS 13.0统计软件分析,Hardy-Weinberg遗传平衡检验,P>0.05认为资料可靠,代表性好。计数资料采用 χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 扩增产物酶切结果电泳图谱 VDR FokⅠ酶切后出现3种结果:纯合子FF为270 bp,1条带;杂合子Ff为270 bp、195 bp,2条带;纯合子ff为195 bp,1条带,见图1。
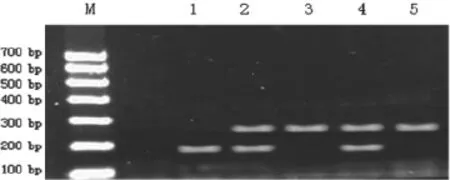
图1 扩增产物酶切结果电泳图谱
2.2 VDR FokⅠ基因的基因型和等位基因频率分布 经Hardy-Weinberg遗传平衡检验后,结果显示符合Hardy-Weinberg平衡,说明资料可靠,代表性好。CHB重度组、中度组VDR FokⅠ基因的基因型与对照组比较差异有统计学意义(χ2=34.816,P<0.01)。见表1。CHB重度组、中度组患者与对照组VDR FokⅠ基因酶切位点的等位基因F/f分布差异有统计学意义(χ2=50.674,P<0.01),Pearson列联系数=0.53,提示等位基因F/f分布与慢性乙型肝炎患者的不同临床表型存在相关性。CHB重度组、中度组f等位基因分布频率高于对照组,见表1。
3 讨论
VDR基因定位于12号染色体长臂,其包含有11个外显子,在基因组上总长为75 Kb,VDR包含427个氨基酸残基,分子量为50 KD[4]。目前报导的VDR基因多态性与4个单核苷酸多态性位点有关,分别为2号外显子的FokⅠ位点、第8内含子的BsmⅠ位点、ApaⅠ位点及第9外显子的TapⅠ位点。近年来,人们逐渐认识到VDR的基因多态性除了参与调节钙磷代谢外,其有着更广泛的生理作用,如:抗增殖、抗分化、调节细胞凋亡、介导免疫反应及多种内分泌腺激素的分泌,调节造血组织造血等作用[5-6]。
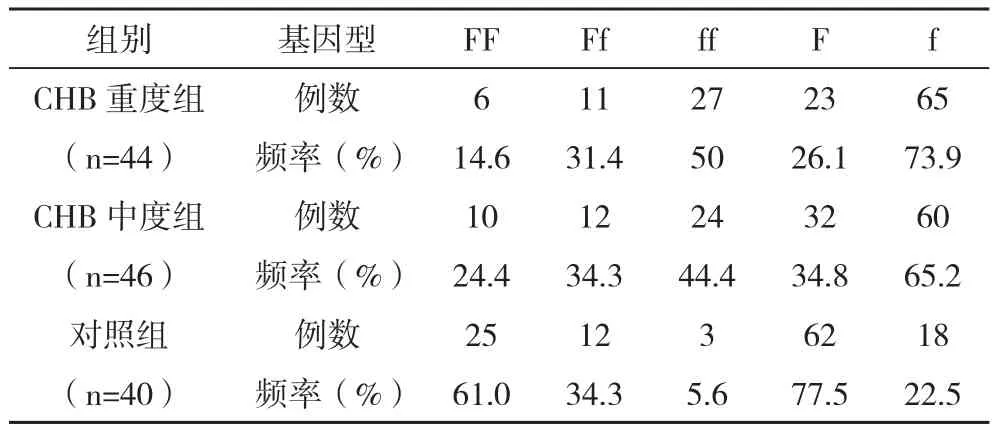
表1 CHB患者VDR基因的FokI酶切位点多态性及其等位基因分布频率的分析
研究证明,Treg细胞和Th17细胞这两种细胞亚型参与了免疫介导性肝炎的发病机制。Treg细胞为体内致免疫耐受的主要细胞,其有效控制病原体的T细胞反应,而Th17细胞主要通过产生细胞因子,如IL-17可促进炎症反应,这两种细胞亚型在特定的某些细胞因子等因素的作用下,可相互转换,相互制约[7-9]。Sneha等[10]研究发现1,25-(OH)2D3可以通过阻碍IL-17转录因子活化T细胞核因子(NF-AT)复合体的形成,从而抑制IL-17的分泌,进而减轻Th17细胞介导的促炎症反应。另有研究表明,1,25-(OH)2D3及其类似物通过作用于树突状细胞的nVDR,抑制了树突状细胞的成熟,使其处于未成熟状态,因此其不能激活初始T细胞,进而使免疫反应不能继续[11-12]。目前认为,不成熟树突状细胞可分泌TGF-b和/或IL-10来诱导初始T细胞向Treg细胞转化,增加Treg细胞的水平,提高了机体的免疫耐受性[13-14]。
本实验结果显示,CHB重度组、中度组患者的f等位基因分布频率高于对照组,提示等位基因f分布频率的提高可能与CHB的炎症再活动存在一定的关系。有研究表明,VDR基因FokⅠ多态性的C-T替换(F等位基因-f等位基因),造成潜在的起始位点,f等位基因编码的VDR增加了3个氨基酸,f等位基因的转录效率比F等位基因降低了1.7倍,故ff基因型的个体,其VDR表达量较低,可能导致使ff基因型结合1,25-(OH)2D3的能力降低,进而使其介导的免疫耐受反应减弱,从而使慢乙肝患者所受的炎症反应和免疫反应的伤害从一定程度上有所增强[15-16]。由此推测,等位基因f分布频率的提高可能会促进慢性乙型肝炎患者炎症的再活动。
VDR的基因多态性与慢性乙型肝炎的病情发展程度有一定的关系,ff基因型的慢性乙型肝炎患者其炎症再活动的可能性更大,且它极可能是通过影响个体的免疫功能而致病,这为更进一步实验,了解慢性乙型肝炎的免疫发病机制及慢性乙型肝炎的基因治疗提供了有价值的理论依据。
[1] Liang Y F. Natural history of chronic hepatitis B vurus infection and long-term outcome under treatment[J]. Liver International, 2009, 29 (1): 100-107.
[2] Zittermann A, Gummert J F.Sun, vitamin D, and cardiovascular disease [J].J Photochem Photobiol, 2010, 101(10):124-129.
[3] Gao L, Tao Y, Zhang L, et al. Vitamin D receptor genetic polymorphisms and tuberculosis: updated systematic review and meta analysis[J]. Int J Tuberc Lung D, 2010, 14(5): 15-23.
[4]崔健, 陈虹, 黄秉仁.维生素D受体最新研究进展[J].生理科学进展, 2011, 42(2): 95-99.
[5] Wu-Wong J R. Potential for vitamin D receptor agonists in the treatment of cardiovascular disease[J].Br J Pharmaco, 2009, 158(11):395-412.
[6] Sreeram V R, Andreas H. A CHIP-seq defined genome-wide map of vitamin D receptor binding: Associations with disease and evolution[J]. Nature Reviews Genetics, 2010, 11(6): 670.
[7] Kimura A, Kishimoto T.IL-6: Regulator of Treg /Th17 balance[J]. Eur J Immunol, 2010, 40(7): 1830-1835.
[8] Chapoval S, Dasgupta P, Dorsey N J, et al.Regulation of the T helper cell type 2 (Th2)/T regulatory cell (Treg) balance by IL-4 and STAT6[J].J Leukoc Biol, 2010, 87(6): 1011-1018.
[9] Shi Y H, Shi G C, Wan H Y, et al.Coexistence of Th1/Th2 and Th17 / Treg imbalances in patients with allergic asthma[J]. Chin Med J(Engl),2011, 124(13): 1951-1956.
[10] Sneha J, Luiz-Carlos P, Liu X K, et al. 1,25-dihydroxyvitamin D (3) ameliorates Th17 autoimmunity via transcriptional modulation of interleukin-17A.[J]Mol Cell Biol, 2011, 31(17): 3653-3669.
[11] Holick M F. Evolution and function of vitamin D[J].Recent Results Cancer Res, 2003, 164(12): 3-28.
[12] Matilainen J M, Malinen M, Turunen M M, et al. The number of vitamin D receptor binding sites defines the different vitamin D responsiveness of the CYP24 gene in malignant and normal mammary cells[J]. Biol Chem, 2010, 285(10): 24 174-24 183.
[13] Ghiringhelli F, Puig P E, Roux S, et al. Tumor cellsconvert immature myeloid dendritic cells into TGF-betasecretingcells inducing CD4+CD25+ regulatory T cell proliferation[J].J Exp Med, 2005, 202 (7): 919-929.
[14] Huang B, Pan P Y, LI Q, et al. Gr-1+CD115+immaturemyeloid suppressor cells mediate the development of tumorinduced T regulatory cells and T-cell anergy in tumor-bearing host[J]. Cancer Res, 2006, 66(2): 1123-1131.
[15] Arai H, Miyamoto K, Taketani Y, et al. A vitamin D receptor genepolymorphism in the translation initiation codeon: Effect on protein activity and relation to bone mineral density in Japaneses women[J]. J Bone Miner Res, 1997, 12(6): 915-921.
[16]韩世发.阿德福韦酯联合复方虫草散剂治疗慢性乙型肝炎的临床观察[J].中国现代医生,2010,48(21):113-115.
Association of Vitamin D Receptor Gene FokⅠ Polymorphisms with Chronic Hepatitis B Patients
LIU Meng,ZHAO Long-feng.//Medical Innovation of China,2014,11(12):022-024
Objective:To investigate the association of vitamin D receptor gene FokⅠ polymorphisms with the clinical phenotype of chronic hepatitis B patients.Method:The genotype of vitamin D receptor gene FokⅠ of 44 heavy degree chronic hepatitis B patients,46 moderate degree chronic hepatitis B patients and 40 non-active HBsAg carriers were tested by polymerase chain react ion-restriction fragment length polymorphism(PCR-RFLP).Result:There were significant differences in FokI genotypes among heavy degree,moderate degree chronic hepatitis B patients and non-activeHBsAg carriers(P<0.01); There were significant difference in the frequence of allel F/f among heavy degree,moderate degree chronic hepatitis B patients and non-active HBsAg carriers(P<0.01), Pearson C=0.53 and the frequency of alleles f in the two groups was significantly higher than that in non-active HBsAg carriers。Conclusion:Vitamin D receptor gene polymorphisms have an relationship with the clinical phenotype of chronic hepatitis B patients.
Chronic hepatitis B; Vitamin D receptor; Genetic polymorphism; Immunoregulatory
10.3969/j.issn.1674-4985.2014.12.008
2014-01-26) (本文编辑:黄新珍)
山西省科技攻关项目(201103113012-4);山西省科技基础条件平台建设项目(2012091007)
①山西医科大学第一附属医院 山西 太原 030001
赵龙凤
First-author’s address: The First Affiliated Hospital of Shanxi Medical University,Taiyuan 030001,China
