补体系统抑制剂联合骨髓间充质干细胞移植用于修复脊髓损伤大鼠的研究
2014-03-10张海松宋振全梁国标刘恩智
张海松,宋振全,梁国标,刘恩智
脊髓损伤(spinal cord injury,SCI)是一种严重危害人类健康的疾病,会严重影响患者劳动能力和生活自理能力,而且其治疗时间长,花费也十分巨大,然而功能恢复却不理想,一直是医学界研究的难点和重点。传统观点认为中枢神经系统损伤后,由于内在的和外在的各种原因导致受损神经很难再生。目前,在脊髓损伤的诸多治疗方案中,细胞移植一直是研究的重点之一[1,2]。然而单独的细胞移植往往达不到理想的效果,仍需要药物进行辅助治疗与干预。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有分化成神经细胞的潜能,是骨髓中的造血结构性和功能性支持细胞,其用于治疗脊髓损伤已取得一定进展[3,4],但对于急性脊髓损伤伴随的补体系统激活引起的损伤组织的中性粒细胞浸润并从而加重继发性损伤却无能为力,导致治疗效果欠佳;补体系统抑制剂(complement system inhibitor,CSI)则恰恰可以弥补这方面的缺陷[5,6],二者的联合移植值得关注。本研究将初步探索补体系统抑制剂与大鼠骨髓间充质干细胞联合移植对于脊髓损伤模型大鼠的修复作用,为后续实验奠定理论基础。
1 材料与方法
1.1 Wistar 大鼠BMSC 的分离、培养、标记取6 w 龄Wistar 大鼠15 只,重约100~150 g,雌雄不限。采用密度梯度离心、贴壁培养和酶消化控制相结合的方法,分离、培养、纯化BMSC,每次传代后在倒置显微镜下作形态学观察与鉴定。传至第6代,在移植前1 d 加入BrdU(3 mg/L)予以标记。移植前细胞计数,制成浓度约为4 ×106/ml 胞悬液。
1.2 补体系统抑制剂成分的制备 参考已报道[7]的方法应用多步沉淀及薄层层析方法进行草麻黄补体抑制成分的提纯并进行活性鉴定。1 kg 草麻黄加入pH 4.0 的蒸馏水10 L 于室温过夜,煮沸1 h后过滤除渣,加入1 mol/L NaOH 调整pH 至9.0,室温搅拌,孵育1 h 至出现大量沉淀物,4000 r/min离心30 min 后弃上清,以pH9.0 蒸馏水及95%乙醇洗涤沉淀3 次,室温烘干得到棕褐色粗品共18.5 g。取3 g 粗品溶于pH 4.0 的蒸馏水50 ml中,搅拌1 h 后过夜,煮沸1 h,2000 r/min 离心15 min,弃上清,溶于pH 9.0 的蒸馏水中。上述酸碱沉淀过程共3 次,最后所得沉淀物溶于10 ml 蒸馏水中,调整pH 值至4.0,进行薄层层析,紫外灯(254 nm)下观察样品分离情况。三段层析带分割收集,以pH 4.0 的蒸馏水分别洗脱,洗脱液调pH 值至9.0,均出现沉淀。离心弃上清,微量法进行补体溶血实验测定,结果证明最快速移动层析带具有显著的抗补体活性,主要作用于补体经典途径及旁路途径的C2 及C9 点位并进而有效抑制补体的联级反应。重复以上步骤,共成功提取草麻黄补体抑制成分(ES)3.9 g,密封贮存备用。
1.3 联合移植细胞悬液组 将上述浓度为4×106/ml 的BMSC 细胞悬液与1.5 g 补体抑制剂成分以100∶ 1 比例混合制成细胞悬液,作为联合移植细胞悬液组。
1.4 SCI 动物模型的制作及分组 取雌性Wistar 大鼠100 只,以大鼠的T11 为中心,通过自制Allen 打击架,制成重物打击致脊髓全瘫Allen 模型。伤后8 d,将制模大鼠随机分为4 组,每组25 只;其中,A 组为BMSC 治疗组、B 组为ES 治疗组、C 组为空白手术组、D 组为BMSC+ES 联合移植治疗组。
1.5 移植方法 用微量进样器抽取6 μl 细胞悬液,在立体定位仪下分别于损伤区中心及远、近端各1 mm 处3 点注射,进针深度为1 mm,注入细胞后针头在脊髓内停留1.5 min 后抽出。空白对照组:注射同体积的培养基。然后依次缝合肌肉及皮肤。
1.6 术后护理 麻醉苏醒后分笼饲养,术后3 d应用抗生素。每天依次进行膀胱按摩挤尿,并翻身防止褥疮发生。术后每隔1 w 称量体重并进行监控。
1.7 灌注、固定、取材、染色移植后的1、3、5 w,每组随机取10 只大鼠,4%多聚甲醛心内灌注、固定、取材,石蜡包埋,连续切片,片厚5 μm,苏木素-依红(HE)染色、观察[8]。
1.8 各组大鼠双后肢的运动功能观察 各组大鼠分别于移植后的7 w 内每周放在100 cm ×150 cm 的开放空间,采用BBB 后肢功能评分标准[9],3人、双盲独立观察大鼠双后肢的运动功能并记录。
1.9 BMSC 存活免疫组织化学观察及计数分别取注射后1、3、5 w 各组标本切片各10 张,先后加入Ⅰ抗(BrdU 小鼠抗大鼠)和Ⅱ抗(小鼠IgG),DAB 显色后观察。在100 倍放大条件下,用Nikon ECLIPSE E600 计算机图像分析仪和Image-pro-plus(4.5)图像分析软件,按文献Lee 法[7]计数每个标本各个时间点BrdU 阳性细胞数的均值以()表示,并计算其占细胞移植数的百分率。
1.10 过氧化物酶(MPO)活性 各组动物于伤后每个时间点各取5 只再次麻醉,以伤处为中心取1 cm 脊髓组织,置于液氮中保存,称重后剪碎。加入含0.5%溴化十六烷基三甲胺的磷酸盐缓冲液中匀浆[9],超声细胞粉碎仪粉碎后再于4 ℃下孵育30 min,12500 r/min 离心30 min,取上清液0.1 ml,按ELISA 测试盒方法进行后续实验。
1.11 统计学方法 采用单因素方差分析法比较组间差异。
2 结果
2.1 术后大鼠体重变化 术后大鼠体重均出现不同程度的减轻,且2 w 内体重减轻明显,4 w 时大鼠体重开始增加(见表1),细胞移植组与空白对照组比较差异有统计学意义。
2.2 各组大鼠后肢功能BBB 评分结果 打击术前大鼠BBB 评分均为21 分,术后1 d 各组大鼠双后肢功能丧失,足底向上呈不负重拖动或足置于不负重位,主要靠前肢拖动身体移动,腹部贴地,大小便失禁,BBB 评分均为0 分,术后7 d 细胞移植组大部分大鼠恢复自主膀胱,2 w 内所有大鼠均可自行排尿。BBB 运动评分具体结果(见表2)。移植后从2 w 开始,各组的BBB 评分由高到低排列顺序为D>A >B >C 组(P <0.05)。
2.3 BMSC 存活及计数观察结果 对于A、B、D 组,移植后1 w 在损伤灶内及损伤灶临近节段的脊髓内可见大量大小不一、呈圆形或椭圆形、胞体较大、蓝色表达于细胞浆的BrdU 阳性细胞,主要分布于灰、白质;在距损伤灶邻近节段脊髓白、灰质内,阳性细胞数明显减少;移植后3 w 损伤段脊髓内仍可见较多BrdU 阳性细胞,但在灰质内的细胞数量明显少于白质;移植后5 w 脊髓内的BrdU 阳性细胞数量减少。D 组移植后1 w 约有(9210 ±652)个BrdU阳性细胞,约占移植细胞数量的7.0%;移植后3 w约有(7923 ±677)个BrdU 阳性细胞,约占移植细胞数量的6.2%;移植后5 w 约有(5822 ±692)个BrdU阳性细胞,约占移植细胞数量的5.1%。A 组移植后1 w 约有(7110 ±552)个BrdU 阳性细胞,约占移植细胞数量的5.8%;移植后3 w 约有(5243 ±517)个BrdU 阳性细胞,约占移植细胞数量的4.2%;移植后5 w 约有(4850 ±545)个BrdU 阳性细胞,约占移植细胞数量的3.5%。B 组移植后1 w 约有(7020±465)个BrdU 阳性细胞,约占移植细胞数量的5.5%;移植后3 w 约有(5106 ±434)个BrdU 阳性细胞,约占移植细胞数量的4.1%;移植后5 w 约有(4341 ±448)个BrdU 阳性细胞,约占移植细胞数量的3.2%。C 组损伤段脊髓及邻近节段内未见有BrdU 阳性细胞。
2.4 过氧化物酶(MPO)活性测定结果 伤后12 h,各组MPO 活性开始增高,分别为0.7824 ±0.085、0.8954 ±0.101、0.8636 ±0.091 和0.7786 ±0.103 (P <0.05);伤后3 d 达到高峰,分别达到1.8824 ±0.125、1.3064 ±0.141、1.9243 ±0.121 和1.2123 ±0.132(P <0.01),之后随着时间延长活性逐渐减弱,存在一个动态变化过程。B 和D 组在伤后3 d 起MPO 活性均弱于A 和C 组,差异具有显著性意义(P <0.01)。
表1 术后各组大鼠不同时期体重变化情况(,n=25)
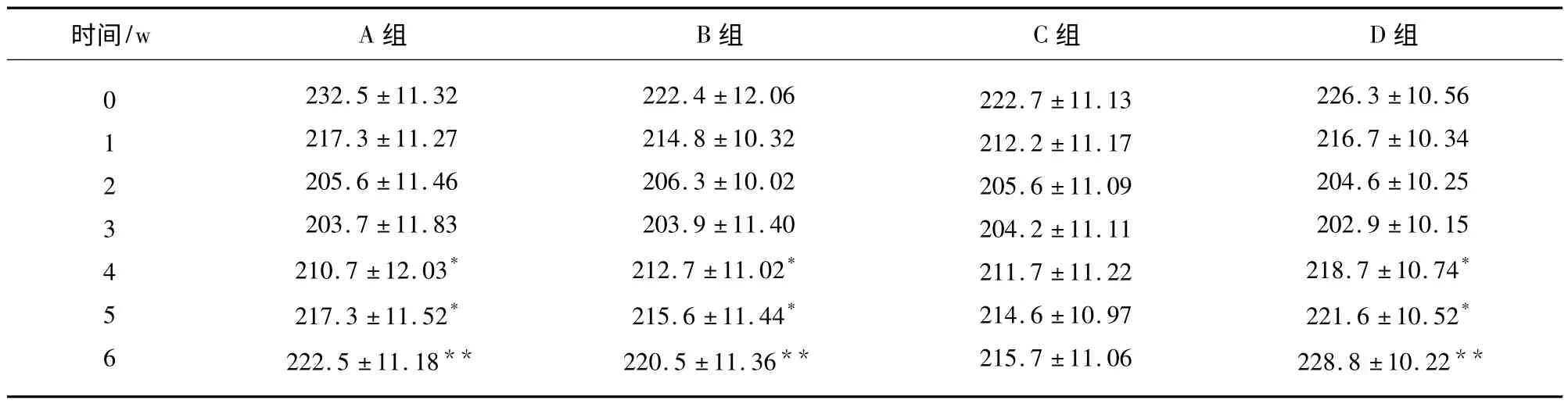
表1 术后各组大鼠不同时期体重变化情况(,n=25)
与空白组比较* P <0.05,**P <0.01
表2 术后各组大鼠不同时期BBB 运动功能评分表(,n=25)

表2 术后各组大鼠不同时期BBB 运动功能评分表(,n=25)
D 组与A 组比较* P <0.05;D 组与B 组比较△P <0.01;与C 组比较#P <0.01
3 讨论
SCI 可以激发机体并引起损伤脊髓组织强烈的免疫炎性反应。此过程包括中性粒细胞、单核细胞等向损伤处浸润、胶质细胞的活化、炎性介质的产生及代谢产物堆积;还可使血管发生痉挛,血管内皮变性、水肿、出血或血小板凝集、血栓形成等,造成局部微循环障碍,从而使损伤脊髓缺血范围不断扩大、损伤程度不断加重[10~12]。
从严格意义上来讲,SCI 后免疫炎症反应是一把双刃剑。一方面该过程可以清除坏死组织,促进组织细胞增生和创面修复,这是机体损伤后修复的基本过程,是一种普遍的防御和保护机制[13]。另一方面,严重的创伤如脊髓损伤时存在过度的炎症反应,这将导致脊髓组织进一步的损伤,妨碍脊髓组织的修复和神经元的再生,导致神经元、神经胶质细胞等继发性的坏死和凋亡,从而阻碍损伤后神经功能的恢复,最终导致临床结果的恶化,而这一方面往往更为重要[14,15]。在对大鼠SCI 模型的研究中发现,SCI组织中的中性粒细胞、巨噬细胞等炎性细胞的数量与继发性SCI 程度密切相关,提示抑制损伤后的炎症反应可显著地减轻神经组织的损害。在本研究中,组织病理学检查结果也显示,大鼠SCI 后损伤组织中的炎症反应存在动态变化过程,实验组的中性粒细胞浸润、神经元肿胀变性等均轻于对照组,提示ES 的干预治疗对损伤后的免疫炎症有抑制作用。免疫炎症反应参与继发性脊髓损害已经越来越得到人们的共识,而通过各种途径抑制SCI 后的炎症反应已经成为SCI 实验性及临床性治疗的一个重要策略及热点方向[16,17]。在急性免疫炎症反应过程中,中性粒细胞是主要的炎症细胞,也是第一个到达损伤组织的炎症细胞[18]。MPO 主要是中性粒细胞胞浆颗粒中的一种特异性酶,每个细胞所含酶约为细胞干重的5%,其活性的高低可代表中性粒细胞的数量和活性[19,20]。我们动态检测大鼠SCI 后脊髓组织的MPO 活性,以明确SCI 后中性粒细胞活性状态,并比较实验组及对照组伤后不同时间点MPO 活力差异。结果表明,B 和D 组在各个时间点MPO 活性均显著弱于A 和C 对照组,表明补体抑制剂ES 对SCI 组织中MPO 活性有显著抑制作用,即对免疫炎症反应的抑制作用较强。结合上述其他实验结果,不难看出,补体系统抑制剂联合骨髓间充质干细胞移植用于修复脊髓损伤大鼠效果较好,既可以增强神经细胞的再生能力又可以抑制其继发的免疫炎症反应,从而大大提高了治疗效果。
[1]Zompa EA,Cain LD,Everhart AW,et al.Transplant therapy:Recovery of function after spinal cord injury[J].J Neurotrauma,1997,14(8):479 -506.
[2]Aguayo AJ,David S,Bray GM.Influences of the glial environment on the elongation of axons after injury:transplantation studies in adult rodents[J].J Exp Biol,1981,95:231 -240.
[3]Wu S,Suzuki Y,Ejiri Y,et al.Bone marrow stromal cells enhance differentiation of cocultured neurosphere cells and promote regeneration of injured spinal cord[J].J Neurosci Res,2003,72(3):343 -351.
[4]Woodbury D,Reynolds K,Black IB.Adult bone marrow stromal stem cel1s express germline,ectodermal,endodermal,and mesodermal genes prior to neurogenesi[J].J Neurosci Res,2002,69(6):908 -917.
[5]Vastha VS,Batone FC,Saran HM,et al.Complonent depletion improve neurological function in cerebral ischemia[J].Brain Research Bulletins,1998,45:413 -419.
[6]Qiao F’Atkinson C,Song H,et al.Complement plays an important role in spinal cord injury and represents a the rapeutic target for improving recovery following trauma[J].Am J Pathol,2006,169:1039 -1047.
[7]Eek JC,Naehtigall D,Humphreys SC,et al.Questiormaire survey of spine surgeons on the use of methylprednisolone for acute spinal cord injury[J].Spine,2006,31:250 -253.
[8]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1 -21.
[9]Stirling DP,Yong VW.Dynamics of the inflammatory response after murine spinal cord injury revealed by flow eytometry[J].J Neurosei Res,2008,86:1944 -1958.
[10]Eng LF,Lee YL.Response of ehemokine antagonists to inflammation in injured spinalcord[J].Neuroehem Res,2003,28:95 -100.
[11]Mollnes TE,Jokiranta TS,Truedsson L,et al.Complement analysis in the 21st century[J].Mol Immunol,2007,44:3838 -3849.
[12]Basu A,Krady JK,O'Malley M,et al.The type 1 interleukin-1 receptor is essential for the etfieient activation of microglia and the induction of muliple proinflammatory mediators in response to brain injury[J].J Neurosei,2002,22:6071 -6082.
[13]Chart CC.Inflammation:beneficial or detrimental after spinal cord injur[J].Recent Pat CNS Drug Diseov,2008,3:189 -199.
[14]Lu HZ,Xu L,Zou J,et al.Effects of autoimmunity on recovery of function in adult rats following spinal cord injury[J].Brain Behav Imlnun,2008,24:125 -130.
[15]Sonia L,Carlson ME,Parrish JE,et al.Acute inflammatory response in spinal cord following impact injury[J].Expetal Neurology,1998,151:77 -88.
[16]Hailer NP.Immunosuppression after traumatio or ischemic CNS damage:it is neuroprotective and illuminates the role of microglial cells[J].Prog Nourobiol,2008,84:211 -233.
[17]Tsai MC,Wei CP,Lee DY,et al.Inflammatory mediators of cerebrospinal fluid from patients with spinal cord injury[J].Stag Ncurol,2008,70:19 -24.
[18]Fitch MT,Silver J.CNS injury,glial soars,and inflammation:Inhibitory extracellular matrices and regeneration failure[J].Exp Nourol,2008,209:294 -301.
[19]Matsumoto T,Tamaki T,Kawakami M,et al.Early complications of high-dose methylprednisolone sodium succinate treatment in the follow-up of acute cervical spinal cord iniury[J].Spine,2001,26:426-430.
[20]Fleming JC,Norenberg MD,Ramsay DA,et al.The cellular inflammatory response in human spinal cords after injury[J].Brain,2006,129:3249 -3269.
