基于Au/SiO2信号放大的沙门氏菌检测方法
2014-03-09宋靓婧马小媛吴世嘉王周平
宋靓婧,马小媛,段 诺,吴世嘉,王周平
基于Au/SiO2信号放大的沙门氏菌检测方法
宋靓婧,马小媛,段 诺,吴世嘉,王周平*
(食品科学与技术国家重点实验室,江南大学食品学院,江苏 无锡 214122)
目的:基于Au/SiO2信号放大,通过循环伏安法实现对沙门氏菌(Salmonella)的高灵敏度检测。方法:将与沙门氏菌靶基因DNA互补配对的碱基序列(捕捉DNA和显示DNA),分别修饰于导电玻璃电极(indium tin oxide,ITO)及Au/SiO2纳米颗粒表面,构建捕获探针和显示探针,当在体系中加入沙门氏菌靶DNA后,会形成捕捉DNA-靶DNA-显示DNA构成的“三明治夹心”结构。由于Au/SiO2的含量与靶DNA浓度呈正相关,因此靶DNA浓度的变化可导致ITO峰电流值相应变化,从而达到检测目的。结果:在最优实验条件下,检测沙门氏菌靶DNA时,浓度在10-11~10-7mol/L范围内呈现出良好的线性关系,线性回归方程为y=-0.000 3x+0.000 1(R2=0.998 9),最低检测限为6 pmol/L;检测沙门氏菌时,线性范围为50~7 910 CFU/mL,线性回归方程为y=-1.6×10-7x+0.003 2(R2=0.994 0),最低检测限为35 CFU/mL。结论:经特异性及实验加标回收实验证明本方法可用于实际样品的检测。
食品分析;沙门氏菌;纳米金;二氧化硅;循环伏安法
沙门氏菌(Salmonella)是兼性厌氧革兰氏阴性菌,在环境中分布广泛[1]。由沙门氏菌引发的沙门氏菌病是世界各地最为普遍的食源性细菌疾病之一,在公共卫生学上具有十分重要的意义[2-3]。传统的沙门氏菌检测方法步骤繁琐、耗时长,难以满足当前追求快速、高效的沙门氏菌检测需要[4]。为此,各国研究人员针对沙门氏菌的快速检测做了大量研究,已报道的方法多种多样,如基于免疫学的免疫磁珠分离法、荧光免疫分析法、酶联免疫法等[5-9]及基于分子生物学的聚合酶链式反应(polymerase chain reaction,PCR)、多重PCR(multiplex PCR)、基因芯片法等[10-13]。这些方法虽在一定程度上节省了操作时间,但其最低检测限一般在100 CFU/mL以上,一些步骤操作繁琐、成本较高、出现假阳性等诸多不足,难以推广利用。
纳米技术作为当今的前沿科技,在许多领域都展现出宏观材料所无可比拟的优越性[14-15]。纳米金作为纳米材料中一种研究较早、发展成熟的材料在食品安全领域受到广泛关注。纳米金也称作胶体金,其直径大小为1~100 nm[16]。纳米金制备简单、性质稳定、颗粒均一,除具备一般纳米材料的表面效应、小尺寸效应、量子效应等特性外,还具有良好的导电性,在建立高灵敏度的生物传感器方面具有重要作用[17-19];同时还具有良好的生物相容性,能迅速吸附生物大分子但不改变其活性[20-22]。在一定实验条件下,构建Au/SiO2纳米复合材料,借助SiO2纳米材料比表面积大、不易团聚、易修饰等特点,将其作为DNA的连接载体;借助纳米金良好的导电性,将其作为生物分子与电极之间的导线,起到加快异相界面的电子传递速率的作用,纳米复合颗粒较单一颗粒更易形成连续势场,因此在增强电流效应、放大电信号、提高灵敏度方面表现优异[23-25]。
本实验研究了一种基于纳米金的沙门氏菌电化学检测方法。通过在亲和素化的ITO表面修饰生物素标记的捕捉DNA,在亲和素化的Au/SiO2纳米材料表面修饰生物素标记的显示DNA,构建捕捉探针及显示探针,结合靶DNA,形成一种由捕捉DNA-靶DNA-显示DNA构成的“三明治夹心”结构的DNA杂交产物。由于Au/SiO2的含量与靶DNA浓度呈正相关,利用ITO及纳米金的导电性,基于电化学方法,在一定浓度范围内,通过循环伏安法,ITO表面的峰电流值随着靶DNA浓度的改变而发生有规律的变化,从而实现对沙门氏菌高灵敏的检测。
1 材料与方法
1.1 材料与试剂
浓氨水、无水乙醇、正硅酸四乙酯(ethylsilicate,TEOS)、3-氨丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,APTES)、戊二醛、氯金酸、NaBH4、H2O2(均为分析纯)国药集团上海化学试剂有限公司;导电玻璃(ITO) 广东力新达能源材料有限公司;亲和素 美国Sigma公司;Biospin细菌基因组DNA提取试剂盒 伯尔迪生物科技(杭州)有限公司;本实验涉及菌种均取自本实验室;所有寡核苷酸序列由上海生工生物工程技术服务有限公司合成。
沙门氏菌特异寡核苷酸探针序列[26]:
Seq1:5’- GAG CGT GCC TTA CCG ACG ATA -biotin - 3’(捕捉DNA)
Seq2:5’- SH-ATA TCC ACG CAG GAA ATA ACA GGA CTT - 3’(显示DNA)
Seq3:5’- TAT CGT CGG TAA GGC ACG CTC AAT TGT CGT TAA AGT CCT GTT ATT TCC TGC GTG GAT AT - 3’(目标序列)
Seq4:5’- TAT CGT CGG TAA GGC AAG CTC AAT TGT CGT TAA AGT CCT GTT ATT TCC TGC GTG GAT AT - 3’(目标序列-单碱基突变链)
Seq5:5’- TAT CGT CGG TAT GGC AAG CTC AAT TCT CGT TTA ACT CCT GTT ATT TCC TGC GTG GAT AT - 3’(目标序列-五碱基突变链)
Seq6:5’- ACA TCT GCA AAA CCG TAT AAG TCC GGT TCG ATA ATG CTG TTG CGG CTT GCT TTT CCG CG -3’(随机对照链)
1.2 仪器与设备
CHI660D电化学工作站三电极体系(ITO工作电极、银/氯化银参比电极、铂丝对电极) 上海辰华仪器有限公司;JEM-2100HR透射电子显微镜 日本Jeol公司;UV-1800紫外分光光度计 日本岛津 公司;NICOLET iS10傅里叶红外光谱仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 亲和素化的SiO2纳米材料的制备
本实验采用Stober等[27]方法稍加改进制备单分散二氧化硅粒子。
1)配制A液:5 mL NH3·H2O+20 mL 无水乙醇+ 10 mL超纯水;B液:1.8 mL TEOS+5 mL 无水乙醇。
2)将B液逐滴加入A液中,混合液于30 ℃磁力搅拌1 100 r/min条件下反应4~6 h。再加入APTES 0.4 mL,继续反应2 h。将所得产物于10 000 r/min离心10 min,依次用无水乙醇、PBS缓冲液(NaCl 0.8 g、KCl 0.02 g、Na2HPO4·12H2O 0.29 g、KH2PO40.024 g、H2O 100 mL、pH 7.4)离心洗涤3 次,收集沉淀。
3)加入体积分数为5%的戊二醛-PBS缓冲液50 mL,室温磁力搅拌1 100 r/min条件下反应2 h,所得产物于5 500 r/min离心10 min,依次用PBS缓冲液、碳酸盐包被液(NaHCO30.29 g、Na2CO30.16 g、H2O 100 mL、pH 9.6)离心洗涤3 次,收集沉淀,加入50 mL碳酸盐包被液,超声重悬。
4)取4 mL经碳酸盐包被液重悬的经戊二醛处理的SiO2纳米材料按10 mg/L的比例加入亲和素,4 ℃条件下摇床孵育12 h,5 500 r/min离心10 min,PBS溶液离心洗涤3 次,弃上清液以除去多余亲和素。
5)对氨基化的SiO2纳米材料采用透射电子显微镜及红外光谱仪进行表征,对亲和素化的SiO2纳米材料采用紫外分光光度计进行表征。
1.3.2 H2O2还原Au/SiO2的制备[28]
1)纳米金的制备:取4 ℃条件下的200 mL超纯水,依次加入 1 g/100mL的HAuCl4溶液3 mL,0.2 mol/L的K2CO3溶液1 mL,磁力搅拌片刻。向混合溶液中迅速加入9 mL新鲜配制的0.5 mg/mL NaBH4溶液,混合溶液由棕褐色转变为酒红色,磁力搅拌5 min,于4 ℃保存备用。
2)取1.3.1节所得的亲和素化的SiO2纳米材料,混匀加入到20 mL酒精中,逐滴缓慢加入到180 mL新鲜配制的纳米金中,磁力搅拌1 h。4 000 r/min离心12 min,超纯水离心3 次,弃上清液,取沉淀超声分散于10 mL超纯水中,制得Au/SiO2纳米材料。
3)配制K2CO3/HAuCl4生长液:将25 mg K2CO3溶于100 mL超纯水中,磁力搅拌10 min,加入1 g/100 mL的HAuCl4溶液1.5 mL,持续搅拌20 min,4 ℃避光保存。
4)取0.132 mol/L的H2O2溶液0.1 mL,0.5 mL上述Au/SiO2纳米材料,6 mL K2CO3/HAuCl4生长液,经还原后在4 000 r/min离心12 min,取沉淀加PBS缓冲液混匀,避光保存。
5)将生物素标记的目标链互补配对序列2(显示DNA)按一定浓度梯度稀释,与上述制备好的Au/SiO2混合,37 ℃摇床中孵育12 h,得到显示探针。
6)对H2O2还原前后的Au/SiO2采用透射电子显微镜及紫外分光光度计行表征。
1.3.3 表面修饰的ITO的制备
1)取1 cm×5 cm规格得导电玻璃ITO,分别用清洗剂、超纯水、乙醇、丙酮各超声洗涤3 次,N2吹干。
2)将ITO置于体积分数为1%的APTES-无水乙醇混合液中,室温条件下孵育12 h,醇洗5 次,120 ℃条件下干燥3 h。
3)将ITO置于质量浓度为15 mg/L的亲和素溶液中,4 ℃摇床中孵育12 h,PBS洗板3 次,N2吹干。
4)将亲和素化的ITO置于按一定浓度梯度稀释的生物素标记的目标链互补配对序列1(捕捉DNA)中,37 ℃摇床中孵育12 h,PBS洗板3 次,N2吹干。
5)将上述ITO置于按一定浓度梯度稀释的靶DNA中,37 ℃摇床中孵育12 h,PBS洗板3 次,N2吹干。
6)将上述ITO与显示探针结合,37 ℃摇床中孵育12 h,PBS洗板3 次,N2吹干。
1.3.4 ITO表面修饰的表征及不同浓度探针的循环伏安检测方法
1)配制铁钾电解液:准确称取KCl 7.45g、K3[Fe(CN)6] 0.329 g、K4[Fe(CN)6] 0.422 g,定容至100 mL。
2)将三电极体系(以表面修饰的ITO为工作电极,以银/氯化银为参比电极,以铂丝为对电极)置于上述铁钾电解液中,设定起始电压-0.2 V,扫描速率100 mV/s,扫描时间60 s,机器预热30 min后开始实验,用循环伏安法进行检测。
1.3.5 特异性实验
分别对沙门氏菌和金黄色葡萄球菌、埃希氏大肠杆菌O157∶H7、单增李斯特菌、阪崎杆菌进行37 ℃摇床过夜培养,然后将菌液按梯度稀释,37 ℃恒温培养24 h并计数。利用试剂盒提取所培养的细菌DNA,得所需的单链DNA。把所制备的单链DNA及原目标链、单碱基突变链、五碱基突变链作为靶DNA,按本实验构建的方法进行实验,通过比较A700nm/A500nm的值来验证特异性。
1.3.6 沙门氏菌DNA的提取与检测
提取各个稀释度的沙门氏菌DNA,得所需的单链DNA。将其作为靶DNA,按本实验构建的方法进行试验,与传统平板计数方法结果相比较,绘制标准曲线,找到线性范围及最低检测限。
1.3.7 牛奶样品中沙门氏菌加标回收
为评价本方法的可行性,将不同浓度的沙门氏菌加入市售无菌牛奶样品中,将所得结果与传统平板计数方法结果比较,得出回收率。
2 结果与分析
2.1 基于ITO及Au/SiO2的“三明治夹心”结构检测沙门氏菌的原理
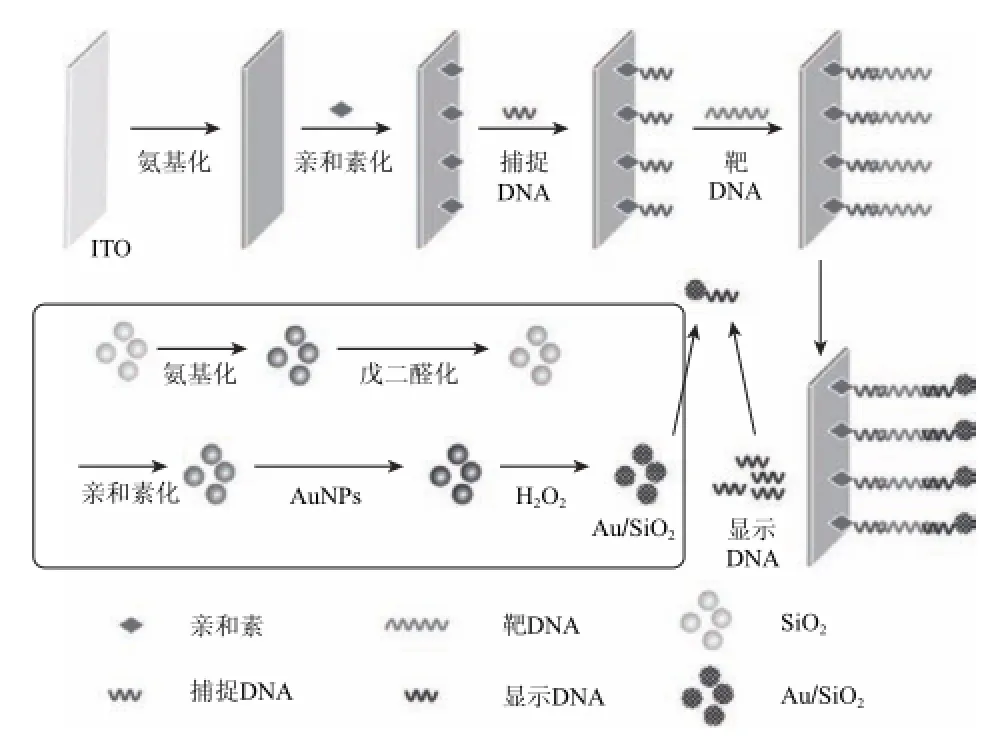
图1 基于ITO及Au/SiO2的“三明治夹心”结构检测沙门氏菌原理图Fig.1 Schematics of “sandwich” structure based on ITO and Au/SiO2for Salmonella detection
将生物素标记的沙门氏菌目标链互补配对序列1(捕捉DNA)修饰在亲和素化的ITO表面,将生物素标记的目标链互补配对序列2(显示DNA)修饰在亲和素化的Au/SiO2复合材料表面,结合靶DNA,形成“三明治夹心”结构,利用ITO的导电性以及H2O2还原金纳米颗粒的信号放大作用,采用循环伏安法检测电信号,实现对沙门氏菌的检测。原理如图1所示。
2.2 氨基化的SiO2纳米材料表面修饰表征
本实验以TEOS作为前驱物质,氨水为催化剂,乙醇为溶剂,在恒定温度和转速条件下通过TEOS水解得到单分散二氧化硅粒子。通过加入APTES,引入更多的自由氨基,修饰到纳米粒子表面,得到氨基化SiO2纳米材料。
图2a显示:所制备的SiO2纳米材料形成了较规则球形,直径在80~100 nm,分散性较好,可应用于后续实验。由图2b可见,1 097.3 cm-1处出现的强吸收峰为SiO2纳米材料的非对称Si—O—Si伸缩振动峰,1 384.6 cm-1的振动吸收峰为—CH2—上的C—H不对称振动吸收峰,1 629.5 cm-1处出现的振动吸收峰为一级胺的N—H剪式振动吸收峰,3 428.8 cm-1处出现的强吸收峰为N—H的伸缩振动吸收峰,红外图谱表明在SiO2纳米材料表面已经成功包覆上氨基。
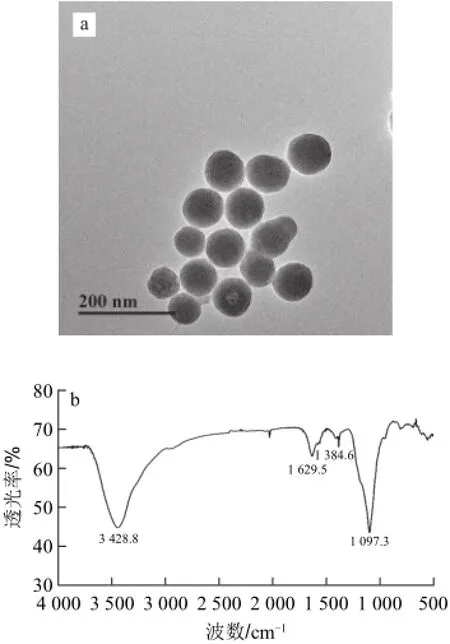
图2 SiO2纳米材料的TEM图(a)和氨基化SiO2纳米材料的红外图谱(b)Fig.2 TEM image of SiO2(a) and IR spectra of amine-functionalized SiO2(b)
2.3 Au/SiO2经H2O2还原前后的表征
利用HAuCl4、K2CO3、NaBH4制备纳米金颗粒,将SiO2纳米材料与金颗粒在静电吸附和配位作用下形成均一的Au/SiO2复合材料。图3a显示:金颗粒成功吸附在SiO2纳米材料表面,形成Au/SiO2纳米复合材料。利用H2O2的还原性,将包覆在硅球表面的金颗粒进一步还原长大,从而增强“三明治夹心”结构生物传感器的电信号,实现电信号放大检测。图3b显示经H2O2还原后,SiO2纳米材料外包覆的金颗粒增大。
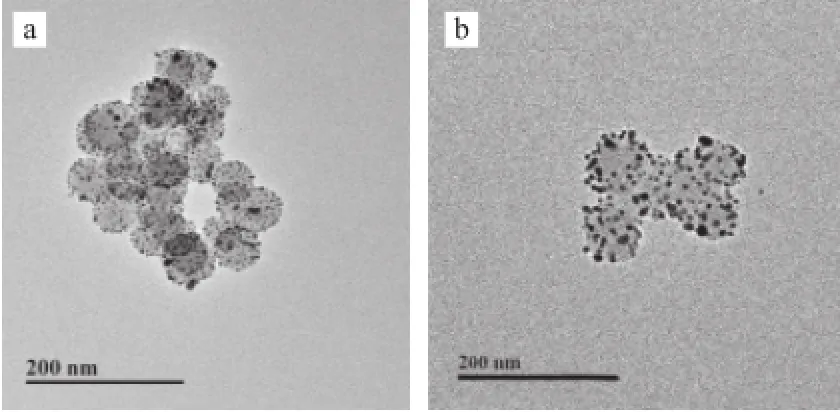
图3 Au/SiO2纳米复合材料(a)和H2O2还原后Au/SiO2纳米复合材料(b)的TEM图Fig.3 TEM image of Au/SiO2(a) and Au/SiO2reduced by H2O2(b)
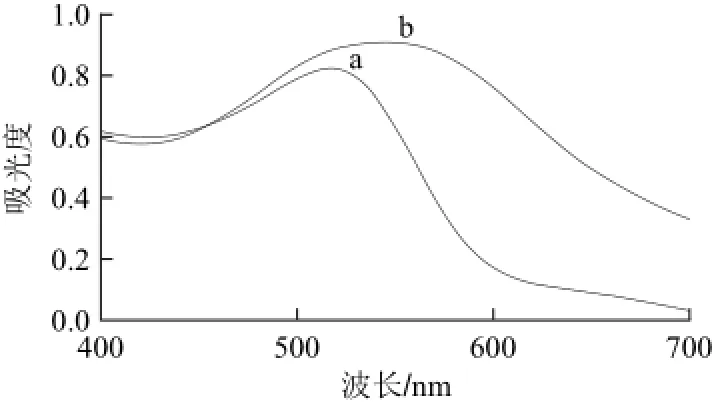
图4 Au/SiO2纳米复合材料经H2O2还原前(a)、后(b)的紫外-可见吸收光谱图Fig.4 UV-Visible absorption spectrum of Au/SiO2reduced by H2O2(b) compared with normal Au/SiO2(a)
由图4可以看出,未经H2O2还原的Au/SiO2纳米复合材料在530 nm波长处有明显紫外吸收峰,经H2O2还原后,金颗粒粒径增大,在570 nm波长处有明显紫外吸收峰,发生红移现象,证明H2O2成功还原Au/SiO2,可以应用于后续实验。
2.4 亲和素修饰SiO2纳米材料及ITO的表征及优化
“三明治夹心”结构的DNA杂交产物是通过生物素化的目标链与经过亲和素修饰的SiO2纳米材料及ITO之间特异性结合而产生的。因此,亲和素能否成功修饰在材料表面是本实验成功与否的基础。
分别用亲和素对SiO2纳米材料及ITO表面进行修饰,图5显示亲和素修饰前后亲和素浓度的变化,修饰后上清液中亲和素含量明显减少,证明亲和素成功修饰在SiO2纳米材料及ITO表面。接着对亲和素浓度进行优化,计算亲和素溶液在修饰SiO2纳米材料及ITO在修饰亲和素前后上清液在280 nm波长处的紫外吸光度减少量。如图6a所示,对于SiO2纳米材料,在亲和素质量浓度为10.00 mg/L时,吸光度减少最明显,之后随亲和素质量浓度增大差值不再发生明显变化,说明亲和素加入量饱和;而对于亲和素修饰ITO而言,如图6b所示,在亲和素质量浓度为15.00 mg/L时,吸光度减少最明显,之后随亲和素浓度增大差值不再发生明显变化,说明亲和素加入量饱和,因此确定10.00 mg/L为SiO2微球体系的最佳亲和素包被质量浓度,15.00 mg/L为ITO的最佳亲和素包被质量浓度。
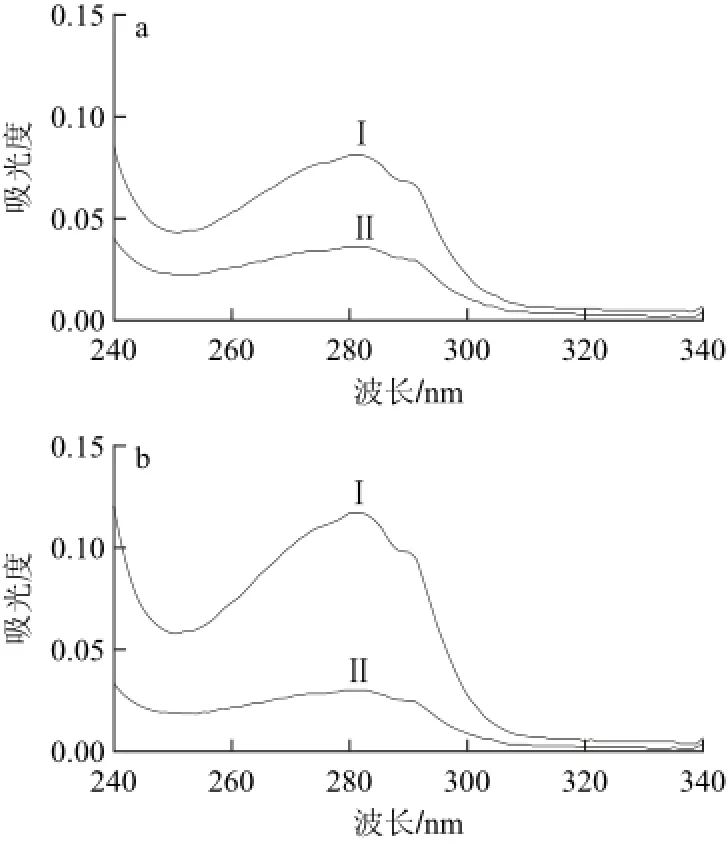
图5 亲和素修饰(a)SiO2纳米材料及ITO(b)前(Ⅰ)、后(Ⅱ)的紫外-可见吸收光谱图Fig.5 UV-Vis absorption spectra of the supernatant of SiO2(a) and ITO (b) before (Ⅰ) and after (Ⅱ) being modified by avidin
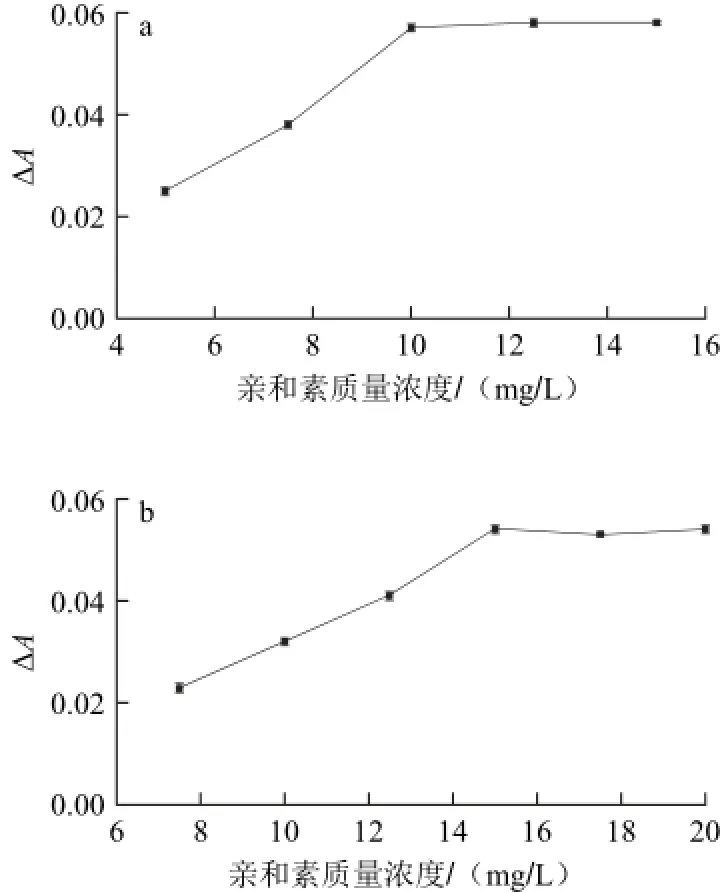
图6 不同质量浓度下亲和素修饰SiO2纳米材料(a)及ITO(b)上清液吸光度变化趋势(λ=280 nm)Fig.6 Absorbance changes of the supernatant of SiO2NPs (a) and ITO (b) before and after being modified by different concentrations of avidin (λ=280 nm)
2.5 ITO表面修饰及表征
基于ITO的导电性,本实验采用循环伏安法对ITO表面的修饰过程进行表征。从图7可以看出,由于没有连接任何物质,空白ITO的导电性能最强,电流值最大,随着在ITO表面进行氨基化处理、修饰亲和素、连接捕捉DNA、连接靶DNA、ITO的电阻增大,导电性能减弱,所测得的峰电流值不断下降(图7中1~5线所示),同时也证明每一步目标物质均成功修饰于ITO表面。但是,当在ITO表面连接由过氧化氢还原的Au/SiO2与显示DNA构成的显示探针时,峰电流值增大(图7中6线),这是由于Au/SiO2中的金颗粒具有导电性,使电极表面的导电性增强。
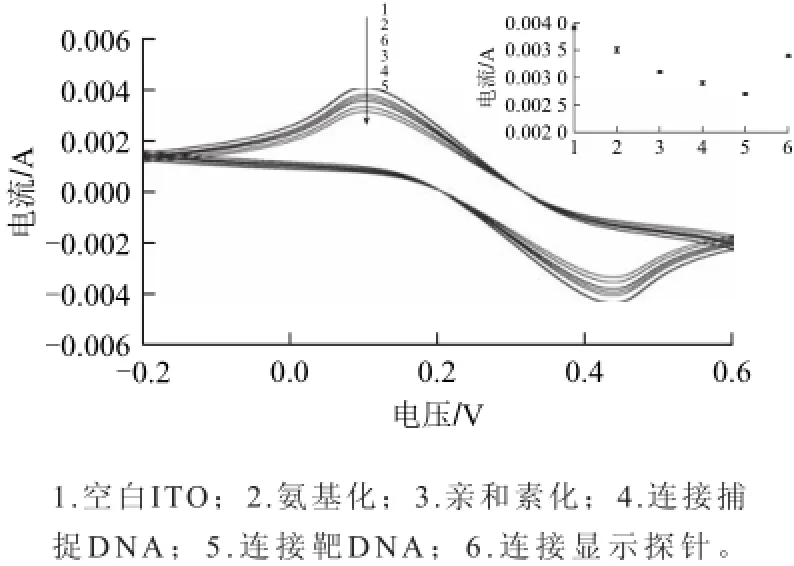
图7 ITO自组装生物传感器的循环伏安曲线表征图Fig.7 CV curves for characterization of the self-assembled ITO biosensor
2.6 沙门氏菌的检测
利用导电玻璃的导电性,使用循环伏安法探究实验的检测限和线性范围。选取10-11、10-10、10-9、10-8、10-7mol/L梯度稀释的沙门氏菌特异寡核苷酸目标探针,经实验发现当在一定范围内,随着目标探针浓度的增大,ITO上连接的目标探针增多,ITO表面的电阻增大,峰电流随之减小。但目标探针浓度过低时,ITO表面电阻值变化很小,所检测到的峰电流值与空白ITO相近,达到最低检测限。由图8可以看出,沙门氏菌特异寡核苷酸目标探针浓度(lgc)在10-11~10-7mol/L呈现出良好的线性关系,线性回归方程为y=-0.000 3x+0.000 1(R2=0.998 9),最低检测限为6 pmol/L。
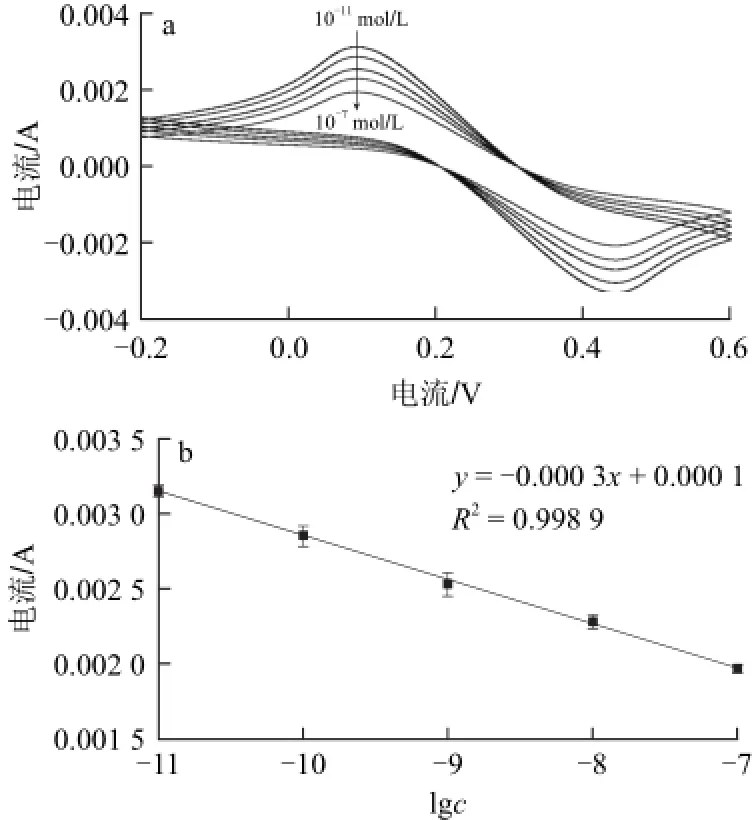
图8 10-11~10-7mol/L沙门氏菌检测CV(a)和标准曲线(b)图Fig.8 CV curves of 10-11-10-7mol/L of Salmonella (a) and linear correlation in the range of 10-11-10-7mol/L of Salmonella (b)
2.7 特异性分析
依上述方法,采用相同浓度(10-7mol/L)的完全匹配靶DNA和单碱基突变链、五碱基突变链、随机对照链以及提取的金黄色葡萄球菌、埃希氏大肠杆菌O157∶H7、单增李斯特菌、阪崎杆菌DNA进行检测,比较其在按照本实验构建的检测方法下,按实验步骤将ITO修饰完全时其循环伏安曲线中的峰电流值与空白ITO的差值(ΔI),结果如图9所示,证明本检测方法具有良好的特异性。
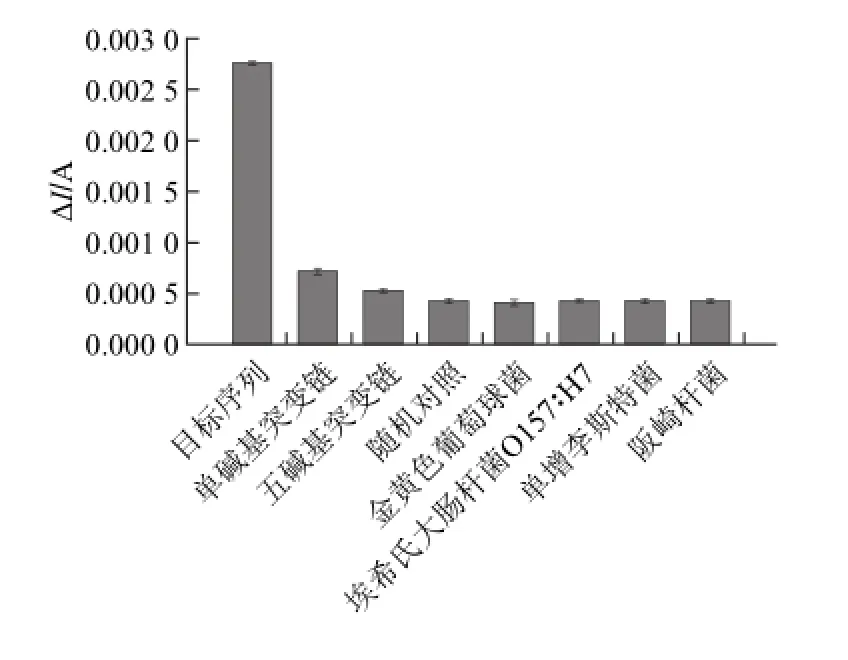
图9 本方法的特异性分析Fig.9 Specificity evaluation of this method
2.8 沙门氏菌DNA的提取与检测
将过夜培养的沙门氏菌用紫外分光光度计测定600 nm处光密度(OD600nm),通过该OD600nm值推断菌体浓度,然后对菌液进行梯度稀释,再测定所稀释菌液的OD600nm值,结果符合成品试剂盒的最佳提取要求。取等体积不同稀释度的菌液进行平板计数,另一方面,取相同体积的菌液利用成品试剂盒提取沙门氏菌DNA,采用本实验建立的方法以所提取的沙门氏菌DNA作为靶DNA进行检测,将检测所得结果与平板计数结果相比较,发现峰电流值与平板计数所得菌落个数具有良好相关性。如图10所示,线性回归方程为y=-1.6×10-7x+0.003 2(R2=0.994 0),线性范围为50~7 910 CFU/mL,最低检测限为35 CFU/mL。
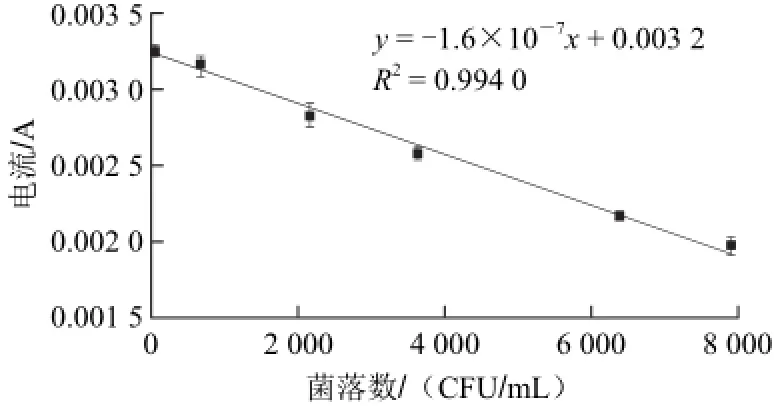
图10 菌落数与峰电流值的线性关系Fig.10 Linear relationship between colony numbers and peak point current
2.9 牛奶样品中沙门氏菌加标回收实验
利用本实验建立的检测方法及平板计数法对稀释至不同浓度的沙门氏菌进行检测,并比较其结果,得出回收率。结果如表1所示,由此可得本方法测得的菌落个数与传统的平板计数方法所测得的结果基本统一,沙门氏菌的检测回收率在93.0%~101.8%之间,回收率良好。说明本实验所建立的沙门氏菌检测方法比传统的平板计数法准确度更高,可以应用于实际样品中沙门氏菌的检测。
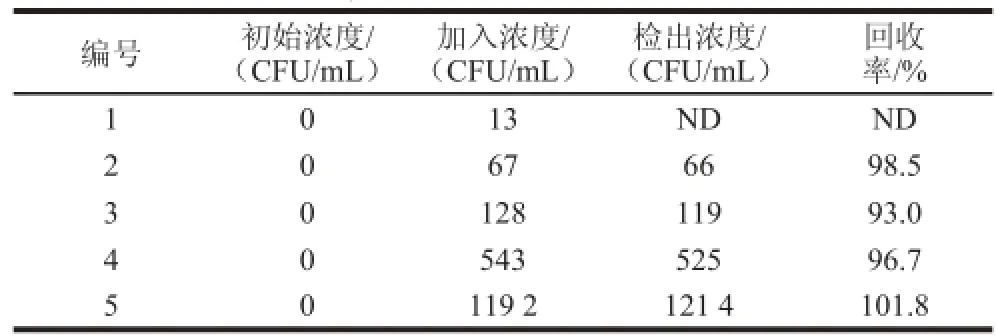
表1 牛奶样品中沙门氏菌的检测回收率Table 1 Recovery of Salmonella from spiked milk samples
3 结 论
本研究利用SiO2纳米材料、纳米金及ITO构建了一种具有独特“三明治夹心”结构的DNA杂交生物传感器,并利用循环伏安法进行表征并实现检测。在一定范围内,通过加入不同浓度靶DNA,使ITO的峰电流值呈现有规律的变化,两者呈现出良好线性相关性,从而实现了对沙门氏菌靶DNA的检测。本方法操作简便、灵敏度高、重复性好,并缩短了检测时间,最低检测限可达6 pmol/L。经一系列实验证明本方法可对沙门氏菌进行特异性检测,所测结果与菌落具有线性相关,在最佳实验条件下,在50~7 910 CFU/mL之间具有良好线性(R2=0.994 0),最低检测限可达35 CFU/mL,并且所测结果与传统的平板计数一致性良好,回收率在93.0%~101.8%之间。本研究为准确高效检测沙门氏菌提供了一种新方法,具有较强应用价值。
[1] 杨保伟, 张秀丽, 曲东, 等. 2007—2008年陕西部分零售畜禽肉沙门氏菌血清型和基因型[J]. 微生物学报, 2010, 50(5): 654-660.
[2] SANCHEZ-VARGA F M, ABU-EI-HAIJA M A, GOMEZ-DUARTE O G. Salmonella infections: an update on epidemiology, management, and prevention[J]. Travel Medicine and Infectious Disease, 2011, 9(6): 263-277.
[3] FDA/CFSAN Food Safety A to Z Reference Guide-Salmonella. FDA-center for food safety and applied nutrition[R]. USA: FDA, (2008-07-03) Retrieved 2009-02-14.
[4] 郭润霞, 鲁波, 张伟, 等. 沙门菌检测技术现况[J]. 中国卫生检验杂志, 2007, 17(10): 1917-1919.
[5] YANG Youjun, XU Feng, XU Hengyi, et al. Magnetic nano-beads based separation combined with propidium monoazide treatment and multiplex PCR assay for simultaneous detection of viable Salmonella typhimurium, Escherichia coli O157:H7 and Listeria monocytogenesin food products[J]. Food Microbiology, 2013, 34(2): 418-424.
[6] CLOAK O M, DUFFY G, SHERIDAN J J, et al. Development of a surface adhesion immunofluorescent technique for the rapid detection of Salmonellae spp. from meat and poultry[J]. Journal of APP Lied Microbiology, 1999, 86(4): 583-590.
[7] 黄嫦娇, 黄晓蓉, 郑晶, 等. 全自动荧光酶联免疫方法检测食品中沙门氏菌[J]. 安徽农业科学, 2010, 38(10): 5320-5321; 5323.
[8] FALKENHORST G, CEPER T H, STRID M A, et al. Serological follow-up after non-typhoid Salmonella infection in humans using a mixed lipopolysaccharide ELISA[J]. International Journal of Medical Microbiology, 2013, 303(8): 533-538.
[9] JAIN S, CHATTOPADHYAY S, JACKERAY R, et al. Highly sensitive detection of Salmonella typhi using surface aminated polycarbonate membrane enhanced-ELISA[J]. Biosensors and Bioelectronics, 2012, 31(1): 37-43.
[10] MYINT M S, JOHNSONA Y J. The effect of pre-enrichment protocol on the sensitivity and specificity of PCR for detection of naturally contaminated Salmonella in raw poultry compared to conventional culture[J]. Food Microbiology, 2006, 23(6): 599-604.
[11] MA Kai, DENG Yi, BAI Yu, et al. Rapid and simultaneous detection of Salmonella, Shigella, and Staphylococcus aureus in fresh pork using a multiplexreal-time PCR assay based on immunomagnetic separation[J]. Food Control, 2014, 42: 87-93.
[12] GARRIDO A, CHAPELA M J, ROMAN B, et al. A new multiplex real-time PCR developed method for Salmonella spp. and Listeria monocytogenes detection in food and environmental samples[J]. Food Control, 2013, 30(1): 76-85.
[13] MASEK B J, HARDICK J, WON H, et al. Sensitive detection and serovar differentiation of typhoidal and nontyphoidal Salmonella enterica species using 16S rRNA gene PCR coupled with highresolution melt analysis[J]. The Journal of Molecular Diagnostics, 2014, 16(2): 261-266.
[14] VASIMALAI N, ABRAHAM JOHN S. Picomolar melamine enhanced the fluorescence of gold nanoparticles: spectrofluorimetric determination of melamine in milk and infant formulas using functionalized triazole capped goldnanoparticles[J]. Biosensors and Bioelectronics, 2013, 42(15): 267-272.
[15] IGNAT T, HUSANU M A, MUNOZ R, et al. Gold nano-island arrays on silicon as SERS active substrate for organic molecule detection[J]. Thin Solid Films, 2014, 550(1): 354-360.
[16] 殷焕顺, 艾仕云, 江建民. 制备金纳米粒子的研究进展[J]. 材料研究与应用, 2007(4): 227-280.
[17] AFONSO A S, PEREZ-LOPEZ B, FARIA R C, et al. Electrochemical detection of Salmonella using gold nanoparticles[J]. Biosensors and Bioelectronics, 2013, 40(1): 121-126.
[18] FENG Rui, ZHANG Yong, LI He, et al. Ultrasensitive electrochemical immunosensor for zeranol detection based on signal amplification strategy of nanoporous gold films and nano-montmorillonite as labels[J]. Analytica Chimica Acta, 2013, 758(3): 72-79.
[19] WANG Xiaolin, ZHANG Xiaoli. Electrochemical co-reduction synthesis of graphene/nano-gold composites and its application to electrochemical glucose biosensor[J]. Electrochimica Acta, 2013, 112(1): 774-782.
[20] LIU Chengche, YEUNG Chunyan, CHEN Pohao, et al. Salmonella detection using 16S ribosomal DNA/RNA probe-gold nanoparticles and lateral flow immunoassay[J]. Food Chemistry, 141(3): 2526-2532.
[21] PREECHAKASEDKIT P, PINWATTANA K, DUNGCHAI W, et al. Development of a one-step immunochromatographic strip test using gold nanoparticles for the rapid detection of Salmonella typhi in human serum[J]. Biosensors and Bioelectronics, 2012, 31(1): 562-566.
[22] POTUCHOVA L, FRANKO F, BAMBOUSKAVA M, et al. Rapid and sensitive detection of cytokines using functionalized gold nanoparticle-based immuno-PCR, comparison with immuno-PCR and ELISA[J]. Journal of Immunological Methods, 2011, 371(1): 38-47.
[23] XU Jian, PERRY C C. A novel approach to Au@SiO2core-shell spheres[J]. Journal of Non-Crystalline Solids, 2007, 353(11/12): 1212-1215.
[24] CAI Hong, ZHU Ningning, JIANG Ying, et al. Cu@Au alloy nanoparticle as oligonucleotides labels for electrochemical stripping detection of DNA hybridization[J]. Biosensors and Bioelectronics, 2003, 18(11): 1311-1319.
[25] 范晓敏, 邹文军, 顾仁敖, 等. Au@SiO2核壳纳米粒子的制备及其表面增强拉曼光谱[J]. 高等学校化学学报, 2008, 20(1): 130-134.
[26] 国家健康与医学研究所. 检测沙门氏菌属的寡核苷酸: 法国, 96104393.8[P]. 2005-01-19.
[27] STOBER W, FINK A, BOHN E. Controlled growth of monodiperse silica spheres in the micron size range[J]. Journal of Colloid and Interface Science, 1968, 26: 62-69.
[28] MA Xiaoyuan, LIU Liangliang, LIU Fangjing, et al. Biocatalytically induced growth of gold nanoshells: using enzyme reaction for the controllable fabrication of nanomaterials[J]. Journal of Nanoscience and Nanotechnology, 2012, 12(2): 870-878.
Detection of Salmonella by Electrochemical Method Based on Au/SiO2Signal Amplification
SONG Liang-jing, MA Xiao-yuan, DUAN Nuo, WU Shi-jia, WANG Zhou-ping*
(State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Purpose: To establish a detection method with high sensitivity for Salmonella by cyclic voltammetry based on Au/SiO2signal amplification. Methods: The capture DNA and the display DNA, which are complementary with the target DNA were modified onto the surface of indium tin oxide (ITO) electrode and the surface of Au/SiO2nanoparticles. As results, capture probe and display probe were constructed. A “sandwich” structure was constructed by capture DNA-target DNA-display DNA when Salmonella target DNA was added into the system. As the content of Au/SiO2was positively correlated with the concentration of the target DNA, the peak current value of fully modified ITO could be changed by varying the concentration of the target DNA, so as to achieve the purpose of detection. Results: Under the optimal conditions, the method showed a good linear relationship when the concentration of target DNA was in the range of 10-11to 10-7mol/L, the linear regression equation was y = -0.000 3x + 0.000 1 (R2= 0.998 9), and the lowest limit of detection (LOD) was 6 pmol/L. And it showed a good linear relationship when the concentration of Salmonella was in the range of 50 to 7 910 CFU/mL, the linear regression equation was y = -1.6×10-7x + 0.003 2 (R2= 0.994 0), and the lowest LOD was 35 CFU/mL. Conclusions: The specificity and spiked recovery experiments proved that this method could be used for the detection of actual samples.
food analysis; Salmonella; gold nanoparticles; silicon dioxide (SiO2); cyclic voltammetry
TS207.3
A
1002-6630(2014)08-0050-07
10.7506/spkx1002-6630-201408009
2014-03-29
国家自然科学基金面上项目(21375049);江苏省科技支撑计划项目(BE2012614);
“十二五”国家科技支撑计划项目(2012BAK08B01)
宋靓婧(1989—),女,硕士研究生,研究方向为食品安全检测。E-mail:kwonleesong@163.com*
王周平(1974—),男,教授,博士,研究方向为食品安全检测。E-mail:wangzp@jiangnan.edu.cn
