脱氧雪腐镰刀菌烯醇模拟表位的2 种融合蛋白的表达及其在无毒酶联免疫吸附方法中的应用
2014-03-09徐富勇刘仁荣裘雪梅朱立鑫
徐富勇,孟 玮,刘仁荣,*,徐 玲,裘雪梅,朱立鑫
(1.江西科技师范大学生命科学学院,江西 南昌 330013;2.南昌大学生命科学与食品工程学院,江西 南昌 330029)
脱氧雪腐镰刀菌烯醇模拟表位的2 种融合蛋白的表达及其在无毒酶联免疫吸附方法中的应用
徐富勇1,2,孟 玮1,刘仁荣1,*,徐 玲1,裘雪梅1,朱立鑫1
(1.江西科技师范大学生命科学学院,江西 南昌 330013;2.南昌大学生命科学与食品工程学院,江西 南昌 330029)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)的模拟表位(CDON),是从噬菌体展示随机肽库中淘选出来的七肽,可模拟DON与抗DON抗体结合。为了在酶联免疫吸附方法(enzyme linked immunosorbent assay,ELISA)中用重组蛋白替代DON偶联物,以期开发出能代替偶联DON人工抗原的无毒检测DON的ELISA方法,通过构建重组表达载体pGEX-CDON和pC89S4-CDON,并在大肠杆菌表达系统中分别表达和纯化GST-CDON和pⅧ-CDON融合蛋白,比较测定2 种融合蛋白与抗DON抗体的结合效果。ELISA方阵滴定结果显示:纯化的融合蛋白具有良好的反应原性。在间接竞争性ELISA中,当以融合蛋白GST-CDON为包被抗原时,检测限为31 ng/mL,线性范围为31~500 ng/mL,IC50为194 ng/mL,加标回收率为54.1%~65.4%,变异系数为6.28%~13.37%;当以融合蛋白pⅧ-CDON为包被抗原时,检测限为15 ng/mL,线性范围为15~500 ng/mL,IC50为94 ng/mL,加标回收率为81.7%~89.0%,变异系数为3.15%~7.55%。
脱氧雪腐镰刀菌烯醇;模拟表位;质粒;噬菌粒
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又称呕吐毒素,是一种由镰刀菌在寄主植物上生长过程中产生的雪腐镰刀菌烯醇的脱氧衍生物[1]。已有研究证明,DON对人体和动物具有多种危害,包括对基因表达的影响[2-3]、对细胞的毒性[4-5]、对胚胎的毒性[6-7]以及对免疫系统的影响[8]等。DON可广泛污染小麦和玉米等谷物,使用这些被污染的原材料加工成的食品和饲料对人类和动物的安全构成严重威胁[9]。有数据显示在北美[10]、中东非洲[11-12]、亚洲[13-14]和欧洲[15-16]等地均有DON的自然产生,可见DON的污染已经遍及全球,因此预防及检测DON的工作显得尤为紧迫。
目前常用的检测DON的方法有气相色谱法[17-18]、高效液相色谱法[19-20]和液相色谱-串联质谱法[21-22]等,但这些方法都存在操作复杂、成本高和不能进行便携性检测等问题。酶联免疫吸附剂方法(enzyme linked immunosorbent assay,ELISA)由于具有检测速度快、灵敏度高、可定量、操作简便和成本低等特点[23],是一种有希望用于方便快速检测DON的方法,但传统ELISA方法中需要使用DON标准品合成人工抗原,由于DON对人体的危害性以及其标准品价格昂贵、获取困难等原因,使得其推广使用受到限制[24]。因此开发出一种能模拟DON反应原性,以代替DON进行检测的无毒物质十分必要。DON模拟表位具有无毒和低成本的特性,为解决上述问题提供了新的思路。本实验在邓舜洲等[17]成功淘选的DON模拟表位肽(CMRPWLQ,命名为CDON)的基础上,利用质粒pGEX-4T-1和噬菌粒pC89S4,构建2种重组表达载体,表达GST-CDON融合蛋白以及展示有pⅧ-CDON融合蛋白的噬菌体颗粒,结合ELISA测定方法,验证表达的融合蛋白的反应原性,并进行加标回收实验,以期开发出DON人工抗原的替代品,并建立无毒的DON ELISA检测方法。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli)BL21(DE3)和XL1-Blue来自本实验室保存菌种;质粒pGEX-4T-1为本实验室自有,大小为4 969 bp,含有BamHⅠ和XhoⅠ酶切位点,具有氨苄青霉素抗性基因;噬菌粒pC89S4由第三军医大学万瑛教授惠赠,大小为3 469 bp,含有EcoRⅠ和BamHⅠ酶切位点,具有氨苄青霉素抗性基因;GST-resin上海点创生物科技有限公司;辣根过氧化物酶(horse radish peroxidase,HRP)标记羊抗鼠IgG 美国Sigma公司;DON抗体由南昌大学许杨教授惠赠。
LB培养基:每1 L含10 g胰化蛋白胨、5 g酵母提取物、10 g NaCl,pH 7.0。
Super Optimal broth with Catabolite Repression(SOC)培养基:每1 L含有20 g胰化蛋白胨、5 g酵母提取物、0.5 g NaCl、0.19 g KCl、3.6 g葡萄,pH 7.0。
1.2 仪器与设备
Wellwash versa洗板机、Multiskan MK3酶标仪 美国Thermo Scientific公司;Milli-Q Synthesis超纯水制备仪美国Millipore公司。
1.3 方法
1.3.1 原核表达载体pGEX-CDON及pC89S4-CDON的构建
DON模拟表位肽为CMRPWLQ,对应碱基序列TGTATGCGGCCTTGGCTTCAG。分别在其5’末端加上BamHⅠ和XhoⅠ酶切位点的4碱基黏性末端,由此设计并合成寡核苷酸单链T11和T12;另外在其5’末端分别加上EcoRⅠ和BamHⅠ酶切位点的4碱基黏性末端序列,设计并合成T13和T14。
T11:5’-GATCCTGCATGCGTCCTTGGCTCCAGC-3’
T12:5’-TCGAGCTGGAGCCAAGGACGCATGCAG-3’
T13:5’-AATTCTGCATGCGTCCTTGGCTCCAG-3’
T14:5’-GATCCTGGAGCCAAGGACGCATGCAC-3’
将T11、T12、T13和T14加dd H2O分别配成20 nmol/mL的寡核苷酸单链溶液,取T11和T12各10 μL混匀,置于PCR仪中,99 ℃保温5 min后缓慢降至室温,得到双链T11、T12,-20 ℃保存。同方法制得双链T13、T14,-20 ℃保存。取5 μL pGEX-4T-1质粒,加入11 μL dd H2O、2 μL酶切缓冲液、BamHⅠ和XhoⅠ各1 μL,混匀后37 ℃双酶切4 h,按照PCR纯化试剂盒所述步骤纯化酶切产物。取5 μL pC89S4噬菌粒同法纯化酶切产物。T11、T12与双酶切后的pGEX-4T-1在T4 DNA连接酶作用下16℃连接8 h,乙醇沉淀法纯化,连接液全量电转化入大肠杆菌BL21(DE3)感受态细胞,加入SOC培养基,37 ℃振荡培养1.5 h后涂布于含50 μg/mL氨苄青霉素(Amp)的LB平板,37 ℃过夜培养。挑取单菌落用于扩增细胞、质粒提取。提取的质粒依次用Xho Ⅰ、EcoR Ⅰ和BamH Ⅰ进行单酶切,时间3 h,之后用1.0%琼脂糖凝胶电泳观察。T13、T14与双酶切后的pC89S4在T4 DNA 连接酶作用下16℃连接8 h,乙醇沉淀法纯化,连接液全量电转化入大肠杆菌XL1-Blue感受态细胞,加入SOC培养基,37℃振荡培养1.5 h后涂布于含50 μg/mL氨苄青霉素及40 μg/mL四环素的LB平板,37℃过夜培养。挑取单菌落用于扩增细胞、质粒提取。提取的质粒依次用Xba Ⅰ、EcoRⅠ和BamHⅠ进行单酶切,时间3 h,之后用1.0%琼脂糖凝胶电泳观察。经酶切验证正确的重组质粒送上海生工测序。
1.3.2 GST-CDON融合蛋白表达及纯化
将重组质粒pGEX-CDON转化感受态BL21(DE3)后,划线接种至含50 μg/mL Amp的LB平板上,37℃倒置培养至单菌落长出,挑取单菌落接种至20 mL(50 μg/mL Amp)LB液体培养中。37℃、220 r/min培养至对数期后,按1%接种量接种至250 mL LB(50 μg/mL Amp)培养液中, OD600nm达到0.6后加入异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)至终浓度为1 mmol/L,于25℃诱导表达6 h。诱导表达后的培养液于4 ℃、5 000 r/min离心10 min,用10 mL冰上预冷过的GST裂解缓冲液重悬菌体。冰浴超声破碎细胞,超声后菌液于4 ℃、13 000 r/min离心30 min。收集上清液即为GST-CDON融合蛋白的粗提液,使用GST-resin纯化GSTCDON,用6 mL含6 mmol/L还原型谷胱甘肽的洗脱缓冲液洗脱融合蛋白,粗提液和洗脱液同时进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析,用Bradford法测定蛋白质浓度。
SDS-PAGE选用12%的分离胶和5%的浓缩胶,取10 μL样品加10 μL 2×SDS上样缓冲液,在沸水中加热3~5min后取出置于冰上冷却;加样后调节电流至10 mA,待样品接触分离胶后,调节电流至30 mA,当溴酚蓝条带迁移至距离凝胶底端约1 cm时即可停止电泳;将胶从玻璃板中取出后置于盛有染色液的培养皿中,染色1 h,倒入脱色液,1 h换液1 次,直至胶的背景清晰,凝胶成像系统拍照记录实验结果。
采用Bradford法测蛋白质质量浓度。取10支试管,0号为空白,1~6号作标准曲线,7~9为洗脱液。往各试管中分别加入0.00、0.01、0.02、0.04、0.06、0.08、0.10 mL 1.0 mg/mL的标准牛血清白蛋白(bovine serum albumin,BSA)溶液,然后补充去离子水至0.1 mL。最后往各试管中加入5.0 mL考马斯亮蓝G-250。4 min后测定各样品在595 nm波长处的吸光度,以标准蛋白质质量为横坐标、吸光度A595nm为纵坐标,绘制标准曲线,根据样品的吸光度,计算出样品的蛋白质含量。分别以纯化的20、10、5、2.5 μg/mL GST-CDON融合蛋白为包被抗原、磷酸缓冲液(phosphate buffer solution,PBS)包被为空白对照,用ELISA方法测定其与稀释度为1∶200 0的抗DON抗体的结合能力。
1.3.3 pⅧ-CDON融合蛋白表达及纯化
将重组噬菌粒pC89S4-CDON转化感受态XL1-Blue后,划线接种至含50 μg/mL Amp的LB平板,37 ℃倒置培养至单菌落长出,挑取单菌落接种至20 mL(50 μg/mL Amp)LB液体培养中。37 ℃、220 r/min培养至OD600nm为0.3,加入KM13辅助噬菌体超感染,37℃静置水浴30 min。按1%接种量接种至250 mL LB(50 μg/mL Amp)培养液中,OD600nm达到0.6后加入IPTG至终浓度为1 mmol/L,于25 ℃诱导表达6 h。诱导表达后的培养液于4℃、5 000 r/min离心10 min,收集上清液,加入总体积1/6的200 g/L聚乙二醇8000、2.5 mol/L NaCl溶液,冰浴1 h。再于4 ℃、10 000 r/min离心20 min,弃上清液,沉淀用2 mL 50 mmol/L Tris-HCl缓冲盐溶液(tris buffer saline,TBS)(pH 7.5)溶解后,加入总体积1/6的200 g/L聚乙二醇8000、2.5 mol/L NaCl溶液,冰浴1 h,于4 ℃、10 000 r/min离心20 min,弃上清液,沉淀用2 mL 50 mmol/L TBS(pH 7.5)溶解后再于4 ℃、10 000 r/min离心5 min,收集上清液。Bradford法测定蛋白质浓度,并分别以20、10、5、2.5 μg/mL纯化的pⅧ-CDON融合蛋白为包被抗原、PBS包被为空白对照,用ELISA方法测定其与稀释度为1∶2 000的抗DON抗体的结合能力。
1.3.4 ELISA方阵滴定实验
将纯化后的GST-CDON和pⅧ-CDON融合蛋白用PBS稀释至20、10、5、2.5 μg/mL,分别取100 μL加至酶标板中,0.01 mol/L的PBS作为阴性对照,于37℃恒温箱中孵育2 h。以PBS-T20为清洗液,洗板机洗板3 次,5%脱脂乳37 ℃条件下封闭1 h。PBS-T20洗板4 次,加入100 μL稀释度为1∶1 000、1∶2 000、1∶4 000、1∶8 000的抗DON抗体,于37 ℃恒温箱中孵育45 min。然后PBS-T20洗板4 次,加入100 μL 1∶3 000的HRP标记羊抗鼠IgG,37 ℃孵育45 min。接着用PBS-T20洗板5 次,3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色液显色10 min后加入50 μL 2 mol/L H2SO4终止反应,酶标仪测定其在450 nm波长处的吸光度。
1.3.5 间接竞争ELISA及标准曲线
将GST-CDON和pⅧ-CDON融合蛋白用PBS稀释至滴定好的浓度,分别取100 μL加至酶标板中,0.01 mol/L的PBS作为阴性对照,于37 ℃恒温箱中孵育2 h。使用PBS-T20洗板3 次,加入5%脱脂奶粉320 μL,于37 ℃恒温箱中封闭1 h。使用PBS-T20洗板3 次,分别加入质量浓度为1 000、500、250、125、62.5、31、25 ng/mL的DON标准品50 μL,再加入50 μL滴定至稀释度的抗DON抗体,于37 ℃恒温箱中孵育45 min。使用PBS-T20洗板4 次,加入100 μL稀释度为1∶4 000的HRP标记羊抗鼠IgG,于37 ℃恒温箱中孵育45 min。使用PBS-T20洗板5 次。TMB显色液显色10 min后加入50 μL 2 mol/L H2SO4终止反应,测定450 nm波长处的吸光度。按下式计算结合率:
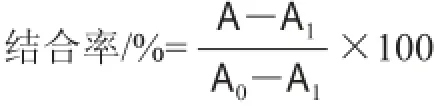
式中:A为添加有DON标准品的吸光度;A0为未加DON标准品的吸光度;A1为阴性对照的吸光度。
以DON标准品质量浓度的对数值为横坐标、以结合率为纵坐标,绘制以融合蛋白GST-CDON和pⅧ-CDON作为包被抗原的竞争ELISA标准曲线。
1.3.6 样品加标回收率的测定
称取6 份阴性玉米粉样品各5 g,添加DON标准品分别为100、200、400、800、1 600、3 200 ng/g。使用去离子水提取样品中的DON,混匀10 min。样品于10 000 r/min离心10 min后收集上清液,用已建立的间接竞争ELISA方法测定每份上清中的DON含量,每份样品重复测定3 次,计算其平均加标回收率。
2 结果与分析
2.1 原核表达载体pGEX-CDON的构建
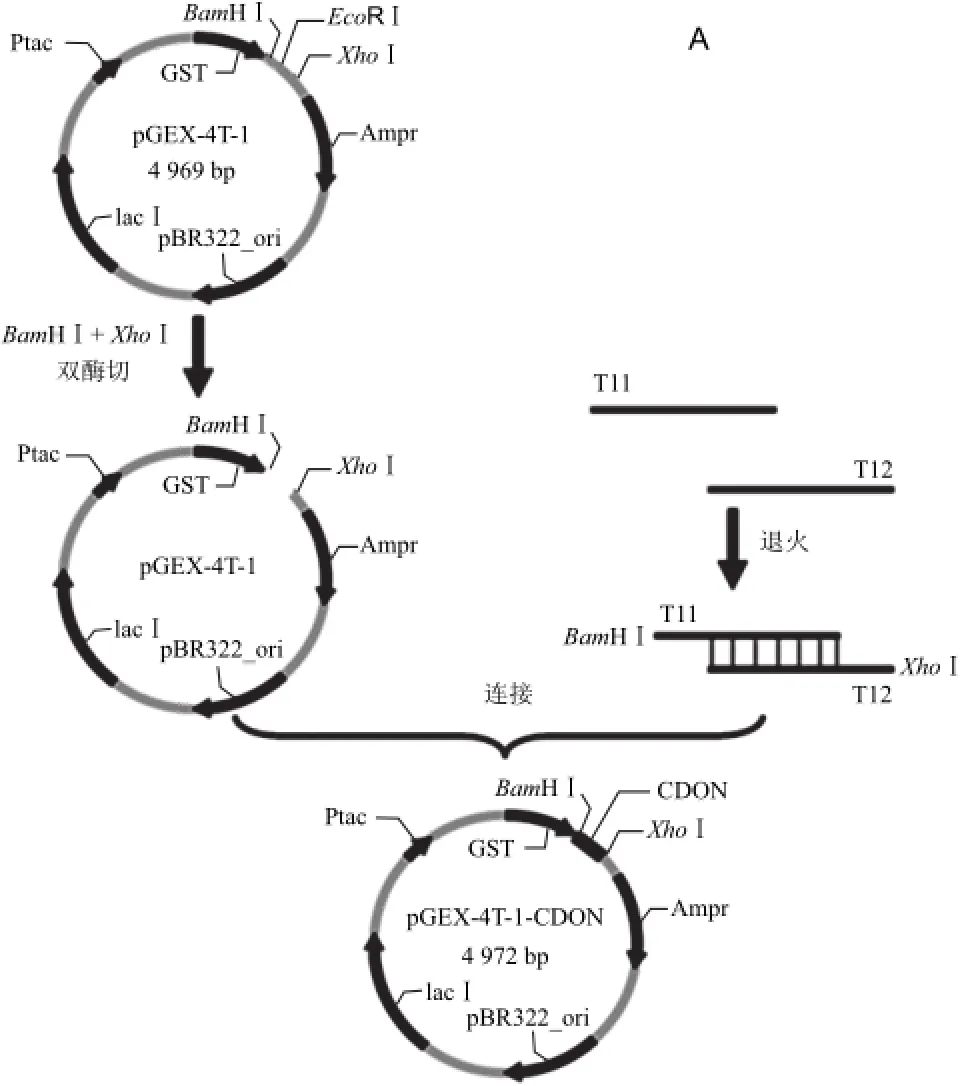
退火寡核苷酸链与质粒双酶切产物连接纯化后,电转化入大肠杆菌BL21(DE3)感受态细胞。从单菌落扩增出来的细胞中提取重组质粒后,用XhoⅠ、EcoRⅠ和BamHⅠ进行单酶切,酶切验证正确的重组质粒经过测序,结果显示其序列与预期一致,证明表达载体pGEXCDON构建成功。同理证明表达载体pC89S4-CDON构建成功。2 个重组质粒构建流程如图1所示。
2.2 GST-CDON融合蛋白表达及纯化

图2 GST-resin纯化GST-CDON融合蛋白电泳图Fig.2 SDS-PAGE analysis of the fusion protein purified by GST-resin
由图2可知,在目的蛋白出现在27 ku处,与GSTCDON的预期分子质量相符,洗脱液电泳后只有一条明显条带。经Bandscan 5.0软件分析,纯化后的融合蛋白占重组菌株中对应融合蛋白总表达量的97%,Bradford法测得蛋白质量浓度为0.37 mg/mL。ELISA实验证实纯化后的GSTCDON融合蛋白可高效地与抗DON抗体结合(图3)。
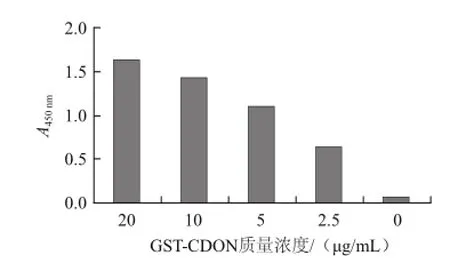
图3 GST-CDON融合蛋白与抗DON抗体的结合效果Fig.3 Binding capacity of GST-CDON with anti-DON antibody
2.3 pⅧ-CDON融合蛋白表达及纯化
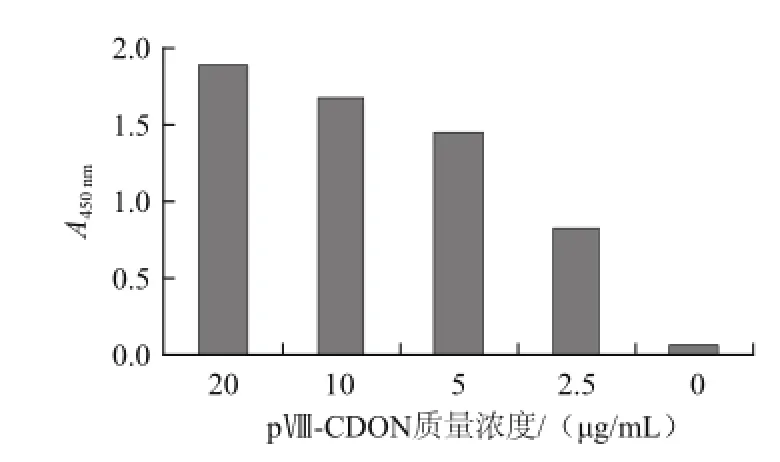
图4 pⅧ-CDON融合蛋白与抗DON抗体的结合效果Fig.4 Binding capacity of pⅧ-CDON with anti-DON antibody
经测定,纯化得到pⅧ-CDON融合蛋白质量浓度为1.02 mg/mL。经ELISA实验证实纯化后的pⅧ-CDON融合蛋白可高效地与抗DON抗体结合(图4)。
2.4 ELISA方阵滴定实验及标准曲线
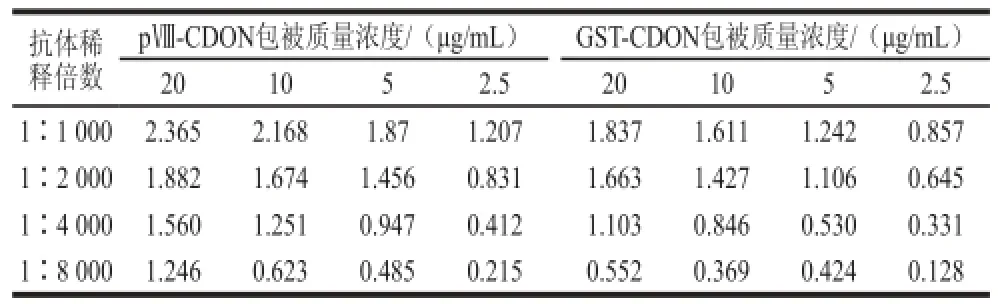
表1 ELISA方阵滴定结果Table 1 Results of checkerboard titration
由表1可知,当2 种融合蛋白的包被质量浓度均为5 μg/mL时、抗DON抗体浓度为1∶2 000时,反应的吸光度都符合间接竞争性ELISA的实验要求。2 种融合蛋白包被质量浓度相同更利于结合率及加标回收实验效果的比较。
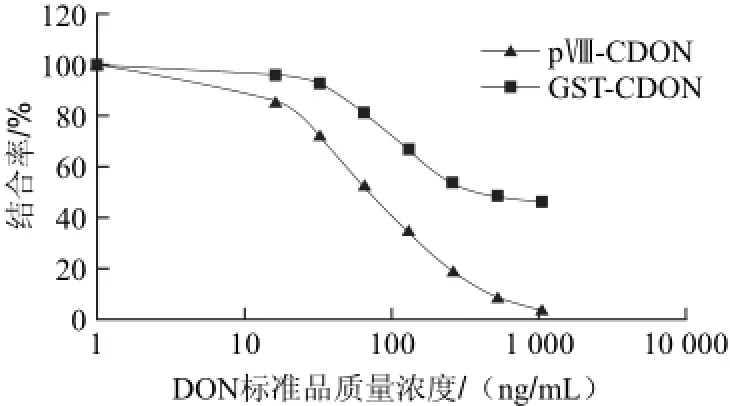
图5 间接竞争性ELISA标准曲线Fig.5 Standard curves of indirect competitive ELISA
由图5可知,当以融合蛋白GST-CDON为包被抗原时,间接竞争ELISA的检测限为31 ng/mL,线性范围为31~500 ng/mL,DON半抑制浓度(IC50)为194 ng/mL,曲线拟合回归方程为Y=112.25-9.21(lnX);当以融合蛋白pⅧ-CDON为包被抗原时,检测限为15 ng/mL,线性范围为15~500 ng/mL,IC50为94 ng/mL,曲线拟合回归方程为Y=114.16-15.79(lnX)。
2.5 加标回收率
表2 GST-CDON作为包被抗原时玉米样品DON加标回收实验结果Table 2 Recovery of DON from spiked corn detected by ELISA using GST-CDON as coating antigen
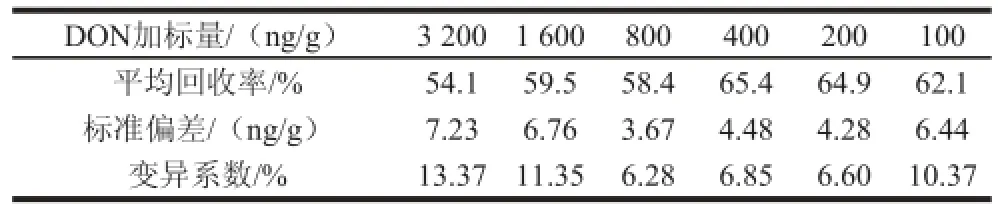
表2 GST-CDON作为包被抗原时玉米样品DON加标回收实验结果Table 2 Recovery of DON from spiked corn detected by ELISA using GST-CDON as coating antigen
DON加标量/(ng/g)3 2001 600800400200100平均回收率/%54.159.558.465.464.962.1标准偏差/(ng/g)7.236.763.674.484.286.44变异系数/%13.3711.356.286.856.6010.37
如表2所示,GST-CDON作为包被抗原时,玉米样品DON的平均回收率为54.06%~65.4%,变异系数为6.28%~13.37%。pⅧ-CDON作为包被抗原时,玉米样品DON的回收率为81.7%~89.0%,变异系数为3.15%~7.55%(表3)。DON加标量/(ng/g)3 2001 600800400200100

表3 pⅧ-CDON作为包被抗原时玉米样品DON加标回收实验结果Table 3 Recovery of DON from spiked corn detected by ELISA using pⅧ-CDON as coating antigen
3 结 论
本研究在成功构建重组质粒pGEX-CDON及重组噬菌粒pC89S4-CDON作为表达载体的基础上,成功表达了2 种融合蛋白GST-CDON和pⅧ-CDON。pGEX-4T-1载体可表达融合蛋白中的GST标签,外源蛋白与GST形成的融合蛋白可以通过偶联有谷胱甘肽的树脂和琼脂糖等材料进行纯化,本实验利用GST-resin纯化的融合蛋白纯度可达到97%。噬菌体展示技术的优势是能够将多肽的表型及其基因型建立直接对应关系,即将外源DNA通过分子克隆技术插入到适当的噬菌体载体上,使外源DNA对应的表达产物与噬菌体的衣壳蛋白融合表达。在丝状噬菌体展示系统的10 种衣壳蛋白中,表达的融合蛋白通常展示于噬菌体衣壳蛋白pⅧ或pⅢ上。pC89S4是一种噬菌粒,它是集合了质粒和丝状噬菌体的有利特征于一体的载体,带有M13和质粒的复制起始位点,在辅助噬菌体KM13的帮助下,装配成重组噬菌体颗粒。
ELISA方阵滴定结果显示表达的2 种融合蛋白具有良好的反应原性,同时滴定结果也显示,在包被质量浓度及抗体浓度相同的情况下,pⅧ-CDON融合蛋白与抗DON抗体的结合效果要优于GST-CDON。由于pⅧ蛋白在噬菌体上的拷贝数高,因此在重组噬菌体上高密度展示融合蛋白的反应原性更好,而GST-CDON融合蛋白在表达过程中容易形成包涵体,超声破碎菌体时亦会使部分蛋白失活,也降低了其反应原性。间接竞争性ELISA中,当以融合蛋白GST-CDON为包被抗原时,检测限为31 ng/mL,线性范围为31~500 ng/mL,IC50为194 ng/mL,加标回收率为54.1%~65.4%,变异系数为6.28%~13.37%;当以融合蛋白pⅧ-CDON为包被抗原时,检测限为15 ng/mL,线性范围为15~500 ng/mL,IC50为94 ng/mL,加标回收率为81.7%~89.0%,变异系数为3.15%~7.55%。由此可以得出,相比于GST-CDON,pⅧ-CDON与抗体反应的灵敏度更高、特异性也更好,但目前的研究结果显示加标回收率偏低,可能是由于融合蛋白的构象在包被和洗板的过程中有所变化,造成与抗体的结合性能改变引起的。因此拟进一步优化抗原的包被条件,并筛选稳定蛋白构象的稳定剂,在方法成熟后进行实际样品的测定和比较,以期研制出更适用于作为DON人工抗原的替代品,建立无毒素的免疫学检测方法。
参考文献:
[1] VESONDER R F, CIEGLER A, JENSEN A H. Isolation of the emeticprinciple from Fusarium-infected corn[J]. Applied Microbiology, 1973, 26(6): 1008-1010.
[2] PESTKA J J. Mechanisms of deoxynivalenol-induced gene expression and apoptosis[J]. Food Additives and Contaminants, 2008, 25(9): 1128-1140.
[3] TSUKADA J, YOSHIDA Y, KOMINATO Y, et al. The CCAAT/ enhancer (C/EBP) family of basic-leucine zipper (bZIP) transcription factors is a multifaceted highly-regulated system for gene regulation[J]. Cytokine, 2011, 54(1): 6-19.
[4] BONY S, OLIVIER-LOISEAU L, CARCELEN M, et al. Genotoxic potential associated with low levels of the Fusarium mycotoxins nivalenol and fusarenon X in a human intestinal cell line[J]. Toxicology in Vitro, 2007, 21(3): 457-465.
[5] COSSETTE F, MILLER J D. Phytoxic effect of deoxynivalenol and gibberella ear rot resistance of corn[J]. Natural Toxins, 1995, 3(5): 383-388.
[6] IVERSON F, ARMSTRONG C, NERA E, et al. Chronic feeding study of deoxynivalenol in B6C3F1 male and female mice[J]. Teratogenesis, Carcinogenesis, and Mutagenesis, 1995, 15(6): 283-306.
[7] 王加生, 徐达道. 赤霉病麦粗毒素的致畸与致突变的研究[J]. 真菌学报, 1986, 5(1): 52-62.
[8] MIKAMI O, YAMAGUCHI H, MURATA H, et al. Induction of apoptotic lesions in liver and lymphoid tissues and modulation of cytokine mRNA expression by acute exposure to deoxynivalenol in piglets[J]. Journal of Veterinary Science, 2010, 11(2): 107-113.
[9] PESTKA J J. Deoxynivalenol: mechanisms of action, human exposure, and toxicological relevance[J]. Archives of Toxicology, 2010, 84(9): 663-679.
[10] WARD T J, CLEAR R M, ROONEY A P, et al. An adaptive evolutionary shift in Fusarium head blight pathogen populations is driving the rapid spread of more toxigenic Fusarium graminearum in North America[J]. Fungal Genetics and Biology, 2008, 45(4): 473-484.
[11] RODRIGUES I, HANDL J, BINDER E M. Mycotoxin occurrence in commodities, feeds and feed ingredients sourced in the Middle East and Africa[J]. Food Additives and Contaminants: Part B, 2011, 4(3): 168-179.
[12] FATMA B, CHIRAZ Z, SALWA A, et al. Occurrence of deoxynivalenol in durum wheat in Tunisia[J]. Food Control, 2010, 21(3): 281-285.
[13] BRYDEN W L. Mycotoxins in the food chain: human health implications[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16(Suppl 1): 95-101.
[14] 熊凯华, 胡威, 汪孟娟. 安徽河南粮食中脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮的污染调查[J]. 食品科学, 2009, 30(20): 265-268.
[15] RODRIGUES I, NAEHRER K A. Three-year survey on the worldwide occurrence of mycotoxins in feedstuffs and feed[J]. Toxins, 2012, 4(9): 663-675.
[16] BINDERA E M, TANB L M, CHINB L J, et al. Worldwide occurrence of mycotoxins in commodities, feeds and feed ingredients[J]. Animal Feed Science and Technology, 2007, 137(3/4): 265-282.
[17] OK H E, CHANG H J, CHOI S W, et al. Co-occurrence of deoxynivalenol and zearalenone in cereals and their products[J]. Journal of Food Hygiene and Safety, 2007, 22(4): 375-381.
[18] 黄志兵, 游淑珠, 邓舜洲, 等. 毛细管气相色谱法测定小麦和玉米中脱氧雪腐镰刀菌烯醇[J]. 食品科学, 2007, 28(4): 241-245.
[19] SABATER-VILAR M, MALEKINEJAD H, SELMAN M H J, et al. In vitro assessment of adsorbents aiming to prevent deoxynivalenol and zearalenone mycotoxicoses[J]. Mycopathologia, 2007, 163(2): 81-90.
[20] 武爱波, 李和平, 张静柏, 等. 中国与欧洲禾谷镰刀菌DON毒素HPLC定量比较分析[J]. 应用与环境生物学报, 2007, 13(1): 131-134.
[21] 卢培成, 剡海阔, 曾振灵, 等. 猪胃组织中脱氧雪腐镰刀菌烯醇的液质联用检测[J]. 广东农业科学, 2011, 47(9): 114-116; 125.
[22] TÓTH S B, JOLANKAI R, MURANYI Z, et al. Analysis of deoxynivalenol, nivalenol, zearalenone in food by LC-APCI-MS[J]. Chromatographia, 2011, 73(1): 171-174.
[23] JI Fang, LI Hua, XU Jianhong, et al. Enzyme-linked immunosorbentassay for deoxynivalenol (DON)[J]. Toxins, 2011, 3(8): 968-978.
[24] PESTKA J J, ISLAM Z, AMUZIE C J. Immunochemical assessment of deoxynivalenol tissue distribution following oral exposure in the mouse[J]. Toxicology Letters, 2008, 178(2): 83-87.
[25] 邓舜洲, 余宙, 游淑珠, 等. 脱氧雪腐镰刀菌烯醇七肽模拟表位淘选及应用[J]. 中国公共卫生, 2006, 22(10): 1205-1206.
Application in Non-Toxic ELISA of Expression of Deoxynivalenol Mimotope Fusion Protein
XU Fu-yong1,2, MENG Wei1, LIU Ren-rong1,*, XU Ling1, QIU Xue-mei1, ZHU Li-xin1
(1. School of Life Science, Jiangxi Science and Technology Normal University, Nanchang 330013, China; 2. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330029, China)
Deoxynivalenol (DON) mimotope, designated as CDON, is a mimicking epitope (CMRPWLQ) screened from a phagedisplayed random peptide library. In order to replace DON conjugated toxin with non-toxic recombinant protein in ELISA, two novel expression vectors, which were designated as plasmid pGEX-CDON and phagemid pC89S4-CDON, were used to produce GST-CDON and pⅧ-CDON fusion proteins in E. coli. After purification, both GST-CDON and pⅧ-CDON fusion proteins showed good reactogenicity with an anti-DON antibody in a competitive inhibition ELISA test. When GST-CDON was used as coating antigen, the linear range of the competitive inhibition ELISA was 31–500 ng/mL with an IC50value of 194 ng/mL, and spiked recoveries were 54.1%–65.4%, with coefficient of variation of 6.28%–13.37%. The detection limit was 31 ng/mL. Upon using pⅧ-CDON as coating protein, the linear range of the competitive inhibition ELISA was 15–500 ng/mL with an IC50value of 94 ng/mL, and spiked recoveries were 81.7%–89.0%, with coefficient of variation of 3.15%–7.55%. The detection limit was 15 ng/mL. ELISA analysis and comparison showed that the reactogenicity and specificity of pⅧ-CDON binding to anti-DON antibody were better than that of GST-CDON fusion protein. Therefore, pⅧ-CDON is promising for establishing an ELISA without the application of the toxic mycotoxin conjugate.
deoxynivalenol; mimotope; plasmid; phagemid
Q819
A
1002-6630(2014)08-0198-06
10.7506/spkx1002-6630-201408039
2013-07-04
江西省自然科学基金项目(20122BAB214006);江西省教育厅科技项目(GJJ13573)
徐富勇(1987—),男,硕士,研究方向为生物转化与加工。E-mail:xfyong@sina.com
*通信作者:刘仁荣(1969—),男,教授,博士,研究方向为生物技术。E-mail:lilirenrong@hotmail.com
