太平洋鳕(Gadus macrocephalus)精液超低温冷冻方法的建立及精子超微结构分析*
2014-03-09韩龙江刘清华于道德官曙光纪利芹王文琪温海深
韩龙江 刘清华 于道德 官曙光 纪利芹王文琪 刘 名 温海深① 李 军①
(1.中国科学院海洋研究所 青岛 266071;2.中国海洋大学水产学院 青岛 266003;3.山东省海水养殖研究所 青岛 266002;4.青岛农业大学海洋科学与工程学院 青岛 266109)
太平洋鳕(Gadus macrocephalus)属于脊椎动物门(Vertebrata)、真骨鱼纲(Division Teleostei)、鳕形目(Gadiformes)、鳕科(Gadidae)、鳕属(Gadus),是太平洋中下层的冷水性鱼类,在我国主要分布于渤海、黄海及东海北部(高天翔等,2003)。鳕鱼是一种重要的世界性经济鱼类,近年来,由于过度捕捞、环境污染日趋严重,太平洋鳕种群遭到严重破坏,自然资源衰退严重,因此,完善鳕鱼人工繁育和养殖技术对满足鳕鱼的需求具有重要意义。
目前国内对鳕鱼的研究处于起步阶段,只有少数学者对鳕鱼的形态学进行了研究(高天翔等,2002)。而鳕鱼人工繁育方面的研究较少,有待加强。
鱼类的精子冷冻在保护物种多样性方面具有广泛的应用前景,鱼类精液的超低温冷冻保存对于提高鱼类种质、选择培育优质鱼种具有重要意义:首先可避免近亲交配,突破地理隔离,扩大杂交组合范围(于海涛等,2004);其次通过该技术可将一些濒危、名贵、优良鱼种的精液保存起来,建立鱼类精子原种库,保护鱼类的种质资源(苏天凤等,2004;陈亚坤等,2010;Chenet al,2010);此外,新鲜精液经超低温冷冻后,质量差的精子更容易被冻死,复苏的精子平均质量得到提高,提高了种群质量(Buttset al,2010)。因此,随着海水养殖业的发展,我国迫切需要建立海洋生物种质资源保护体系(张轩杰,1987),自20世纪80年代开始,我国主要在淡水鱼类精子冷冻方面(陈松林等,1992)进行了一定研究,近几年在海水鱼类精液的冷冻保存方面也取得了巨大的进展,对一些具有较高经济价值鱼类,如真鲷(Pagrus major)(Liuet al,2007)、黑鲷(Sparus macrocephalus)(叶霆等,2009)、大菱鲆(Scophamus maximus)(Chenet al,2004)、牙鲆(Paralichthys olivaceus)(Zhanget al,2003)、虹鳟(Oncorhynchus mykiss)(Pérez-Cerezaleset al,2010)、半滑舌鳎(Cynoglossus semilaevis)(田永胜等,2009)等,进行了一系列的精子超低温保存研究,而对太平洋鳕精子冷冻保存的研究未见报道。因此,本实验拟建立了太平洋鳕精子冷冻方法,并通过电子显微镜对冻精超微结构的损伤做了初步观察。
1 材料和方法
1.1 样品采集
实验所用太平洋鳕于2013年2月份在青岛近海捕获后暂养于山东省海水养殖研究所胶南增养殖站养殖车间,实验时将性腺发育良好的雄性亲鱼(体重1800—2500g)从养殖池中捞出,放置于海绵上,蒸馏水冲洗生殖孔三次,纸巾擦净,轻轻从后向前挤压腹部获得3尾雄鱼的新鲜精液约150mL,存于干净避光的离心管中,显微镜检测活力,计算机辅助精子分析(computer-assisted sperm analysis,CASA)检测运动率高于90%的样品置于冰盒中带回实验室进行冷冻保存。
1.2 实验方法
将采集的新鲜精液经稀释液稀释,选取5种不同的抗冻剂(PG(丙二醇)、DMSO(二甲基亚砜)、EG(乙二醇)、GLY(甘油)、MeOH(甲醇),DMSO 购自 SIGMA公司,其它药品均购自国药集团化学试剂有限公司)配成六个不同的浓度(8%、10%、12%、14%、16%、18%),提前一天置于4°C冰箱预冷过夜。将采集来的新鲜鳕鱼精液与冷冻保护液按1︰3的比例装入2mL的冻存管中(Liuet al,2006),4°C平衡5min使抗冻剂充分渗透进精子细胞后立即放入程序降温仪中(型号Kryo-360-1.7),以-12°C/min的降温速率从 0°C 降至-80°C,平衡5min后再以-20°C/min的降温速率降至-180°C后直接投入液氮中保存。每一实验组设三个平行,实验重复三次。
1.3 鲜精与冻精的活力测定
鲜精活力的测定:吸取 1—2μL新鲜精液在添加有 100μL10%(v/v)胎牛血清(BSA)的过滤海水中激活,显微镜检测活力,采用计算机辅助精子分析(CASA)统计精子的运动率、平均直线速度、平均曲线速度、平均圆周速度等指标(刘清华等,2006)。
冻精活力的测定:将存有精液的冻存管直接放入 37°C水浴中解冻 100—110s,然后置于室温(18—20°C)条件下完全融化,在添加有 10%(v/v)BSA 的过滤海水中激活。具体操作为向载玻片中滴入 100μL海水,然后加入1—2μL冻精,吸打3—5次使其充分混匀,随机取6个视野,检测运动精子的数量占视野中所有精子总数的比例,采用CASA统计精子的运动率、平均直线速度、平均曲线速度、平均圆周速度等指标(刘清华等,2006)。运动率是指解冻后精子与激活液(添加有10%BSA的过滤海水)混合后立即于光学显微镜(型号 Nikon-YS-100)下观察同一视野中运动精子数量占全部精子的百分比。
1.4 鲜精与冻精的超微结构观察
扫描电镜(scanning electron microscope,SEM)观察:取鲜精与冻融精液,用 2.5%的戊二醛(4°C)固定24h,经磷酸缓冲液(0.2mol/L,pH=7.4)漂洗后,用1%锇酸(4°C)固定 2h,然后依次经梯度酒精脱水、醋酸异戊脂置换、离子镀膜等步骤后,于日本电子株式会社(JEOL公司)的JSM-840型扫描电镜下观察、拍照。
透射电镜(transmission electron microscopy,TEM)观察:取鲜精与冻融精液,用 2.5%戊二醛(0.2mol/L,pH=7.4,磷酸缓冲液配制)进行前固定,然后用 1%锇酸(4°C)固定 2h,梯度酒精脱水,然后用 Epon-812渗透包埋,超薄切片机切片,经醋酸铀和柠檬酸铅双重染色后透射电镜(日立H-7000)下观察、拍照。
1.5 数据处理
实验数据分析采用SPSS17.0软件进行单因素方差(One-Way ANOVA)分析,比较实验结果差异显著性,结果以平均值±标准差表示,多重比较采Duncan法。
2 结果
2.1 添加剂蛋黄对精子运动率的作用
在PG和DMSO中添加蛋黄对精子运动率的影响分别见图1和图2。由图1可以看出,在各浓度下,添加蛋黄后的 PG精子运动率显著高于未添加蛋黄的PG(P<0.05),且在 12%浓度下达到最大值,与其余各组差异显著(P<0.05)。由图2可以看出,8%浓度下,DMSO 组精子运动率高于(DMSO+蛋黄)组,但无显著差异(P>0.05);在 10%、14%、16%、18%浓度下,(DMSO+蛋黄)组精子运动率高于 DMSO 组,且在10%、16%、18%浓度下有显著性差异(P<0.05),在14%浓度下无显著性差异(P>0.05);12%浓度下,DMSO 组精子运动率高于(DMSO+蛋黄)组,且差异显著(P<0.05);综合比较可知,各组中的精子运动率在 10%浓度下的(DMSO+蛋黄)组达到最大值,且与其余各组差异显著(P<0.05)。
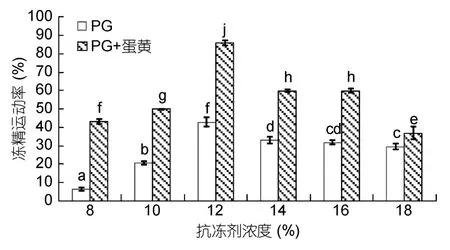
图1 添加蛋黄的丙二醇对精子运动率的影响Fig.1 Effect of adding yolk into propylene glycol on motility ofGadus macrocephalus sperm

图2 添加蛋黄的二甲基亚砜对精子运动率的影响Fig.2 Effect of adding yolk into dimethyl sulfoxide on motility of G.macrocephalus sperm

图3 不同抗冻剂不同浓度下精子的运动率Fig.3 Motility of G.macrocephalus sperm in different cryoprotectants at different concentrations
2.2 抗冻剂种类和浓度对运动率的影响
不同种类的抗冻剂对太平洋鳕精子运动率的影响见图3(MeOH实验组精子解冻后基本全部死亡,故没有数据)。由图3可知,在8%、12%、14%、16%、18%浓度下,(PG+蛋黄)组太平洋鳕冻鱼精运动率显著高于其他实验组(P<0.05)。在10%浓度下,(DMSO+蛋黄组)太平洋鳕冻精运动率显著高于其他实验组(P<0.05)。分别将六个浓度下运动率最高的实验组进行差异性比较,即浓度为8%、12%、14%、16%、18%的(PG+蛋黄)组与 10%浓度的(DMSO+蛋黄)组相比,12%浓度下的(PG+蛋黄)组中冻精运动率达到最大值85.87%±1.6%,显著高于其他实验组(P<0.05)。
2.3 抗冻剂种类和浓度对精子活力的影响
不同种类的抗冻剂对太平洋鳕冻精平均直线速度的影响见图4:8%浓度下,(GLY+蛋黄)组精子平均直线速度显著高于其他实验组(P<0.05);10%浓度下,(DMSO+蛋黄)组精子平均直线速度高于其他实验组,与(PG+蛋黄)组、(EG+蛋黄)组差异显著(P<0.05),但与鲜精、(DMSO+蛋黄)组差异不显著(P>0.05);12%浓度下,(DMSO+蛋黄)组精子平均直线速度显著高于其他实验组(P<0.05);14%浓度下,(PG+蛋黄)组精子平均直线速度显著高于其他实验组(P<0.05);16%浓度下,鲜精实验组精子平均直线速度高于其他实验组,与(PG+蛋黄)、(EG+蛋黄)、(GLY+蛋黄)组差异显著,但与(DMSO+蛋黄)组差异不显著(P>0.05);18%浓度下,鲜精实验组精子平均直线速度显著高于其他实验组(P<0.05)。分别将六个浓度下精子平均直线速度最大的实验组进行差异性比较,即8%(GLY+蛋黄)、10%(GLY+蛋黄)、18%(GLY+蛋黄)、12%(DMSO+蛋黄)、14%(PG+蛋黄)、鲜精相比,12%(DMSO+蛋黄)精子平均直线速度达到最大值(120.39±20.78)μm/s,显著高于其他实验组(P<0.05)。

图4 不同抗冻剂不同浓度下精子的平均直线速度Fig.4 Average linear velocity of G.macrocephalus sperm in different cryoprotectants at different concentrations
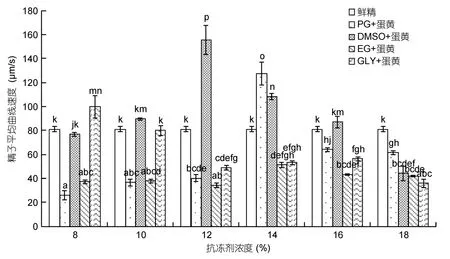
图5 不同抗冻剂不同浓度下精子的平均曲线速度Fig.5 Average curve velocity of G.macrocephalus sperm in different cryoprotectants at different concentrations
不同种类的抗冻剂对太平洋鳕冻精平均曲线速度的影响见图5:8%浓度下,(GLY+蛋黄)组精子平均曲线速度显著高于其他实验组(P<0.05);10%浓度下,(DMSO+蛋黄)组精子平均曲线速度高于其他实验组,与(PG+蛋黄)组、(EG+蛋黄)组差异显著,但与鲜精、(GLY+蛋黄)组差异不显著(P>0.05);12%浓度下,(DMSO+蛋黄)组精子平均曲线速度显著高于其他实验组(P<0.05);14%浓度下,(PG+蛋黄)组精子平均曲线速度显著高于其他实验组(P<0.05);16%浓度下,(DMSO+蛋黄)组精子平均曲线速度高于其他实验组,与(PG+蛋黄)、(EG+蛋黄)、(GLY+蛋黄)组差异显著,且与鲜精差异不显著(P>0.05);18%浓度下,鲜精实验组精子平均曲线速度显著高于其他实验组(P<0.05)。分别将六个浓度下精子平均曲线速度最大的实验组进行差异性比较,即 8%(GLY+蛋黄)、10%(DMSO+蛋黄)、12%(DMSO+蛋黄)、16%(DMSO+蛋黄)、14%(PG+蛋黄)、鲜精六组相比,12%(DMSO+蛋黄)精子平均曲线速度最大(155.64±12.02)μm/s,显著高于其他实验组(P<0.05)。
不同种类的抗冻剂对太平洋鳕冻精平均路径速度的影响见图6:8%浓度下,(GLY+蛋黄)组精子平均路径速度显著高于其他实验组(P<0.05);10%、12%浓度下,(DMSO+蛋黄)组精子平均路径速度显著高于其他实验组(P<0.05);14%浓度下,(PG+蛋黄)组精子平均直线速度显著高于其他实验组(P<0.05);16%、18%浓度下,鲜精实验组精子平均路径速度显著高于其他实验组(P<0.05)。分别将六个浓度下精子平均路径速度最大的实验组进行差异性比较,即 8%(GLY+蛋黄)、10%(DMSO+蛋黄)、12%(DMSO+蛋黄)、14%(PG+蛋黄)、16%鲜精、18%鲜精六组相比,12%(DMSO+蛋黄)精子的平均路径速度最大(157.43±6.02)μm/s,显著高于其他实验组(P<0.05)。

图6 不同抗冻剂不同浓度下精子平均路径速度Fig.6 Average path velocity of G.macrocephalus sperm in different cryoprotectants at different concentrations
2.4 太平洋鳕鲜精及冻精的超微结构
通过扫描电镜和透射电镜观察新鲜和冻融后的鳕鱼精子发现,鲜精中 75.5%精子形态结构正常,24.5%精子形态结构异常;运动率最高的冻精中 67%精子形态结构正常,33%精子形态结构异常。
2.4.1 扫描电镜观察结构正常和异常的精子 扫描电镜观察结构正常的太平洋鳕精子:由头部、中段和尾部组成,头部扁圆略呈梭型,长约 2μm,宽约 1μm,形态正常无膨胀,中段不明显,线粒体部分位于精子头部和鞭毛连接处,形态完整,鞭毛细长无断裂,长约 18.0μm,质膜与核膜结构完整(图7A—D)。
扫描电镜观察太平洋鳕精子结构异常,主要表现在精子头部、线粒体和鞭毛的变化上。精子头部结构异常主要体现在:精子头部破裂,表面褶皱不平滑,胞膜破损变形,细胞质流失,细胞脱水皱缩,细胞器分散(图7E,G),线粒体结构异常主要体现在线粒体脱落、移位(图7H)等。鞭毛结构异常主要体现在鞭毛脱落、折断(图7F)。
2.4.2 透射电镜观察结构正常和结构异常的精子透射电镜观察发现,正常精子头部中央是袖套腔,后端为袖套,细胞核致密,呈卵椭圆形,核长径约5μm。核染色质密集,染色较深(图8A,C)。核泡位于核内相对疏松、染色较浅的区域,靠近鞭毛有排列不规则且不在同一平面的线粒体(图8D),精子尾部有细长的鞭毛,由9组二联微管构成,中央有一对微管,为典型的“9+2”微管结构(图8H)。精子质膜与核膜结构完整,嵴发达(图8B)。
透射电镜观察发现核内部结构异常主要表现在:核膜脱落、间断、局部破裂、皱缩(图8E,F),核局部受损、染色质变松散、颜色变浅(图8E);线粒体结构异常表现为:内部结构弥散、线粒体破裂、嵴膜破损(图8G);鞭毛结构异常主要表现为被膜破裂、皱缩(图8H)。

图7 太平洋鳕精子扫描电镜观察Fig.7 SEM image showing ultrastructure of spermatozoa of G. macrocephalus
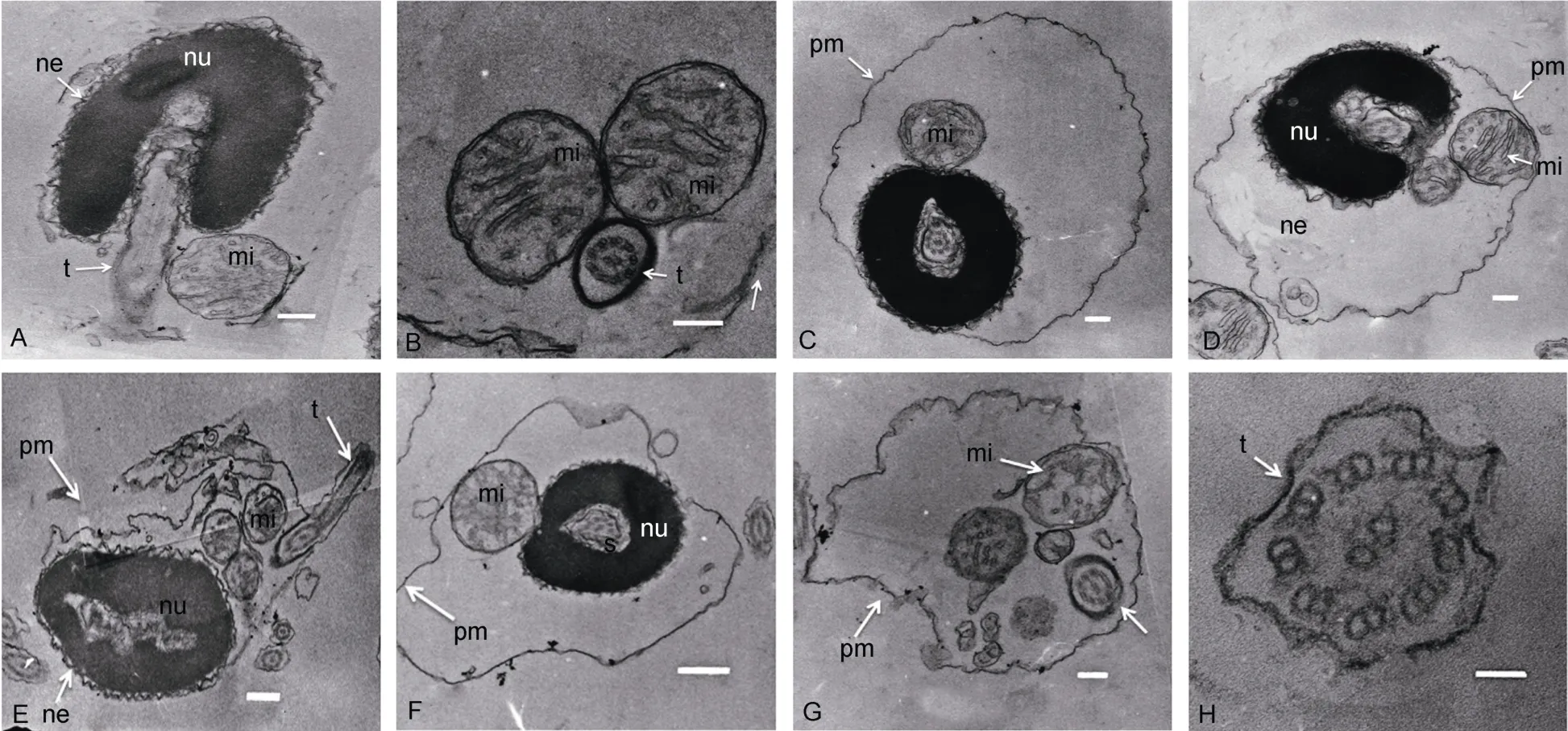
图8 太平洋鳕精子透射电镜观察Fig.8 TEM image showing ultrastructure of spermatozoa of G.macrocep halus
3 讨论
3.1 添加剂蛋黄对精子冷冻的影响
添加剂在精子冷冻保存过程中起着重要作用,其主要功能是保护精细胞膜不受损伤,减少抗冻剂的毒性,延长精子的保存期限等。最常见的添加剂有二糖(海藻糖,蔗糖,葡萄糖)、微量添加剂(维生素、抗生素)、血清以及蛋黄等。蛋黄作为外部渗透的化合物,在冷冻或解冻过程中起到防止质膜损坏的作用。在大西洋鳕(Gadus morhua)(Buttset al,2010)精子冷冻过程中,用含有蛋黄的 PG做抗冻剂,冻融后精子具有最高的运动率。在太平洋鳕精子冷冻方法的筛选中,本研究结果表明,以蛋黄作为添加剂,PG为抗冻剂,与没有添加蛋黄的PG抗冻剂相比能够显著提高太平洋鳕精子冷冻保存效果,以蛋黄为添加剂的抗冻剂 DMSO与没添加蛋黄的抗冻剂的 DMSO在10%、16%、18%浓度下相比,冷冻保存效果显著提高(P<0.05)。所以,由本实验数据可以得出结论:选择蛋黄作为添加剂能显著提高太平洋鳕的精子冷冻保存效果,这与其他不同鱼类精子冷冻保存中,添加蛋黄能够显著提高精子冷冻保存的效果相一致。由于蛋黄中含有丰富的胆固醇、磷脂等物质,与精子细胞膜结构组成物质相类似,作为一种细胞外的添加剂,能够显著升高细胞外溶质的浓度,减少溶质深入细胞的量,以降低溶质损伤的程度。另外,蛋黄作为一种天然优良的抗冻添加剂,毒性小,冷冻前可以使细胞大量脱水,增加总的抗冻剂浓度,可在冷冻时缓解细胞内冰晶的形成。
3.2 抗冻剂种类和浓度对精子活力的影响
抗冻保护剂主要是通过渗入精子细胞,调节精子细胞渗透压,降低精子的冰点,以减少冰晶损伤的方式起到保护精子的作用(陈松林等,2002)。不同鱼类的最适抗冻保护剂种类不同(Comizzoliet al,2012),常用的抗冻保护剂主要有GLY、DMSO、EG、PG、MeOH、二甲基乙酰胺(MDA)(陈松林等,1992;李纯等,2000;汪小锋等,2003;Groisonet al,2010;Daiet al,2012)等。抗冻保护剂浓度亦是影响精液冷冻保存的一个重要因素,抗冻保护剂对鱼类贝类精子会产生一定毒性(杨爱国等,1999;陈松林等,2007)。
本实验通过对 GLY、PG、DMSO、EG、MeTH五种抗冻剂的筛选发现:稀释液加蛋黄的 12%PG为抗冻剂,通过分步降温法超低温冻存的太平洋鳕精子在解冻后精子运动率最高;添加蛋黄的12%DMSO为抗冻剂,通过分步降温超低温保存的太平洋鳕精子其精子运动速率最快。Butts等人(2010)在大西洋鳕精液冷冻过程中发现10%的PG对大西洋鳕精子冷冻效果最好,解冻后精子运动率最高;DeGraaf等(2004)冷冻保存黑线鳕(Melanogrammus aeglefinus)、大西洋鳕精子时发现PG对这两种鳕鱼精子冷冻保存效果最好。分类地位相近的鱼类,其精子大小、结构和组成成分都很相似,所以其在冷冻保存中会有很多共同之处,可以相互借鉴。本实验借鉴了与太平洋鳕同属的大西洋鳕、狭鳕(Theragra chalcogrammaPallas)、黑线鳕等成熟的冷冻方法(Rideoutet al,2004),得到了与这几种鳕鱼相近的结果。从实验结果可以看出,12%PG作为保护剂的精子具有最高的激活率,而12%DMSO作为抗冻剂对保持精子的运动速率有一定作用。12%PG和 12%DMSO作为抗冻剂,是两种渗透性的小分子物质,渗透速度快,其主要作用是渗入精子细胞内部,发生水合作用结合水分子,使溶液的黏性增加,弱化水的结晶过程,以保护精子不受冷冻损伤。其使用的浓度、渗入细胞的能力、对水分子活性的影响各不相同。12%PG和12%DMSO在太平洋鳕的冷冻过程中,能够有效地冲淡溶质的浓度,降低冰点,防止大冰晶的产生,以避免冷冻和解冻过程中细胞肿胀死亡。
3.3 抗冻剂种类和浓度对精子运动速度的影响
精子的运动率与卵子的受精率存在一定的相关性,精子运动速率是评价精子质量的一个重要的指标,采用CASA检测精子质量的方法已广泛应用于受精生物学的研究中(柳凌等,2007),CASA主要用于分析精子激活后精子平均直线速度、平均曲线速度、平均路径速度等指标,能够方便、快捷的统计分析精子运动状态,以评价精子质量(Liuet al,2007;Daiet al,2012)。实验采用 CASA检测新鲜和冻融后太平洋鳕精子发现,冻存精子的运动速度大部分低于新鲜精子,但亦有个别实验组冻融后精子速度明显高于鲜精。Butts等(2011)在冷冻大西洋鳕鱼精子发现,冷冻过程中质量差的精子被冻死,质量好的精子存活了下来,精子冷冻保存提高了精子的质量。由于CASA分析的是视野中所有精子的平均运动速率,因此,本实验中,由于活力差、运动速率慢的精子死亡,存活下来的精子质量提高导致了精子平均运动速度的提高。精子的运动主要是由鞭毛系统控制的,鞭毛含有ATP酶,提供了精子运动的动力,诱导精子运动主要与离子浓度、pH和渗透压有关。太平洋鳕精子冷冻过程中发现部分鞭毛结构受损,导致主要起动力作用的双联微管的结构受损,最终导致运动速率的下降,抗冻剂种类和浓度的不同,对精子鞭毛结构的保护作用不同造成了解冻后精子运动速率的差异。
3.4 太平洋鳕鲜精及冻精的超微结构
在超低温冷冻保存过程中因温度的急剧变化使精子易受冰晶的损伤,影响冻融精子运动率。在一些鱼类精子超低温冷冻保存的研究中发现,精子超微结构的变化主要表现为生理特性的变化(Billard,1983;Chenet al,2010)与结构的损伤(汪小锋等,2003;)。本研究超低温保存太平洋鳕精子表明:超低温冷冻细胞膜、线粒体和鞭毛均造成不同程度的破坏,具体包括细胞膜破裂,线粒体脱落、变形,鞭毛断裂等,与其他学者在冷冻保存其他物种精子时造成的结构损伤基本一致。例如有研究显示,低温冷冻对精子结构产生了明显的损害(程顺等,2013),较为常见的精子形态异常现象变化包括:精子质膜的变化,如膨胀或破损;核的变化,如核膜消失,染色质解体,DNA损伤(Cabritaet al,2005;Junet al,2006;魏平等,2010);细胞器的损伤,如线粒体膨胀破损、轴丝断裂(王小刚等,2013)。太平洋鳕精子冷冻过程中细胞膜的损伤,破坏了精子正常的生理结构,导致精子功能紊乱,这与章龙珍等(2008)冷冻鲟鱼过程中造成膜蛋白脱落,导致细胞内环境改变,精子细胞膜发生膜脂晶格化,使精子细胞功能紊乱,进而影响精子活力和受精率孵化率的结果相一致。线粒体和鞭毛在精子运动过程中起着重要作用,线粒体提供能量,促使鞭毛摆动(杨爱国等,1999)。精子激活后,精子依靠尾部鞭毛的摆动而运动。在超低温冷冻太平洋鳕精子时发现,鞭毛结构发生了不同程度的损伤多发生于中段,如鞭毛破裂、折断、打结、皱缩等。本研究认为,超低温冷冻和升温过程中,由于精细胞鞭毛中段结合处膜结构比较脆弱,在冷冻过程中易受到损伤,超低温冷冻、解冻过程容易导致该段受到损伤,这与冻精扫描电镜鞭毛损伤、盘绕、折断多发生于中段相一致。精子鞭毛结构的损伤最终导致精子细胞运动速率的下降,进而影响了卵子的受精率。
目前,人们对精子冷冻损伤机制的本质尚未了解透彻,精子的低温损伤机制需要更深入的研究,电子显微镜在精子超低温保存技术中的应用,推动了精子超低温冷冻损伤的研究。
本研究结果建立了太平洋鳕精子冷冻的方法;对解冻后精子质量进行了全面细致的分析;并且第一次详细描述了冷冻保存对太平洋鳕精子超微结构的影响。这一研究将有助于太平洋鳕以及其他鳕鱼冷冻保存技术的完善与提高。
于海涛,张秀梅,陈 超等,2004.鱼类精液超低温冷冻保存的研究展望.海洋湖沼通报,66(2):66—72
王小刚,骆 剑,尹绍武等,2013.点带石斑鱼的精子活力及超低温冷冻前后精子超微结构的比较.海洋科学,37(2):70—75
叶 霆,竺俊全,杨万喜等,2009.黑鲷精子的超低温冻存及DNA损伤的SCGE检测.动物学研究,30(2):151—157
田永胜,陈松林,季相山等,2009.半滑舌鳎精子冷冻保存.渔业科学进展,30(6):97—102
刘清华,李 军,丁福红等,2006.运用计算机辅助分析检测超低温保存的真鲷(Pagrus major)精子的质量.自然科学进展,16(9):1181—1185
苏天凤,艾 红,2004.鱼类精子活力及其超低温保存研究综述.上海水产大学学报,13(4):343—347
李 纯,李 军,薛钦昭等,2000.海洋生物种质细胞低温保存与机理.海洋科学,24(4):12—15
杨爱国,王清印,孔 杰等,1999.扇贝精液超低温冷冻保存技术的研究.海洋与湖沼,30(6):624—628
汪小锋,樊廷俊,2003.鱼类精子冷冻保存的研究进展.海洋科学,27(7):28—31
张轩杰,1987.鱼类精液超低温冷冻保存研究进展.水产学报,9(3):259—267
陈亚坤,刘清华,赵春彦等,2010.长期超低温保存后真鲷精子的质量变化.海洋科学,34(6):50—54
陈松林,2002.鱼类配子和胚胎冷冻保存研究进展及前景展望.水产学报,26(2):161—168
陈松林,2007.鱼类精子和胚胎冷冻保存理论与技术.北京:中国农业出版社,31
陈松林,刘宪亭,鲁大椿等,1992.鲢、鲤、团头鲂和草鱼精液冷冻保存的研究.动物学报,38(4):413—424
柳 凌,OTOMARLinhart,危起伟等,2007.计算机辅助对几种鲟鱼冻精激活液的比较.水产学报,31(6):711—720
高天翔,张肖荣,王 丹等,2003.几种鳕鱼的生物学初步研究.海洋湖沼通报,35(1):35—42
高天翔,武云飞,张秀梅等,2002.四种鳕鱼的形态学研究.青岛海洋大学学报(自然科学版),32(6):884—890
章龙珍,刘 鹏,庄 平等,2008.超低温冷冻对西伯利亚鲟精子形态结构损伤的观察.水产学报,32(4):558—565
程 顺,闫家强,竺俊全等,2013.大黄鱼(Pseudosciaena crocea)精子冷冻前后的活力及超微结构变化.海洋与湖沼,44(1):56—61
魏 平,竺俊全,闫家强等,2010.真鲷精子的超低温冻存及DNA损伤的检测.水生生物学报,34(5):1049—1055
Billard R,1983.Ultrastructure of trout spermatozoa:Changes after dilution and deep-freezing.Cell and Tissue Research,228(2):205—218
Butts I A E,Babiak I,Ciereszko Aet al,2011.Semen characteristics and their ability to predict sperm cryopreservation potential of Atlantic cod,Gadus morhuaL.Theriogenology,75(7):1290—1300
Butts I A E,Litvak M K,Kaspar Vet al,2010.Cryopreservation of Atlantic codGadus morhuaL.spermatozoa:Effects of extender composition and freezing rate on sperm motility,velocity and morphology.Cryobiology,61(2):174—181
Cabrita E,Robles V,Rebordinos Let al,2005.Evaluation of DNA damage in rainbow trout(Oncorhynchus mykiss)and gilthead sea bream(Sparus aurata)cryopreserved sperm.Cryobiology,50(2):144—153
Chen Y K,Liu Q H,Li Jet al,2010.Effect of long-term cryopreservation on physiological characteristics,antioxidant activities and lipid peroxidation of red seabream(Pagrus major)sperm.Cryobiology,61(2):189—193
Chen S L,Ji X S,Yu G Cet al,2004.Cryopreservation of sperm from turbot(Scophthalmus maximus)and application to large-scale fertilization.Aquaculture,236(1):547—556
Comizzoli P,Songsasen N,Hagedorn Met al,2012.Comparative cryobiological traits and requirements for gametes and gonadal tissues collected from wildlife species.Theriogenology,78(8):1666—1681
Dai T R,Zhao E H,Lu Get al,2012.Sperm cryopreservation of yellow drumNibea albiflora:A special emphasis on post-thaw sperm quality.Aquaculture,368(1):82—88
DeGraaf J D,Berlinsky D L,2004.Cryogenic and refrigerated storage of Atlantic cod(Gadus morhua)and haddock(Melanogrammus aeglefinus)spermatozoa.Aquaculture,234(1):527—540
Groison A L,Suquet M,Cosson Jet al,2010.Sperm motility in European hake,Merluccius merluccius,and characterization of its spermatozoa concentration and volume,spermatocrit,osmolality and pH.Aquaculture,301(1):31—36
Jun L,Qinghua L,Shicui Z,2006.Evaluation of the damage in fish spermatozoa cryopreservation.Chinese Journal of Oceanology and Limnology,24(4):370—377
Liu Q H,Li J,Xiao Z Zet al,2007.Use of computer-assisted sperm analysis(CASA)to evaluate the quality of cryopreserved sperm in red seabream(Pagrus major).Aquaculture,263(1):20—25
Liu Q H,Li J,Zhang S Cet al,2006.An efficient methodology for cryopreservation of spermatozoa of red seabream,Pagrus major,with 2-mL cryovials.Journal of the World Aquaculture Society,37(3):289—297
Pérez-Cerezales S,Martínez-Páramo S,Beirão Jet al,2010.Evaluation of DNA damage as a quality marker for rainbow trout sperm cryopreservation and use of LDL as cryoprotectant.Theriogenology,74(2):282—289
Rideout R M,Trippel E A,Litvak M Ket al,2004.The development of haddock and Atlantic cod sperm cryopreservation techniques and the effect of sperm age on cryopreservation success.Journal of Fish Biology,65(2):299—311
Zhang Y Z,Zhang S C,Liu X Zet al,2003.Cryopreservation of flounder(Paralichthys olivaceus)sperm with a practical methodology.Theriogenology,60(5):989—996
