黄花水龙化感物质对铜绿微囊藻生长及藻毒素产生和释放的影响*
2014-03-09叶金云
吴 湘 吴 昊 叶金云
(1.浙江省水生生物资源养护与开发技术研究重点实验室 湖州师范学院生命科学学院 湖州 313000;2.湖州市环境保护监测中心站 湖州 313000)
由富营养化引起的水华作为一种全球性环境问题,近年来受到人们越来越多的关注(de Figueiredoet al,2004),利用水生植物产生的次生代谢物质(化感物质)控制藻类水华已成为水环境研究领域的前沿和热点课题( 啟鲜 鸣等,2005;胡洪营等,2006)。这是一种高效、安全、简便的生物抑藻技术,具有抑藻作用强、成本低、材料天然易得、无二次污染等优点。化感物质通常在自然条件下易降解,在生态系统中不会积累,对特定的藻类具有显著的抑制作用。因此,从水生植物中提取化感物质施入水体进行藻类控制研究具有重要的环境和生态意义。
鉴于多数水华藻种均能产生一定量的藻毒素(Coddet al,2005),因此在利用水生植物化感物质进行藻类控制研究的过程中,化感物质的生态安全性即其对含毒藻种产生和释放藻毒素的影响规律同样值得研究和关注。根据Jones等(1994)的研究发现,在利用有机鳌合铜类的化学杀藻剂抑制铜绿微囊藻生长过程中,水体中的微囊藻毒素(MC-LR)含量明显上升,维持14天后才因微生物的降解作用而被逐渐减低。因此,利用化学杀藻剂抑制产毒藻细胞生长极易产生水质安全隐患,而利用水生植物的化感物质进行藻类水华控制是否会引发同样的安全问题也必须得到应有的重视和关注,但是目前相关方面的研究十分有限,仍有待系统、全面地研究。
本试验的研究对象为经作者前期研究(吴湘等,2007)发现的高效脱氮除磷的水生浮叶植物黄花水龙(Jussiaea stipulaceaOhwi),它具有适应性强、生物量大、次生代谢物质丰富等特点,通过分离提取其中的化感物质进行藻类控制研究具有良好的应用前景。由于半数以上的水华藻种都能够产生藻毒素,且铜绿微囊藻又是最为常见的水华优势藻种(Chenet al,2004;王欣伊等,2005),因此本试验选用铜绿微囊藻(FACHB-905)为受试藻类,以蓝藻毒素中最为常见、毒性最大的微囊藻毒素(MC-LR)为代表。通过研究黄花水龙化感物质对铜绿微囊藻生长的抑制作用,确定其最佳抑藻浓度范围,同时阐明黄花水龙化感物质对铜绿微囊藻藻细胞内外MC-LR产生或释放的影响规律,从而为水生植物化感物质在实际抑藻应用时的有效量化及其生态安全性评价提供一定的科学借鉴和参考。
1 材料与方法
1.1 实验材料
黄花水龙采自浙江省湖州市乡村河道,采集时间为7月上旬,选取个体均匀、生长良好的植株,全株洗净后于60°C烘箱干燥48h,备用。实验所用铜绿微囊藻(FACHB-905)购自中国科学院水生生物研究所淡水藻种库,实验前使用BG-11培养基(李锋民等,2007)预培养7—8d,使之处于对数生长期。
1.2 实验设置与方法
1.2.1 黄花水龙化感物质的提取 称取 20g黄花水龙干植物体(粉碎至50目),置于500mL锥形瓶中,加入400mL乙酸乙酯,超声波常温提取1h。提取结束后,用滤纸滤去提取液中的残渣,并通过 0.22μm有机系滤膜除去颗粒物的干扰,之后利用旋转蒸发(100r/min,65°C)除去溶剂,获得浸膏并称重,最后用二甲基亚砜(DMSO)进行定容溶解,使得最高浓度组DMSO浓度小于1%,此浓度对铜绿微囊藻生长无影响(洪喻等,2008)。浓缩液在无菌条件下,通过0.22μm 无菌有机系滤膜除去微生物,于 4°C冰箱保存备用。
1.2.2 黄花水龙化感物质的抑藻活性检测及最佳抑藻浓度范围的确定 采用培养液检测法,通过摇瓶实验对黄花水龙化感物质进行抑藻活性检测,并确定其最佳抑藻浓度范围。将总体积为 200mL的藻类培养混合液(含5mL处于对数生长期的藻种液、一定量的经121°C高温灭菌30min的 BG-11培养液以及黄花水龙的化感物质)加入500mL锥形瓶中,其中黄花水龙化感物质设置为5个浓度梯度,分别为0、25、50、75、150mg/L,每个浓度设 3个平行。将上述混合培养液置于温度25°C,相对湿度70%,光照强度 50μmol/(m2·s),光暗比 14h︰10h的人工气候室中培养 16d,每天通过显微镜计数法测定藻细胞密度,平行计3次,结果取均值。最后采用概率单位法拟合计算黄花水龙化感物质的半效应质量浓度(EC50,7d),该数值越低,说明其抑藻效果越好。
1.2.3 黄花水龙化感物质对MC-LR产生和释放的影响测定 在 1.2.2实验的基础上,分别测定培养对数期(7d)和稳定期(16d)时胞外培养液和藻细胞中的MC-LR含量以及藻细胞密度。采用固相萃取(SPE)联合高效液相色谱(HPLC)法测定微囊藻毒素MC- LR的含量。在进行MC-LR的HPLC测定前,先将待测的铜绿微囊藻培养液参照宋立荣等(1999)方法进行预处理。
1.3 数据处理方法
根据藻密度计算黄花水龙化感物质对藻细胞的相对抑制率:
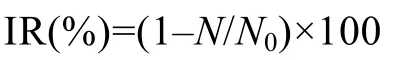
其中IR为相对抑制率,N为加入化感物质组的藻密度(ind./mL),N0为对照组的藻密度(ind./mL)。采用概率单位法拟合计算EC50,7d。所有样品平行测定3次,实验结果取其均值。利用Excel进行数据分析和绘图。
2 结果与讨论
2.1 黄花水龙化感物质对铜绿微囊藻(FACHB-905)的生长抑制作用及其最佳抑藻浓度范围的确定
黄花水龙化感物质以不同浓度梯度(0、25、50、75、150mg/L)分别投放到定量的铜绿微囊藻培养液中,同时进行抑藻效果测定。图1分别对应各浓度组每天的藻密度变化及其相对抑制率(IR)。根据图1a,在7d的培养期内,化感物质对铜绿微囊藻的生长抑制作用随着化感物质浓度的增加而逐渐增强。采用概率单位法拟合计算求得黄花水龙化感物质的 EC50,7d值为47mg/L,说明黄花水龙化感物质对铜绿微囊藻生长具有较强的抑制作用。但在培养后期,各浓度组的抑制率均呈下降趋势,说明化感物质对藻细胞的生长抑制作用会随着时间延长而逐渐减弱。这可能与化感物质中有效抑藻成分存在降解或转化作用(洪喻等,2009)有关,具体机理有待进一步探讨。
图1b的结果表明,不同浓度组的黄花水龙化感物质对铜绿微囊藻生长的影响作用也不同。其中对照组(0mg/L)随着时间延长藻细胞数目迅速增加(图1a);低浓度组(25mg/L)的化感物质在试验开始1—2d内对藻细胞生长反而起促进作用,IR在-6.7%—5.2%之间,3d后才逐渐表现出对藻细胞生长的抑制作用,但是IR始终低于25%,抑藻效果较差。整个培养期内,除低浓度组外,其余浓度组对铜绿微囊藻均呈现出较显著的生长抑制作用,这种低剂量促进、高剂量抑制和先促进后抑制的趋势,之前已有相关文献报道(何池全等,1999;刘光涛等,2011)。

图1 不同浓度的黄花水龙化感物质对铜绿微囊藻藻密度(a)和相对抑制率(b)的影响Fig.1 Influence of different concentrations of J.stipulacea allelochemicals on the algae density(a),the inhibition ratio(b)of M.aeruginosa
中浓度组(50mg/L)的黄花水龙化感物质在藻细胞培养4d时对藻细胞的IR就已达到60%,但是培养后期IR下降较快,藻细胞生长恢复明显。Nakai等(1999)研究发现,在一次性投加大型植物浸提液抑制铜绿微囊藻生长时,藻细胞在培养8d后即开始恢复生长,抑藻作用明显减弱,这与本研究得到的结果类似。而较高浓度组(75mg/L)和高浓度组(150mg/L)的黄花水龙化感物质对铜绿微囊藻的生长抑制变化趋势相类似,藻细胞培养3d时IR都已大于85%,培养后期IR虽有下降,但是较其他浓度组缓慢,化感物质仍发挥较好的抑藻作用。由此可知,虽然浓度越高对藻细胞生长的抑制作用越显著,但是当浓度达到一定值时,浓度增加对提高IR影响不大,75mg/L和150mg/L的抑藻效果差异不显著,出现了阈值效应,因此从节约原材料的角度考虑,75mg/L即可达到最好的抑藻效果。
综上所述,黄花水龙化感物质的最佳抑藻浓度范围应为 50—75mg/L,铜绿微囊藻在培养 4—7d内其相对抑制率可达50%—95%。化感物质之所以能够抑制藻细胞生长,估计与其能提高藻细胞的呼吸速率,降低光合作用速率,降低叶绿素a含量有关( 啟鲜鸣等,2005)。同时根据李锋民等(2007)的研究报道,化感物质在较低浓度时可以提高铜绿微囊藻的过氧化物酶、超氧化物歧化酶和脱氢酶的活性,而高浓度的化感物质则显著降低了这些酶的活性。抑制铜绿微囊藻的抗氧化酶体系并促进藻类叶绿素的降解可能是化感物质的抑藻机理之一(Qianet al,2009)。本实验同样发现,随着黄花水龙化感物质浓度的增加,且达到一定浓度范围后,铜绿微囊藻单位藻细胞的叶绿素a含量迅速减少,与藻密度的变化趋势一致,而叶绿素a含量与光合作用有关,从另一角度间接反映了化感物质的投加可以抑制藻类的光合作用,且化感物质浓度的高低与其抑藻活性显著相关。
2.2 黄花水龙化感物质对铜绿微囊藻(FACHB-905)MC-LR产生和释放的影响
2.2.1 黄花水龙化感物质对MC-LR释放的影响 投加黄花水龙化感物质7d后胞外培养液中MC-LR的浓度参见表1,而16d后培养液中的MC-LR浓度均未被检出,因此未列入表1。从表1可以看出,不论是对照组(0mg/L),还是其他浓度组(25—150mg/L),7d时胞外培养液中 MC-LR浓度都很低,小于 WHO推荐的饮用水体中MC-LR的最高限值1μg/L(Coddet al,2005);而藻细胞在培养 16d后开始进入生长稳定期,胞外培养液中MC-LR浓度均低于检测下限。这说明,在本试验16d的培养期内,黄花水龙化感物质的投加对铜绿微囊藻MC-LR的释放无显著影响。即使黄花水龙化感物质的浓度达到最大值150mg/L时,整个培养期内藻细胞向胞外释放的藻毒素的量还是很少,有时甚至无法检出。

表1 投加黄花水龙化感物质7d后胞外MC-LR的浓度Tab.1 Concentrations of extracellular MC-LR after adding J.stipulacea allelochemicals for 7 days
Robilllot等(2000)研究认为,无任何外界干扰情况下的藻细胞在培养前期胞外藻毒素浓度很低,可以忽略;进入稳定期前胞外藻毒素浓度都会维持在较低水平。本试验在藻细胞培养16d时即进入稳定期,对照组依然未能检测出胞外 MC-LR,意味着藻类在正常环境下向周围水体释放藻毒素的量并不多,而之所以目前存在许多藻毒素污染水体的问题,主要原因还是人们在施加化学杀藻剂时,引起死亡藻细胞内藻毒素的大量释放。有研究发现,当使用硫酸铜化学杀藻剂处理铜绿微囊藻水华时,水体中的 MCLR(即胞外 MC-LR)含量明显升高,严重威胁水域生态安全(Joneset al,1994)。而在本试验中,黄花水龙化感物质既能有效抑制铜绿微囊藻的生长,又不会引起藻细胞的胞内藻毒素向外释放,生态安全性高,因此可将黄花水龙化感物质应用至实际水华水体的处理中。
2.2.2 黄花水龙化感物质对MC-LR产生的影响 根据图2a,对照组(0mg/L)的单位藻细胞 MC-LR含量(用 106单位个数藻细胞内 MC-LR的质量来表示)与Wiedner等(2003)的测定结果在同一水平。培养7d后,随着黄花水龙化感物质浓度的增加,铜绿微囊藻培养液中单位藻细胞 MC-LR含量也随之增加,当化感物质浓度为50—150mg/L时,单位藻细胞MC-LR含量显著升高。

图2 不同浓度的黄花水龙化感物质对铜绿微囊藻的胞内MC-LR含量(a)、MC-LR产生总量(b)的影响Fig.2 Influence of different concentrations of J.stipulacea allelochemicals on the intracellular MC-LR(a)and total MC-LR(b)contents in M.aeruginosa
培养7d后,除低浓度组外,黄花水龙化感物质对铜绿微囊藻产生了较强的化感抑制作用,藻细胞生长速率明显减缓,藻密度一直维持在较低水平,且胞内MC-LR含量显著升高。由此可知,为了抵御化感物质产生的胁迫作用,存活下来的藻细胞会合成更多的藻毒素(Janget al,2003)。Kearns等(2000)研究认为,藻细胞的内部能量一方面用于合成自身生长所需的营养物质,另一方面还可用于抵御外界环境胁迫的影响,例如铜绿微囊藻藻细胞在化感物质的作用下会将更多的能量用于藻毒素的合成,从而导致自身生长速率变缓。
培养16d后,黄花水龙化感物质对铜绿微囊藻的生长抑制作用减弱,藻细胞开始恢复生长,此时单位藻细胞中MC-LR含量的变化受化感物质浓度的影响不显著。因此可以认为,培养16d后,黄花水龙化感物质对培养液中铜绿微囊藻胞内MC-LR产生的促进作用减弱,基本恢复到对照组水平。这可能与之前讨论中提到的化感物质存在天然降解和转化作用有关。
根据表1所示,铜绿微囊藻在整个试验期内向胞外释放的MC-LR含量极少,因此可不计入藻细胞MC-LR产生总量的计算中。单位藻细胞内MC-LR含量与相应藻密度的乘积即可作为MC-LR产生总量的结果。图2b的结果表明,随着黄花水龙化感物质浓度的增加,培养7d后藻细胞MC-LR产生总量逐渐降低,这可能是由于随着化感物质浓度的增加,虽然单位藻细胞内MC-LR的含量会有所升高,但是同时藻密度也在迅速降低,因而使得两者结合产生的MC-LR总量依然呈现下降趋势,可见影响MC-LR产生总量的主要因子应为藻密度测定值。培养16d后,除最高浓度组外,培养液中MC-LR的产生总量随化感物质浓度的增加变化不显著,和图2a反映的结果一致。150mg/L处理组在培养7d、16d时MC-LR产生总量都是所有浓度处理组中最低的,这可能是因为化感物质浓度越大,有效抑藻成分含量越多,即使到了16d,剩余的有效抑藻成分依然较其他浓度组多,对藻细胞生长还能发挥一定的抑制作用,从而使得MC-LR产生总量较其他浓度组要低。因此,在本实验投加黄花水龙化感物质抑制铜绿微囊藻生长过程中,随着化感物质浓度增加,不会使培养液中MC-LR产生的总量增大。
3 结论
(1)黄花水龙化感物质对铜绿微囊藻(FACHB-905)具有较强的生长抑制作用,EC50,7d值为47mg/L。培养1周内,随着黄花水龙化感物质浓度的增加,其抑藻效果逐渐增强,但是随着时间延长其抑藻效果也会逐渐减弱。黄花水龙化感物质的最佳抑藻浓度范围应为 50—75mg/L,在此浓度下培养 4—7d对铜绿微囊藻生长的相对抑制率可达50%—95%。此浓度范围可作为黄花水龙化感物质实际抑藻应用时一个有效剂量的参考值。
(2)整个培养期间,黄花水龙化感物质对铜绿微囊藻MC-LR的胞外释放无显著影响。培养7d后,单位藻细胞内 MC-LR的含量随化感物质浓度的增加而升高,16d后无显著影响。由此可知,黄花水龙化感物质既能有效抑制铜绿微囊藻的生长,又不会引起藻毒素的向外释放,生态安全性高,可应用至实际水体处理中。
致谢衷心感谢中国科学院水生生物研究所、湖州市环境保护监测中心站在提供铜绿微囊藻藻种(FACHB-905),以及微囊藻毒素(MC-LR)测定方面提供的一切指导与帮助!
王欣伊,阚振荣,王梅梅,2005.淡水藻类产毒研究进展.生物学杂志,22(2):5—9
刘光涛,周长芳,孙利芳等,2011.凤眼莲化感物质对铜绿微囊藻、斜生栅藻生长及细胞数相对比例的影响.环境科学学报,31(10):2303—2311
宋立荣,雷腊梅,何振荣等,1999.滇池水华蓝藻铜锈微囊藻和绿色微囊藻的生长生理特性及毒素分析.水生生物学报,23(5):402—408
何池全,叶居新,1999.石菖蒲(Acorus tatarinowii)的克藻效应的研究.生态学报,19(5):754—758
吴 湘,杨肖娥,李廷强等,2007.漂浮植物对富营养化景观水体的净化效果研究.水土保持学报,21(5):128—132
李锋民,胡洪营,种云霄等,2007.芦苇化感物质EMA对铜绿微囊藻生理特性的影响.中国环境科学,27(3):377—381
胡洪营,门玉洁,李锋民,2006.植物化感作用抑制藻类生长的研究进展.生态环境,15(1):153—157
洪 喻,胡洪营,黄晶晶等,2008.不同溶剂提取芦竹化感物质对铜绿微囊藻生长的影响.环境科学,29(11):3143—3147
洪 喻,胡洪营,2009.水生植物化感抑藻作用研究与应用.科学通报,54(3):287—293
鲜啟鸣,陈海东,邹惠仙等,2005.淡水水生植物化感作用研究进展.生态学杂志,24(6):664—669
Chen J Z,Liu Z L,Ren G J,2004.Control ofMicrocystis aeruginosaTH01109 with batangas mandarin skin and dwarf banana peel:technical note.Water SA,30:279—282
Codd G A,Morrison L F,Metcalf J S,2005.Cyanobacterial toxins:risk management for health protection.Toxicology and Applied Pharmacology,203(3):264—272
de Figueiredo D R ,Azeiteiro U M,Esteves S Met al,2004.Microcystin-producing blooms—a serious global public health issue.Ecotoxicology and Environmental Safety,59(2):151—163
Jang M H,Ha K,Joo G Jet al,2003.Toxin production of cyanobacteria is increased by exposure to zooplankton.Freshwater Biology,48(9):1540—1550
Jones G J,Orr P T,1994.Release and degradation of microcystin following algicide treatment of aMicrocystis aeruginosabloom in a recreational lake,as determined by HPLC and protein phosphatase inhibition assay.Water Research,28(4):871—876
Kearns K D,Hunter M D,2000.Green algal extracellular products regulate antialgal toxin production in a cyanobacterium.Environmental Microbiology,2(3):291—297
Nakai S,Inoue Y,Hosomi M,1999.Growth inhibition of blue-green algae by allelopathic effects of marophytes.Water Science and Technology,39(8):47—53
Qian H F,Xu X Y,Chen Wet al,2009.Allelochemical stress causes oxidative damage and inhibition of photosynthesis inChlorella vulgaris.Chemosphere,75(3):368—375
Robilllot C,Vinh J,Puiseux-Dao Set al,2000.Hepatotoxin production kinetics of the cyanobacteriumMicrocystis aeruginosaPCC7820,as determined by HPLC-mass spectrometry and protein phosphatase bioassay.Environmental Science and Technology,34(16):3372—3378
Wiedner C,Visser P M,Fastner Jet al, 2003.Effects of light on the microcystin content ofMicrocystisstrain PCC7806.Applied and Environmental Microbiology,69(3):1475—1481
