东海多环旋沟藻的形态特征和系统进化分析*
2014-03-09王红霞陆斗定何飘霞戴鑫烽李冬融
王红霞 陆斗定 何飘霞 戴鑫烽 夏 平 李冬融
(国家海洋局第二海洋研究所 国家海洋局海洋生态系统与生物地球化学重点实验室 杭州 310012)
多环旋沟藻(Cochlodinium polykrikoidesMargalef)为一种广布有毒藻,隶属于甲藻门(Dinophyta),甲藻纲(Dinophyceae),裸甲藻目(Gymnodiniales),裸甲藻科(Gymnodiniaceae),旋沟藻属(Cochlodinium)(陆斗定,2008)。该藻裸露,以单细胞、2个和4个细胞成串存在,偶尔有 8个和 16个细胞成串(Tomaset al,2008)。多环旋沟藻的同种异名有Cochlodinium heterolobatumSilva(Silva,1967),Cochlodiniumsp.Schütt(Kumadaet al,1980)和Cochlodinium catenatumOkamura(Hargraveset al,1981)。Iwataki等依据核糖体大亚基基因序列(LSU rDNA)所做的系统进化分析将多环旋沟藻分成了4支不同的地域亚型,包括东亚型(East Asian)、美国/马来西亚型(American/Malaysian)、菲律宾型(Philippines)和地中海型(Mediterranean)(Iwatakiet al,2008;Reneet al,2013)。目前,旋沟藻属已大约有 40种被描述,虽然其中一些在形态上相差甚大,但是都具有该属的特征,即横沟环绕细胞多于1.5 圈(Iwatakiet al,2007)。
Margalef(1961)于1961年首次对多环旋沟藻进行了描述。近年来,多环旋沟藻在全球的各个海域陆续被报道,此藻形成的有害赤潮事件通常伴有鱼类的大量死亡,已在大西洋西岸、西太平洋、东太平洋和印度洋发生(Gárate-Lizárragaet al,2000;Morales-Blakeet al, 2001;Matsuokaet al,2004,2009;Vargas-Monteroet al,2004;Antonet al,2008;Azanzaet al,2008;Gobleret al,2008;Tanget al,2009a,b)。另外,该藻在亚太地区的地理分布格局已明显增加,包括日本、韩国、菲律宾、沙巴和马来西亚的热带到亚热带海域(Reloxet al,2003;Azanzaet al,2005;Antonet al,2008)。1995年,在韩国由多环旋沟藻引发的赤潮导致的鱼类死亡造成了九千五百多万美元的经济损失(Kim,1997)。而 2008—2009年,发生在阿拉伯湾和阿曼湾的多环旋沟藻赤潮持续时间多达八个月之久,杀死了数千吨的养殖鱼(Richlenet al,2010)。
东海由于其特殊的地理条件和独特的富营养环境,已成为我国赤潮发生最严重的区域之一(张传松等,2008)。该海域赤潮暴发在时间和规模上均有所加剧,并且有毒有害藻在不断增加(苏纪兰,2001;周名江等,2001),比如新近报道的剧毒卡尔藻(Karlodinium veneficumJ.Larsen)(王红霞等,2011)。多环旋沟藻已在全球范围内扩张,加之其对鱼类的有毒特性,受到各国研究者的广泛关注。黄长江(2000)曾报道在1998年我国珠江口海域发生的大规模赤潮中发现了多环旋沟藻,但在其所拍该藻的光学照片中并未见其分类特征,而且与其相似的双胞旋沟藻(Cochlodinium geminatumSchütt)最近被报道在珠海发生赤潮(欧林坚等,2010;Shenet al,2012),因此并不能确定该藻为多环旋沟藻。本研究中将形态方法和分子方法相结合,对分离自我国东海的多环旋沟藻藻株进行了详细的分类学描述和分子系统发育分析,填补了我国在该藻分类学上的空白,为多环旋沟藻在我国海域及东亚地区的地理分布情况提供科学依据,进而为提高赤潮藻监测和预警质量奠定理论基础。
1 材料与方法
1.1 藻种的分离纯化和培养
实验所用藻种分离于2011年7月在东海温岭海域所采的赤潮水样。藻株分离采用逐级稀释法并结合毛细管分离法,获得单细胞藻株(实验室编号为LAMB110745)。藻种分离培养的条件是温度25°C,盐度为30—31,光暗循环为L︰D=12︰12,光照强度为100mol/(m2·s)。
1.2 样品处理与形态观察
1.2.1 光学和荧光显微镜 利用光学显微镜(OLYMPUS CX31)观察多环旋沟藻的活体藻细胞达到一定的密度后,取少许处于生长指数期的藻液,用鲁哥染液固定,然后选取 50个藻细胞进行测量。在荧光显微镜(LEICA DM5000B)下观察多环旋沟藻细胞的叶绿体形态及分布。
1.2.2 扫描电镜 吸取指数期的藻液5mL于离心管中,离心5min(1343×g),收集大约0.5mL浓缩的藻液,然后用锇酸固定1.5h,并用去离子水进行洗脱。随后用一系列浓度梯度(10%、30%、50%、70%、80%、90%和95%)的酒精各脱水15min(De Salaset al,2008),接着用 100%的酒精和 100%的丙酮各脱水两次。处理完后进行临界点干燥和喷金,最后在扫描电镜(HITA CHIS-3000N)下观察结果。
1.3 分子测序与系统进化分析
1.3.1 分子测序 取指数期藻培养液 50mL,离心10min(1343×g),收集藻细胞沉淀并将其转移至 EP(eppendorf tube)管中。然后利用UNIQ-10柱式植物基因组DNA抽提试剂盒提取总DNA。提取的DNA序列作为PCR的模板来扩增大约900bp的LSU rDNA序列,扩增引物为D1RF和D3Car(Mikulskiet al,2005)。PCR的反应体系为 50µL,包括正向引物 D1RF和反向引物D3Car各1µL,10X缓冲液5µL,dNTP混合液4µL,TaqDNA聚合酶0.5µL,基因组DNA提取液2µL,最后加无菌双蒸水至 50µL。PCR的基本程序为:预变性:95°C,5min;94°C,1min;55°C,1min;72°C,2min;30个循环;延伸:72°C,5min。PCR产物用琼脂糖凝胶进行电泳,然后用浓度为 0.5%的 EB(溴化乙锭)染色,最后在凝胶成像分析仪下进行凝胶成像与图谱分析。条带清晰的序列送至生工生物工程(上海)股份有限公司测序。
1.3.2 系统进化分析 所测得的核糖体大亚基D1—D3区序列先在NCBI中与其他藻株的序列进行比对。然后采用 ClustalW 软件包进行多序列匹配排列。其次利用Mega4.1软件包,根据“Kimura双参数”法则,采用 Neighbor-joining(NJ)方法,构建系统发育树,各分支的重复数均为1000。Jukes-Cantor距离矩阵的构建,则是用 Mega4.1软件包,采用 NJ法,Jukes-Cantor方式计算而获得。
2 结果
2.1 细胞形态特征
2.1.1 光学和荧光显微镜下细胞形态特征 多环旋沟藻东海藻株(LAMB110745)单细胞的大小为长25—36µm,宽16—22µm。在光学显微镜下可看到细胞呈链状形态,横沟较深且环绕细胞,纵沟较细随着横沟延伸(图1a)。细胞核较大,位于上锥,叶绿体呈条状或短棒状分布于整个细胞中(图1b)。在荧光显微镜下可清晰看到多环旋沟藻的叶绿体为棒状,数量较多并呈簇状分布(图1c)。
2.1.2 扫描电镜下细胞形态特征 在扫描电镜下多环旋沟藻的单细胞上锥的顶端为圆锥形,下锥为半球形。从细胞腹面观可见横沟宽且深,左旋绕细胞两圈,而且鞭毛镶嵌在横沟中。纵沟细且浅,在上锥与横沟平行环绕细胞,在下锥则发生错位延伸至细胞底部浅裂端(图2a)。而从细胞背面观可见横沟在上下锥各绕细胞一圈,在上锥纵沟在横沟下面紧挨着横沟延伸(图2d)。在细胞的顶部有两条细且长的顶沟,并行排列(图2b)。从细胞的背顶面可清楚看到两条顶沟在最后端由一条短且细的沟相连,呈U形(图2e)。成串的前面细胞上锥较尖,下锥圆且扁,后面细胞的上锥钝圆且末端浅裂。细胞在经向稍被压缩,横沟纵沟清晰可见,在细胞的底部伸出一根细且长的鞭毛(图2c)。

图1 光学和荧光显微镜下多环旋沟藻(LAMB110745)的细胞形态Fig.1 Light micrographs and laser scanning images of Cochlodinium polykrikoides (LAMB110745)
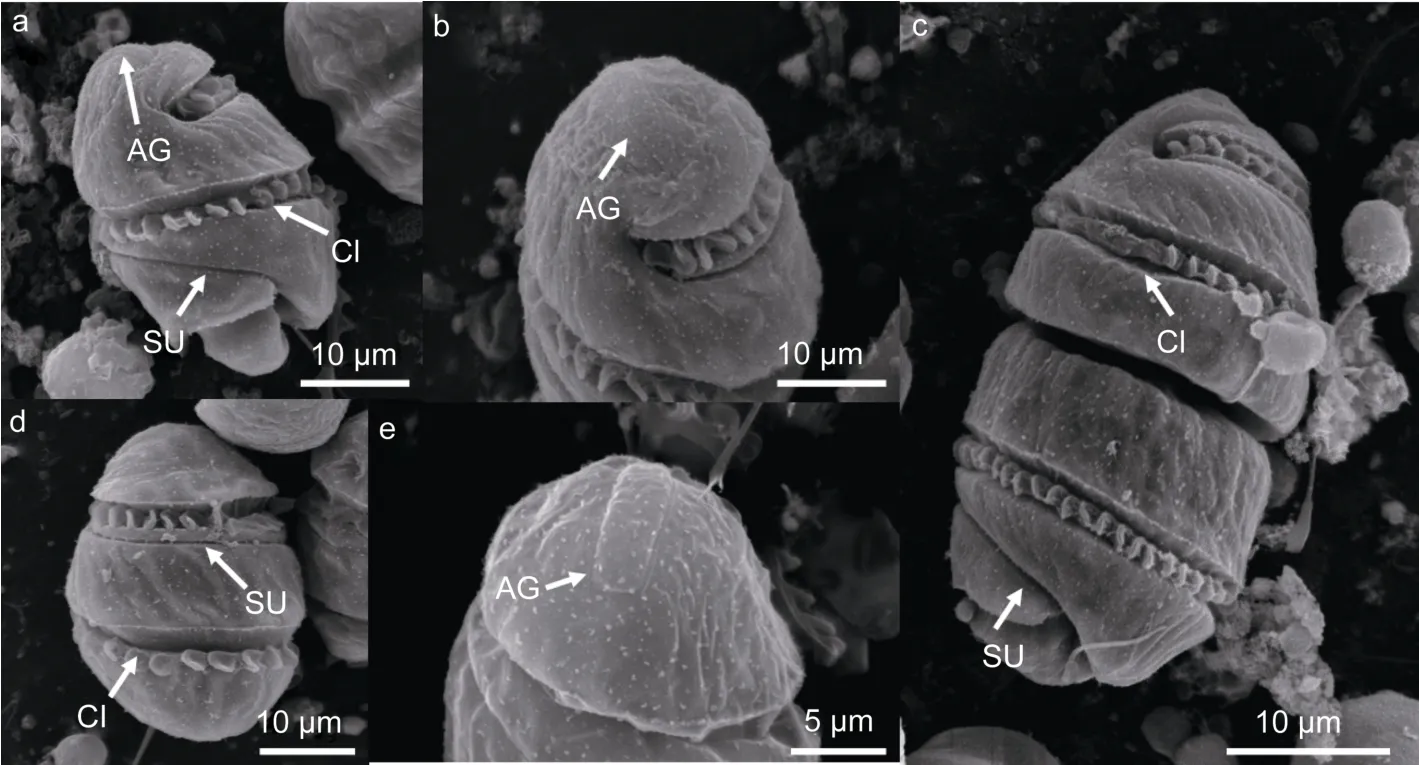
图2 扫描电镜下多环旋沟藻(LAMB110745)的细胞形态Fig.2 Scanning electron images of C.polykrikoides(LAMB110745)
2.2 系统进化关系
通过正序引物“D1RF”和倒序引物“D3car”对东海藻株多环旋沟藻(LAMB110745)的核糖体大亚基D1—D3区进行扩序,获得870bp的分子序列。将所获得的D1—D3区序列与GenBank中其他已报道的多环旋沟藻 D1—D3区序列进行比对可知,藻株LAMB110745与香港藻株(EF506623)相似度为100%,无碱基差异。
以Azadinium poporum(KC286552)为种外群,用邻接法构建系统发育树。从系统发育树上可知,东海藻株(LAMB110745)与GenBank中的韩国藻株(EF506618、AY725423、EF506620、EF506622、AY347309)、日本藻株(AB295045、AB288383)以及香港藻株(EF506623)聚在一起,且支持率为 100%,表明它们同属于东亚型。另外,属于美国/马来西亚型的 6株多环旋沟藻,属于地中海型的6株和属于菲律宾型的2株藻株均以高支持率聚在一起,表明多环旋沟藻藻株具有明显的地域差异。
利用 Mega4.1软件包构建系统发育分析中各藻株间的遗传距离矩阵(表1)。多环旋沟藻东海藻株(LAMB110745)与同属于东亚型的香港、韩国和日本藻株亲缘关系近,遗传距离均为 0.000。而与美国/马来西亚型和菲律宾型的多环旋沟藻藻株的亲缘关系次之,这与系统发育树相吻合。测序的东海藻株多环旋沟藻与种外群Azadinium poporum亲缘关系最远,遗传距离为0.121。
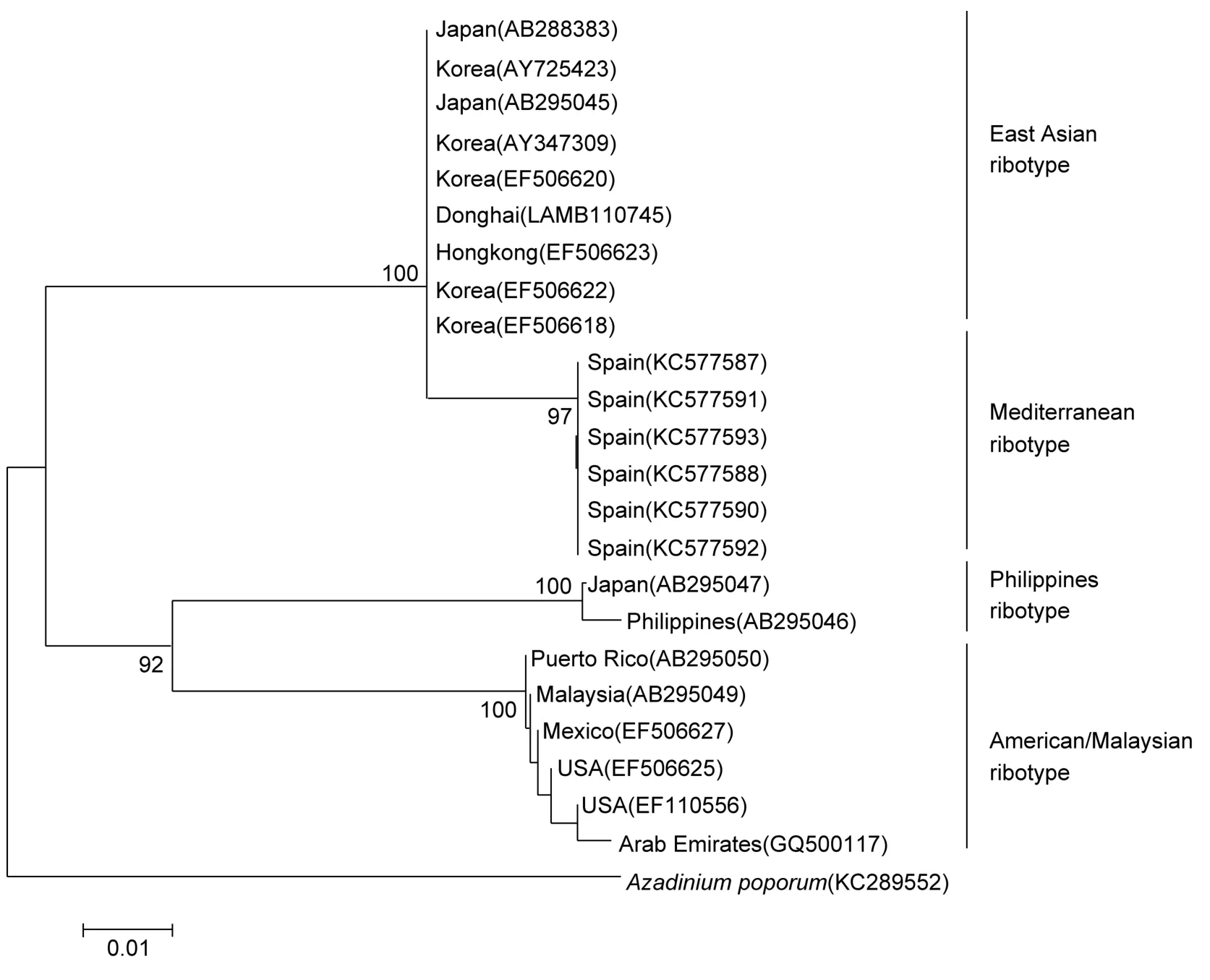
图3 基于核糖体大亚基D1—D3区所构建的多环旋沟藻的系统发育树Fig.3 Phylogenetic trees of the C. polykrikoides based on the D1—D3 rDNA sequences
3 讨论
有研究指出,多环旋沟藻的细胞形态和形成的赤潮周期存在密切关系(Tomaset al,2008)。此外,有效证据表明旋沟藻属可产生暂时性和休眠性孢子,这可能与它们的生活史相关,并导致该属在全球扩张(Kudelaet al,2012)。
在对多环旋沟藻的鉴定和识别中,形态特征很重要,包括细胞大小和形状,棒状叶绿体和横沟的旋转度,横沟绕细胞 1.8—1.9圈(Faustet al,2002;Matsuokaet al,2008)。从马来西亚分离得到的多环旋沟藻标本长 50µm,而从日本、韩国和美国东北部分离的藻株较小些,为 30—40µm(Matsuokaet al.,2008)。此外,Anton等(2008)报道的分离于马来西亚沙巴州的多环旋沟藻藻株长为28—40µm,宽为20—22µm。该藻株与本研究中的东海藻株单细胞个体大小相近,可能是实验室培养条件没有达到最佳或是细胞处于生长前期所致。阿拉伯湾分离的多环旋沟藻藻株横沟绕细胞1.6—1.9圈(Richlenet al,2010),而报道的马来西亚沙巴州的藻株横沟绕细胞近两圈,与东海藻株相似。棒状叶绿体对区分多旋旋沟藻与相似种褐色旋沟藻(Cochlodinium fulvescensIwataki,Kawami and Matsuoka)和卷曲旋沟藻(Cochlodinium convolutumKofoid and Swezy)至关重要。多环旋沟藻东海藻株的叶绿体为棒状,且呈簇状并行分布。此外,多环旋沟藻的顶沟呈 U形,且在细胞的背面与纵沟的延伸部分相连。在被描述的顶沟形态中,裸甲藻马蹄状的顶沟和多环旋沟藻的有些相似(Iwatakiet al,2010)。
Shao等(2004)从分子方面很好地证实了旋沟藻(Cochlodinium)与裸甲藻(Gymnodinium)、前沟藻(Amphidinium)、环沟藻(Gyrodinium)、卡尔藻(Karlodinium)及凯伦藻(Karenia)有明显的差异。多环旋沟藻与杀鱼费氏藻(Pfisteria piscicidaSteidinger and Burkholder)和红色赤潮藻(Akashiwo sanguineaG.Hansen and Moestrup)聚成一支,更亲近些。基于LSU rDNA所做的系统进化分析可区分旋沟藻属的多环旋沟藻和褐色旋沟藻,且褐色旋沟藻是多环旋沟藻的姐妹群,亲缘关系较近(Iwatakiet al,2008)。有研究指出,核糖体大亚基D1—D3区适用于多环旋沟藻种内藻株间水平的鉴定(Kiet al,2008)。本实验选取 LSU rDNA D1—D3区作为分子指标来区分多环旋沟藻藻株不同的地域亚型,通过系统进化分析比较得出多环旋沟藻东海藻株(LAMB110745)属于东亚型。

多环旋沟藻为有毒有害赤潮藻,加之其在全球的扩张,对沿海区的渔业、生态环境和旅游业造成严重影响,已引起各国研究者的广泛关注。但是因其在形态结构上与旋沟藻属其他藻种相似,且这些藻很难进行培养,所以很难精确地对其进行分类鉴定。本研究对多环旋沟藻东海藻株进行了光学形态、显微结构和分子系统进化方面的分析,而关于其个体生态学、毒理学特性及扩张机制等有待进一步研究。
王红霞,陆斗定,黄海燕等,2011.东海剧毒卡尔藻的形态特征及其系统进化分析.植物学报,46(2):179—188
苏纪兰,2001.中国的赤潮研究.中国科学院院刊,16:339—342
张传松,王江涛,朱德弟等,2008.2005年春夏季东海赤潮过程中营养盐作用初探.海洋学报,30(2):153—159
陆斗定,2008.甲藻门(Phylum Dinophyta,Pyrrophyta).刘瑞玉编著.中国海洋生物名录.北京:科学出版社,175
欧林坚,张玉宇,李 扬等,2010.广东珠海双胞旋沟藻Cochlodinium geminatum赤潮事件分析.热带海洋学报,29(1):57—61
周名江,朱明远,张 经,2001.中国赤潮的发生趋势和研究进展.生命科学,13(2):54—59
黄长江,董巧香,2000.1998年春季珠江口海域大规模赤潮原因生物的形态分类和生物学特征 Π.海洋与湖沼,31(3):233—238
Anton A,Teoh P L,Mohd-Shaleh S Ret al,2008.First occurrence ofCochlodiniumblooms in Sabah,Malaysia.Harmful Algae,7(3):331—336
Azanza R V,David L T,Borja R Tet al,2008.An extensiveCochlodiniumbloom along the western coast of Palawan,Philippines.Harmful Algae,7(3):324—330
Azanza R V,Baula I U,2005.Fish kills associated withCochlodiniumblooms in Palawan,the ‘‘last frontier’’ of the Philippines.Harmful Algae News,29:13—14
De Salas M F,Laza-Martínez A,Hallegraeff G M,2008.Novel unarmored dinoflagellates from the toxigenic family Karrniaceae(Gymnodiniales):five new species ofKarlodiniumand one newTakayamafrom the Australian sector of the southern ocean. Journal of Phycology,44(1):241—257
Faust M A,Gulledge R A,2002.Identifying harmful marine dinoflagellates.Smithsonian Institution Contributions from the United States National Herbarium,42:1—144
Gárate-Lizárraga I,Bustillos-Guzmán J J,Morquecho Let al,2000.First outbreak ofCochlodinium polykrikoidesin the Gulf of California.Harmful Algae News,21:7
Gobler C J,Berry D L,Anderson O Ret al,2008.Characterization,dynamics,and ecological impacts of harmfulCochlodinium polykrikoidesblooms on eastern Long Island,NY,USA.Harmful Algae,7(3):293—307
Hargraves P E,Víquez R,1981.The dinoflagellate red tide in Golfo Nicoya,Costa Rica.Revista de Biologia Tropical,29(1):31—38
Iwataki M,Hansen G,Moestrup Øet al,2010.Ultrastructure of the harmful unarmored dinoflagellateCochlodinium polykrikoides(Dinophyceae)with reference to the apical groove and flagellar apparatus.Harmful Algae,57(4):308—321
Iwataki M,Kawami H,Mizushima Ket al,2008.Phylogenetic relationships in the harmful dinoflagellateCochlodinium polykrikoides(Gymnodiniales,Dinophyceae)inferred from LSU rDNA sequences.Harmful Algae,7(3):271—277
Iwataki M,Kawami H,Matsuoka K,2007.Cochlodinium fulvescenssp.nov.(Gymnodiniales,Dinophyceae),a new chain-forming unarmored dinoflagellate from Asian coasts.Phycological Research,55(3):231—239
Ki J S,Han M S,2008.Implications of complete nuclear large subunit ribosomal RNA molecules from the harmful unarmored dinoflagellateCochlodinium polykrikoides(Dinophyceae)and relatives.Biochemmical Systematics and Ecology,36(7):573—583
Kim H G,1997.Recent harmful algal blooms and mitigation strategies in Korea.Ocean Research(Seoul),19:185—192
Kudela R M,Gobler C J,2012.Harmful dinoflagellate blooms caused byCochlodiniumsp.:Global expansion and ecological strategies facilitating bloom formation.Harmful Algae,14:71—86
Kumada K,Takeda K,Aramaki T,1980.Yatsushiro Kaiiki,Tatsushiro Kai-2.In:Fisheries Agency,Fukuokaken Suisan Shikenjou,Sagaken Suisan Shikenjou,Nagasakiken Suisan Shikenjou,Kumamotoken Suisan Shikenjou,Kagoshimaken Suisan Shikenjou eds.Kyushu Seikaiiki Akashio Yosatsu Chosa Hokokusho,125—136
Margalef R,1961.Hidrografia y fitoplancton de un area marina de la costa meridionale de Puerto Rico.Investigaciones Pesqueras,18:33—96
Matsuoka K,Iwataki M,2009.Taxonomy and geographical distribution of the harmful dinoflagellateCochlodinium polykrikoides.Bulletin of Plankton Society of Japan,56:27—30
Matsuoka K,Iwataki M,Kawami H,2008.Morphology and taxonomy of chainforming species of the genusCochlodinium(Dinophyceae).Harmful Algae,7(3):261—270
Matsuoka K,Iwataki M,2004.Present status in study on a harmful unarmored dinoflagellateCochlodinium polykrikoidesMargalef.Bulletin of Plankton Society of Japan,51:38—45
Mikulski C M,Morton S L,Doucette G J,2005.Development and application of LSU rRNA probes forKarenia brevisin the Gulf of Mexico,USA.Harmful Algae,4(1):49—60
Morales-Blake A,Cavazos-Guerra C,Hernández-Becerril D,2001.Unusual HABs in Manzanillo Bay,Colima,Mexico.Harmful Algae News,22:6
Relox J J R,Bajarias F F A,2003.Harmful algal blooms(HABs)in the Philippines.In:Furuya K,Fukuyo Y eds.Extended Abstracts of Workshop on Red Tide Monitoring in Asian Coastal Waters.University of Tokyo,Tokyo,Japan,March 10—12:65—68
Rene A,Garces E,Camp J,2013.Phylogenetic relationships ofCochlodinium polykrikoidesMargalef(Gymnodiniales,Dinophyceae)from the Mediterranean Sea and the implications of its global biogeography.Harmful Algae,25:39—46
Richlen M L,Morton S L,Jamali E Aet al,2010.The catastrophic 2008—2009 red tide in the Arabian gulf region,with observations on the identification and phylogeny of the fish-killing dinoflagellateCochlodinium polykrikoides.Harmful Algae,9(2):163—172
Silva S E,1967.Cochlodinium heterolobatumn.sp:Structure and some cytophysiological aspects.Journal of Protozool,14(4):745—754
Shao P,Chen Y Q,Zhou Het al,2004.Genetic variability inGymnodiniaceaeITS regions:implications for species identification and phylogenetic analysis.Marine Biology,144(2):215—224
Shen P P,Li Y N,Qi Y Zet al,2012.Morphology and bloom dynamics ofCochlodinium geminatum(Schütt)in the Pearl River Estuary,South China Sea.Harmful Algae,13:10—19
Tang Y Z,Gobler C J,2009a.Characterization of the toxicity ofCochlodinium polykrikoidesisolates from Northeast U.S.estuaries to finfish and shellfish.Harmful Algae,8(3):454—462
Tang Y Z,Gobler C J,2009b.Cochlodinium polykrikoidesblooms and clonal isolates from the northwest Atlantic coast cause rapid mortality in larvae of multiple bivalve species.Marine Biology,156(12):2601—2611
Tomas C R,Smayda T J,2008.Red tide blooms ofCochlodinium polykrikoidesin a coastal cove.Harmful Algae,7(3):308—317
Vargas-Montero M,Freer E,Jiménez-Montealegre Ret al,2004.Extensive blooms due toCochlodinium polykrikoides:new to Costa Rica.Harmful Algae News,26:7
